
- •Методичні рекомендації
- •Техніка безпеки в лабораторії аналітичної хімії
- •Перша допомога при нещасних випадках
- •Лабораторне устаткування.
- •Модуль і Лабораторна робота № 1
- •Катіони і групи
- •Часткові реакції катіонів і групи
- •1. Дія гідротартрату натрію NaHc4h4o6
- •2. Дія натрій (ііі) гексанітрокобальтату
- •2. Реакція Несслера
- •Вивчення загальних і часткових реакцій
- •Дія групового реагенту II групи
- •Часткові реакції катіонів II групи
- •1. Реакція з калій хроматом к2СгО4
- •2. Реакція з н2sо4 і її розчинними солями
- •1. Реакція з амоній оксалатом (nн4)2с2о4
- •2. Реакція з н2sо4 і її розчинними солями
- •1. Реакція з їдкими лугами
- •Реакція з натрій гідрофосфатом
- •Дія групового реагента
- •Часткові реакціі катіонів III групи
- •1. Дія їдких лугів
- •1. Дія їдких лугів
- •2. Дія калій гексаціаноферрата(II) к4[Fe(cn)6]
- •3. Дія роданистих солей nh4cns або kcns
- •1. Дія їдких лугів
- •2. Дія калій гексаціаноферрата (III) k3[Fe(cn)6]
- •1. Дія їдких лугів
- •1. Дія їдких лугів
- •2. Дія розчину аміаку nh4oh
- •3. Дія сірководню h2s
- •Лабораторна робота № 4
- •Аналітична класифікація аніонів
- •І група аніонів
- •Лабораторна робота № 5
- •III група аніонів
- •Реакції аніона нітратної кислоти nо3-
- •Реакція з сульфатом двовалентного заліза
- •2. Реакція з алюмінієм (або цинком) і лугом
- •Реакція аніона нітритної кислоти no2-
- •Модуль іі Лабораторна робота № 6
- •Теоретичні передумови до виконання роботи
- •Метод нейтралізації
- •Експериментальна частина
- •1. Розрахунок і приготування 250 мл розчину h2so4 молярної концентрації еквівалента 0,1 моль/л.
- •Хід роботи
- •2. Стандартизація розчину h2 so4 по бурі. Хід роботи
- •Контрольні питання
- •Лабораторна робота № 7
- •Експериментальна частина Хід роботи
- •Контрольні питання
- •Лабораторна робота № 8
- •Теоретичні передумови до виконання роботи
- •Експериментальна частина Хід роботи
- •Контрольні питання
- •Лабораторна робота № 9
- •Теоретичні передумови до виконання роботи
- •Перманганатометрія
- •Експериментальна частина Хід роботи
- •Лабораторна робота № 10
- •Хід роботи
- •Контрольні питання
- •Лабораторна робота № 11
- •Теоретичні передумови до виконання роботи
- •Експериментальна частина Визначення вмісту йоду у водному розчині калій йодиду
- •Хід роботи
- •Контрольні питання
- •Контрольні завдання по темі «Окисно-відновне титрування»
- •Список рекомендованої літератури
- •Додатки
- •73006, М. Херсон, вул. Р. Люксембург, 23
Теоретичні передумови до виконання роботи
До методів окисно-відновного титрування (редоксіметрії) відносять методи об’ємних визначень, засновані на окисно-відновних реакціях. За допомогою цих методів можливо кількісно визначити окисники і відновники, а також речовини, що з ними реагують.
В якості робочих розчинів в методах окисно-відновного титрування застосовують розчини різних окисників і відновників.
В залежності від робочих розчинів методи окиснення і відновлення розділяються на декілька груп. Основні серед них слідуючі:
Перманганатометрія. Робочим розчином являється калій перманганат KMnO4.
Хроматометрія. Робочим розчином являється калій біхромат K2Cr2O7.
Йодометрія. Робочим розчином являється розчин йоду в калії йодистому і розчин натрій тіосульфату Na2S2O3.
Йон, який потрібно визначити, повинен бути або окисником, або відновником, а робочий розчин — або відновником, або окисником, відповідно. В процесі титрування між розчином, який аналізують, та робочим розчином відбувається окисно-відновна реакція. Точка еквівалентності визначається за допомогою редокс-індикаторів, але іноді індикатором може бути робочий розчин, або розчин, який титрують.
Хімічна активність окисників та відновників в розчині характеризується значенням редокс-потенціалу, який визначають по відношенню до стандартного водневого електроду E2H/H2 при температурі 25 °C в стані рівноваги (окс=ред.)=1. Редокс-пара з більшим стандартним електродним потенціалом буде окисником по відношенню до пари з меншим потенціалом. Наприклад, в реакції:
MnO4ˉ + Clˉ + H+ → Mn²+ + Cl2 + H2O
Пара MnO4ˉ/ Mn²+ (Е0 MnO4ˉ/ Mn² = 1,51B) є окисником по відношенню до пари Cl2/ 2Clˉ (Е0 Cl2/2Clˉ = 1,36B).
Окисно-відновні реакції відбуваються лише тоді, коли різниця стандартних електродних потенціалів двох (окислювально-відновних) пар, які беруть участь в реакції, досить велика. Ступінь зміщення редокс-реакції в прямому чи зворотному напрямку залежить від константи рівноваги, яку розраховують за формулою:
LgK =(Eo - E˝o)*n/0.059 (1)
де, К - константа рівноваги;
Ео та Ео˝ - стандартні електродні потенціали, В;
n – число електронів, що перемістилися (відданих або прийнятих).
З формули (1) витікає, що константа рівноваги прямо пропорційна різниці стандартних редокс-потенціалів: чим вона більша, тим вірогідніше протікає реакція в потрібному напрямку.
Перманганатометрія
Перманганатометрією називають метод титрометричного аналізу, в якому робочим розчином служить розчин калій перманганату KMnO4.
В процесі титрування аналізуємого розчину малиново-фіолетове забарвлення розчину перманганату зникає. Однак, після досягнення точки еквівалентності перша ж надлишкова крапля розчину перманганату забарвлює титруєму рідину в блідо-малиновий колір. Індикатором в даному випадку являється сам перманганат калію. Тому при перманганатометричних визначеннях сторонні індикатори не добавляють.
Калій перманганат володіє сильними окисними властивостями. Марганець в ступені окиснення 7+ може змінювати ступінь окиснення до 2+, 4+, 6+. Зниження ступеня окиснення залежить від середовища, в якому протікає реакція.
В кислому (pH<7) MnO4ˉ → Mn²+ Е0 MnO4ˉ/ Mn²+ = 1.51B
В лужному (pH>7)MnO4ˉ → MnО4²ˉ Е0 MnO4ˉ/ MnО4²ˉ=0,56В
В нейтральному (pH=7)MnO4ˉ→MnО2 Е0 MnO4ˉ/ Mn =0.59B
Кисле середовище
2KMnO4 + 5NaNO2 + 3H2SO4 → K2SO4+5NaNO3 + 3H2O + 2MnSO4
Mn+7 +5e → Mn²+ fекв. = 1/5
5 N+3 -2e → N+5 fекв. = ½
Me(KMnO4) = M(KMnO4)/5 Me(KMnO4) = 31,6 г/моль
Me(NaNO2) = M(NaNO2)/2 Me(NaNO2) = 34,5 г/моль
Середовище лужне.
2KMnO4 + NaNO2 + 2KOH → NaNO3 + H2O + 2K2MnO4
2 Mn+7
+1e
→ Mn+6
fекв
= 1
Mn+7
+1e
→ Mn+6
fекв
= 1
1 N+3 -2e → N+5 fекв = 1/2
Me(KMnO4 )= M(KMnO4)/1 Me(KMnO4) = 158 г/моль
Me(NaNO2) = M(NaNO2)/2 Me(NaNO2) = 34.5 г/моль
Нейтральне середовище
2KMnO4 + 3NaNO2 + 2H2O → 2MnO2 + 3NaNO3 + 2KOH
2 Mn+7
+3e
→ Mn+4
fекв.
= 1/3
Mn+7
+3e
→ Mn+4
fекв.
= 1/3
3 N+3 -2e → N+5 fекв. = ½
Me(KMnO4) = M(KMnO4)/3 Me(KMnO4) = 52,7 г/моль
Me(NaNO2) = M(NaNO2)/2 Me(NaNO2) = 34,5 г-моль
Перманганатометрію використовують для кількісного визначення відновників прямим титруванням та окисників – методом оберненого титрування, коли до аналізуємого розчину окисника доливають надлишок допоміжного розчину відновника з відомим титром, а залишок відновника відтитровують розчином KMnO4.
Визначення молярних мас еквівалентів окисників і відновників має свої особливості. Фактор еквівалентності елементу (fекв) визначається за кількістю відданих або прийнятих електронів в електронному балансі окисно-відновного рівняння. Молярна маса еквівалента речовини визначається за формулою:
Ме(х) = М(х)/n,
де n - число електронів.
Перманганатометричним методом визначають в агрохімії вміст заліза (ІІ) в ґрунтах; визначають Са²+ в ґрунті і у витяжках із біологічних матеріалів.
Титрований
розчин
![]() неможливо
приготувати розчиненням точної наважки,
оскільки він містить домішки і витрачається
на окиснення аміаку, органічних речовин,
що присутні у воді, і розкладається за
рівнянням реакції:
неможливо
приготувати розчиненням точної наважки,
оскільки він містить домішки і витрачається
на окиснення аміаку, органічних речовин,
що присутні у воді, і розкладається за
рівнянням реакції:
![]()
Тому
точну концентрацію
![]() визначають через 7-10 днів після приготування
розчину шляхом стандартизації свіже
перекристалізованою щавелевою(оксалатною)
кислотою
визначають через 7-10 днів після приготування
розчину шляхом стандартизації свіже
перекристалізованою щавелевою(оксалатною)
кислотою![]() .
.
Приготування
розчину
![]()
Припустимо, що для роботи потрібно приготувати 0,5 л розчину молярної концентрації еквівалента = 0,03 моль/л.
Розрахунок
необхідної маси
![]()
Дано:![]()

![]() =500
мл
=500
мл
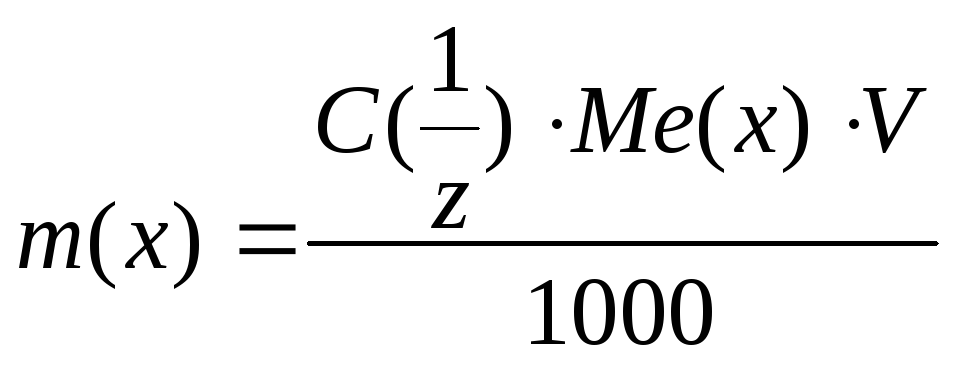
![]() =
0, 03 моль/л
=
0, 03 моль/л

![]()
![]() =
?
=
?
Згідно
розрахунку потрібна маса
![]() 0,47
г.
0,47
г.
Проте,
з урахуванням окислювальних процесів,
треба зважити на технічних терезах
0,47 + 0,3 = 0,77 г
![]() ,
цю наважку розчиняють у плоскодонній
колбі в 500 мл дистильованої води при
перемішуванні (воду видмірюють мірним
циліндром).
,
цю наважку розчиняють у плоскодонній
колбі в 500 мл дистильованої води при
перемішуванні (воду видмірюють мірним
циліндром).
Через
7-10 діб розчин стабілізується. Одержаний
розчин
![]() обережно зливають сифоном в посудину
з темного скла з притертою пробкою.
обережно зливають сифоном в посудину
з темного скла з притертою пробкою.
