
- •Методичні рекомендації
- •Техніка безпеки в лабораторії аналітичної хімії
- •Перша допомога при нещасних випадках
- •Лабораторне устаткування.
- •Модуль і Лабораторна робота № 1
- •Катіони і групи
- •Часткові реакції катіонів і групи
- •1. Дія гідротартрату натрію NaHc4h4o6
- •2. Дія натрій (ііі) гексанітрокобальтату
- •2. Реакція Несслера
- •Вивчення загальних і часткових реакцій
- •Дія групового реагенту II групи
- •Часткові реакції катіонів II групи
- •1. Реакція з калій хроматом к2СгО4
- •2. Реакція з н2sо4 і її розчинними солями
- •1. Реакція з амоній оксалатом (nн4)2с2о4
- •2. Реакція з н2sо4 і її розчинними солями
- •1. Реакція з їдкими лугами
- •Реакція з натрій гідрофосфатом
- •Дія групового реагента
- •Часткові реакціі катіонів III групи
- •1. Дія їдких лугів
- •1. Дія їдких лугів
- •2. Дія калій гексаціаноферрата(II) к4[Fe(cn)6]
- •3. Дія роданистих солей nh4cns або kcns
- •1. Дія їдких лугів
- •2. Дія калій гексаціаноферрата (III) k3[Fe(cn)6]
- •1. Дія їдких лугів
- •1. Дія їдких лугів
- •2. Дія розчину аміаку nh4oh
- •3. Дія сірководню h2s
- •Лабораторна робота № 4
- •Аналітична класифікація аніонів
- •І група аніонів
- •Лабораторна робота № 5
- •III група аніонів
- •Реакції аніона нітратної кислоти nо3-
- •Реакція з сульфатом двовалентного заліза
- •2. Реакція з алюмінієм (або цинком) і лугом
- •Реакція аніона нітритної кислоти no2-
- •Модуль іі Лабораторна робота № 6
- •Теоретичні передумови до виконання роботи
- •Метод нейтралізації
- •Експериментальна частина
- •1. Розрахунок і приготування 250 мл розчину h2so4 молярної концентрації еквівалента 0,1 моль/л.
- •Хід роботи
- •2. Стандартизація розчину h2 so4 по бурі. Хід роботи
- •Контрольні питання
- •Лабораторна робота № 7
- •Експериментальна частина Хід роботи
- •Контрольні питання
- •Лабораторна робота № 8
- •Теоретичні передумови до виконання роботи
- •Експериментальна частина Хід роботи
- •Контрольні питання
- •Лабораторна робота № 9
- •Теоретичні передумови до виконання роботи
- •Перманганатометрія
- •Експериментальна частина Хід роботи
- •Лабораторна робота № 10
- •Хід роботи
- •Контрольні питання
- •Лабораторна робота № 11
- •Теоретичні передумови до виконання роботи
- •Експериментальна частина Визначення вмісту йоду у водному розчині калій йодиду
- •Хід роботи
- •Контрольні питання
- •Контрольні завдання по темі «Окисно-відновне титрування»
- •Список рекомендованої літератури
- •Додатки
- •73006, М. Херсон, вул. Р. Люксембург, 23
Хід роботи
В мірну колбу на 250 мл налийте 100-150 мл дистильованої води. Залийте кислоту в бюретку і відмірте об’єм H2 SO4, який розрахували, в цю мірну колбу. Доведить об’єм дистильованою водою до мітки по ніжньому меніску. Закрийте пробкою і ретельно перемішайте.
2. Стандартизація розчину h2 so4 по бурі. Хід роботи
Промийте бюретку і, користуючись лійкою, заповніть бюретку кислотою. Зніміть лійку і злийте залишки кислоти, встановивши нижній край меніска на нульовій поділки.
Чисту піпетку місткістю 10 мл промийте розчином бури. Відмірьте 10 мл розчину бури і перенесіть в конічну колбу для титрування місткістю 100 мл.
Прилийте до розчину бури 2-3 краплі розчину метилового оранжевого.
Відтитруйте розчин бури кислотою до появи слабкорозового забарвлення.
Повторіть титрування тричі, причому значення об’ємів кислоти повинні відрізнятись одне від одного не більш, ніж на 0,1 мл.
Результати титрування запишіть в таблицю і обчисліть молярну концентрацію еквівалента та титр розчину H2 SO4.
|
№ титрування |
Стандартний розчин бури Na2B4O7∙10H2O |
Аналізуємий розчин H2 SO4. | ||
|
V, мл |
C(1/zX), моль/л |
V, мл |
C(1/zX), моль/л | |
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
середнє |
|
|
|
|
Формули для обчислення:
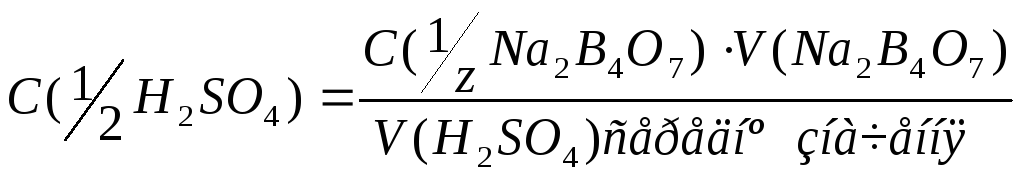
![]()
Контрольні питання
Поняття про приготовлені і встановлені розчини.
Що таке точка еквівалентності і як її визначають?
З якими індикаторами необхідно проводити титрування:
а) сильних кислот сильними основами;
б) слабких кислот сильними основами;
в) слабких основ сильними кислотами?
В яких випадках титрування кислот лугами і навпаки точка еквівалентності співпадає з нейтральним середовищем, а в яких не співпадає?
Обчислити молярну концентрацію еквівалента розчину H2SO4 з масовою часткою H2SO4 6,5% (густина розчину 1,040г/мл).
Яка маса бури необхідна для приготування 250мл розчину молярної концентрації еквівалента 0,050моль/л?
Який об`єм розчину НСІ з масовою часткою 20% (густина 1,093 г/мл) потрібен для приготування 5л розчину молярної концентрації еквівалента 0,1моль/л?
До 10 мл розчину H2SO4 з масовою часткою 10% (густина 1,07 г/мл) добавили 10 мл розчину цієї ж кислоти з масовою часткою 50% (густина 1,40 г/мл) і 980 г води. Визначити молярну концентрацію еквівалента розчину кислоти.
На нейтралізацію 30 мл розчину H2SO4 необхідно 20 мл розчину NaОН з масовою часткою 8% (густина 1,092 г/мл). Чому дорівнює молярна концентрація еквівалента розчину кислоти?
Визначте об’єм 0,3н розчину кислоти, потрібний для нейтралізації розчину, який містить 0,32 г натрій гідроксиду в 40 мл.
Лабораторна робота № 7
Тема: Визначення лугу в розчині
Мета: Закріпити навички титрування, провести визначення лугу в розчині за методом нейтралізації
Знати: сутність титриметричного аналізу та метода нейтралізації
Вміти: грамотно виконувати титрування, проводити розрахунки за результатами титрування
Техніка безпеки: Бути уважним в хімічній лабораторії, проявляти обережність під час роботи з хімічними реактивами і хімічним посудом.
