
Научные стремления 2011-1
.pdfУДК 577.112.083
М.А. Капустин, В.П. Курченко
ВЫДЕЛЕНИЕ ЛАКТОФЕРРИНА ИЗ КОРОВЬЕГО МОЛОКА МЕТОДОМ ИММУНОАФФИННОЙ ХРОМАТОГРАФИИ
Белорусский государственный университет, г. Минск, Республика Беларусь
С каждым годом в молочной промышленности усиливается тенденция к обогащению традиционных пищевых продуктов биологически активными веществами. Некоторые минорные белки, содержащиеся в молоке различных видов животных, так же обладают выраженной биологической активностью. Лактоферрин является среди них в практическом отношении наиболее важным протеином.
Впервые лактоферрин был обнаружен в коровьем молоке. Позднее было установлено, что данный белок присутствует в плазме крови, слезной, амниотической и некоторых других биологических жидкостях [1, 2]. Он представляет собой гликопротеин с молекулярным весом около 78 кДа, способный обратимо связывать ионы металлов, в основном Fe2+ и Fe3+. Концентрация данного белка в коровьем молоке не превышает 1 г/л. В животном организме лактоферрин выполняет несколько функций. Данный белок считается одним из основных компонентов первичной защиты от действия патогенов и неблагоприятных условий среды. Лактоферрин играет существенную роль в регуляции гомеостаза ионов железа [3], обладает выраженным антимикробным действием против широкого спектра бактерий, грибов, вирусов и паразитов, противовоспалительной и противораковой активностью, а также рядом ферментативных активностей. Лактоферрин подавляет рост и жизнедеятельность грам-положительных и грамотрицательных бактерий [2, 4]. В связи с чем актуальным является выделение лактоферрина в чистом виде и исследование его физико-химических свойств и биологических активностей.
Целью наших исследований являлось изучение возможности выделения лактоферрина из коровьего молока методом иммуноаффинной хроматографии.
Для этого была проведена иммунизация кроликов гомогенным препаратом бычьего лактоферрина. Нами была получена антисыворотка с титром антител 1/32, дающая при двойной иммунодиффузии перекрестные реакции преципитации с лактоферринами коровьего, козьего молока, с очищенным бычьим лактоферрином и не взаимодействующая с человеческим лактоферрином и другими белками молока (рисунок 1).
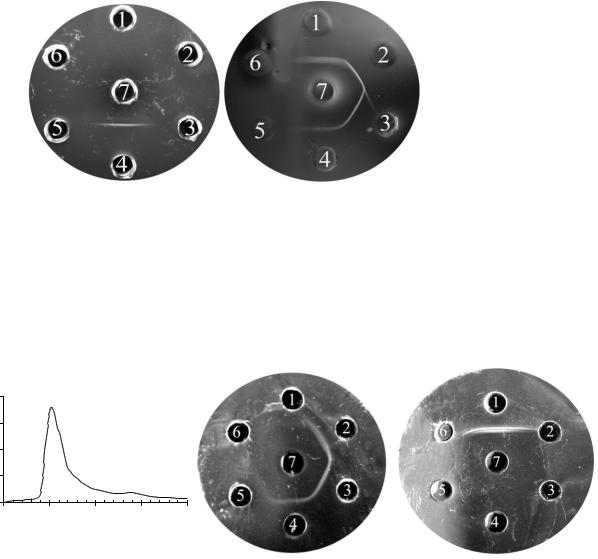
На сорбенте Сефароза 4B с иммобилизованным бычьим лактоферрином были выделены моноспецифические антитела. Для этого на колонку с сорбентом наносили большой объем антисыворотки, колонку отмывали до исчезновения белка в элюате, затем элюировали специфические антитела 0,2 М глицин-HCl pH=2,8 и проверяли их способность реагировать с бычьим лактоферрином (рисунок 2 А, Б, В).
181
А |
Б |
А. 1. Казеин коровий 2. Казеин козий 3. α-лактоальбумин 4. Лактоферрин бычий Sigma 5. β-лактоглобулин 6. Раствор БСА 7. Антисыворотка к бычьему лактоферрину
Б. 1. Лактоферрин бычий Sigma 2. Сыворотка коровьего молока 3. Сыворотка козьего молока 4. Сыворотка козьего молока 5. Лактоферрин выделенный из женского молока 6. Лактоферрин человеческий Sigma 7. Антисыворотка к бычьему лактоферрину
Рисунок 1 – Иммуноспецифичность антисыворотки против бычьего лактоферрина в реакции двойной иммунодиффузии с различными белками молока
нм |
|
А |
|
|
Б |
В |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
, 280 |
1,5 |
|
|
|
|
|
Поглощение |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
0,5 |
|
|
|
|
|
|
0 |
|
|
|
|
|
|
0 |
5 |
10 |
15 |
20 |
|
|
|
|
фракция |
|
|
|
А. Элюция антител к бычьему лактоферрину с аффинного сорбента 0,2 М Гли-HCl буфером pH=2.8, V=30 мл/час, объем фракции 1,5 мл
Б. 1. Антисыворотка к бычьему лактоферрину после инкубации с аффинным сорбентом 2. Фракция элюции антител № 5 3. Фракция элюции антител № 7 4. Фракция элюции антител № 10 5. Фракция элюции антител № 15 6. Фракция элюции антител № 20 7. Лактоферрин бычий Sigma
В. 1. Антисыворотка к бычьему лактоферрину 2. Антисыворотка к бычьему лактоферрину после инкубации с аффинным сорбентом 3. Фильтрат после концентрирования антител 4. - 5. - 6. - 7. Лактоферрин бычий Sigma
Рисунок 2 – Способность антител выделенных на аффинном сорбенте образовывать преципитаты в реакции двойной иммунодиффузии с бычьим
лактоферрином
После проверки иммунореактивности полученных антител, они были иммобилизованы на Сефарозе 4B, активированной бромцианом. Этот иммуноаффинный сорбент был использован для хроматографического выделения лактоферрина из коровьего молока.
Данные анализа выделенного лактоферрина методом ДСН-электрофореза свидетельствуют о соответствии молекулярных масс полученного белка и стандарта бычьего лактоферрина (Sigma). Молекулярная масса протеина
182

составляет около 78 кДа. Отсутствие посторонних полос на электорфореграмме позволяет также судить о степени чистоты полученного белка, которая составляет 95–98% (рисунок 3).
1. Молоко коровье
2. Не связавшаяся с сорбентом белковая фракция 3. Лактоферрин из коровьего молока 4. Стандарт бычьего
лактоферрина (Sigma)
5. стандарты молекулярных масс
1 2 3 4 5
Рисунок 3 – Электрофореграмма белков коровьего молока после разделения на иммуноаффинном сорбенте
Таким образом, можно заключить, что иммуноаффинный способ выделения пригоден для получения лактоферрина из коровьего молока. Использованный метод позволяет эффективно отделить лактоферрин от других белков сыворотки коровьего молока в одну хроматографическую стадию. Применение аффинных сорбентов позволяет получить лактоферрин из сыворотки коровьего молока с высокой чистотой, достигающей 95–98%. Такой лактоферрин может быть использован в качестве БАД а также входить в состав специализированных продуктов функционального назначения.
Литературные источники
1.Adlerova, L. Lactoferrin: a review / L. Adlerov, A. Bartoskova, M. Faldyna // Veterinarni Medicina. – 2008. – Vol. 53, No 9. – P. 457–468.
2.González-Chávez, S.A. Lactoferrin: structure, function and applications / S.A. González-
Chávez, S. Arévalo-Gallegos, Q. Rascón-Cruz // International Journal of Antimicrobial Agents. – 2009. – Vol. 33. – P. 301.e1–301.e8.
3.Siimes, M.A. Exclusive breast-feeding for 9 months: risk of iron deficiency / M.A.
Siimes, L. Salmenperä, J. Perheentupa // J. Pediatr. – 1984. – Vol. 104. – P. 196–199.
4.Ellison III, R.T. Damage of the membrane of enteric Gram-negative bacteria by lactoferrin and transferring / R.T. Ellison III, T.J. Giehl, F.M. Laforce // Infect. Immun. – 1988. – Vol. 56. – P. 2774–2781.
M.A. Kapustin, V.P. Kurchenko
ISOLATION OF LACTOFERRIN FROM COW MILK USING IMMUNOAFFINITY
CHROMATOGRAPHY
Belarusian State University, Minsk, Republic of Belarus
Summary
Certain scanty milk proteins possess pronounced biological activity. Lactoferrin is among them. This protein is very important in practical application. Unfortunately the amount of lactoferrin in milk of different species is low, that is why it‘s important to find out methods of lactoferrin isolation and obtainment in pure form to use in food and pharmaceutical industry. In our study the possibility of lactoferrin isolation by immunoaffinity chromatography methods was investigated. Purified protein was analysed with SDS-electrophoresis.
183
УДК 579.6+577.15:577.113.3
А.С. Коровашкина1, С.В. Квач1, А.И. Зинченк 1,2
СОЗДАНИЕ ШТАММА ESCHERICHIA COLI – ПРОДУЦЕНТА ПЛАЗМИДНОЙ ДНК, ОБОГАЩЕННОЙ ИММУНОТРОПНЫМИ
CPG-МОТИВАМИ
1Институт микробиологии НАН Беларуси, Минск 2Международный государственный экологический университет имени А.Д. Сахарова,
Минск
Введение. CpG-мотивы представляют собой особые шестичленные нуклеотидные последовательности, содержащие в своей центральной части CpG-динуклеотид. В ДНК бактерий преобладают неметилированные CpGмотивы. В геноме позвоночных CpG-динуклеотиды встречаются в 3–4 раза реже, чем у бактерий, кроме того, около 70–80% CpG-мотивов ДНК позвоночных метилированы по пятому атому углерода остатка цитозина [1].
Неметелированные CpG-мотивы взаимодействуют с TLR9-рецепторами иммунокомпетентных клеток (В-клетки, макрофаги, дендритные клетки и др.) и стимулируют врожденный неспецифический иммунитет человека и животных против инфекционных патогенов, проявляют противоопухолевые и противоаллергенные свойства, а также обладают адьювантной (т.е. усиливающей иммуногенность вакцин) активностью [2, 3].
Целью данной работы явилось конструирование плазмидной ДНК, обогащенной CpG-мотивами, и создание штамма-продуцента такой рекомбинантной плазмидной ДНК.
Материалы и методы исследования. Для получения двухцепочечной ДНК, содержащей CpG-мотивы, использовали химически синтезированную прямую (CpG-F) и обратную (CpG-R) цепи олигодезоксинуклеотидов (ОДН) (жирным выделен участок, содержащий 4 повтора CpG-мотива, италика – сайт узнавания рестриктазы HindIII).
CpG-F: 5′- AGCTTCGTCGTTTTGTCGTTTTGTCGTTTTGTCGTTA-3′ CpG-R: 5′-AGCTTAACGACAAAACGACAAAACGACAAAACGACGA-3′
Для отжига ОДН реакционную смесь, содержащую CpG-R (500 пмоль),
CpG-F (500 пмоль), 20 мМ Трис-НCl-буфер (pH 7,5), 10 мМ MgCl2 и 50 мМ
NaCl, прогревали при 95°C 5 мин, а затем медленно охлаждали до +4°C. Фосфорилирование 5′-концов полученного дуплекса осуществляли с
помощью Т4-полинуклеотидкиназы (Sileks, Россия).
Самолигирование фосфорилированного дуплекса проводили по «липким концам», соответствующим сайтам узнавания рестриктазы HindIII, с помощью T4-лигазы (Fermentas, Литва). Продукт лигирования (двухцепочечный полидезоксинуклеотид; dsCpG-полинуклеотид) разделяли с помощью электрофореза в 1%-ном агарозном геле. Вырезали участок геля, содержащий продукт наибольшего размера (900–1000 п.н.) и очищали с использованием набора реагентов «MinElute Gel Extraction Kit» (Qiagen, Германия) согласно методике фирмы-изготовителя. Далее, реакционную смесь, содержащую 30 мкл раствора очищенных dsCpG-полинуклеотидов с концентрацией 70 нг/мкл, ПЦР-
184

буфер (67 мМ Трис-HCl (pH 8,3), 17 мМ (NH4)2SO4, 2 мМ MgCl2, 0,02% Твин-
20), каждый из четырех природных дезоксинуклеозидтрифосфатов в концентрации 0,2 мМ и 1 ед активности Taq-ДНК-полимеразы, инкубировали
20 мин при 72°C.
Полученные dsCpG-полинуклеотиды с дополнительными остатками дAMФ на 3′-концах лигировали с Т-вектором, приготовленным на основе плазмиды pXcmkn12 (Сloning Vector Collection, Япония) путем ее обработки рестриктазой XcmI (New England Biolabs, США) в течение 12 ч при 37ºС.
В результате была сконструирована плазмида pCpG-KH11, обогащенная иммуностимулирующими мотивами GTCGTT. Наличие и размер вставки подтверждали методом рестрикционного анализа.
Путем последующей трансформации плазмидой pCpG-KH11 клеток Escherichia coli BLR(DE3) (Novagen, США) был получен рекомбинантный штамм E. сoli pCpG-KH11 – продуцент плазмиды, обогащенной CpG-мотивами.
Клетки E. coli pCpG-KH11 выращивали на термостатированной биологической качалке с частотой колебания платформы 170–190 об/мин при +37оС в течение 16 ч на среде следующего состава: триптон – 1,0%; дрожжевой экстракт – 0,5%; глицерин – 0,5%; глюкоза – 0,05%; Na2HPO4 – 0,025 М;
KH2PO4 – 0,025 М; NH4Cl – 0,05 М; Na2SO4 – 0,005 М; MgSO4 – 0,002 М; FeCl3 – 50 мкМ; CaCl2 – 20 мкМ; MnCl2 – 10 мкМ; ZnSO4 – 10 мкМ; CoCl2 – 2 мкМ;
CuCl2 – 2 мкМ; NiCl2 – 2 мкМ, Na2MoO4 – 2 мкМ; Na2SeO3 – 2 мкМ, H3BO3 – 2
мкМ; ампициллин – 150 мкг/мл; (pH 7,0). Для определения продуктивности штамма в отношении плазмиды pCpG-KH11 из полученной биомассы выделяли плазмиду стандартным методом щелочного лизиса [4].
Результаты и их обсуждение. В результате выполнения данной работы сконструирован плазмидный вектор pCpG-KH11, обогащенный мотивом GTCGTT, который, по литературным данным, наиболее эффективно стимулирует иммунную систему человека [5]. Схематическое изображение плазмиды pCpG-KH11 представлено на рисунке 1.
Рисунок 1 – Схематическое изображение плазмиды pCpG-KH11
Наличие в плазмиде встроенных тандемных повторов CpG-мотивов подтверждено методом рестрикционного анализа. С этой целью плазмидную
185

ДНК инкубировали со смесью рестриктаз NdeI и EcoRI, сайты узнавания которых ограничивают клонированный участок.
Полученные в результате рестрикции фрагменты затем обработали рестриктазой HindIII, сайты рестрикции которой находятся внутри клонированного участка. Анализ продуктов рестрикции проводили путем электрофореза в 1%-ном агарозном геле (рисунок 2).
1 |
2 |
3 |
4 |
3000 п.н. |
|
|
Фрагмент плазмидной ДНК |
|
|
без клонированной вставки |
|
|
|
|
|
1000 п.н. |
|
|
Клонированная вставка, окруженная |
|
|
фланкирующими участками, ~1250 п.н. |
|
|
|
|
|
|
|
|
Деградировавшая |
200 п.н. |
|
|
вставка |
1 – фрагменты ДНК c известным количеством пар нуклеотидов;
2– очищенная плазмида рCpG-KH11;
3– фрагменты ДНК, полученные после обработки рCpG-KH11 смесью рестриктаз
NdeI и EcoRI;
4– фрагменты ДНК, полученные после обработки рCpG-KH11 смесью рестриктаз
NdeI, EcoRI и HindIII.
Рисунок 2 – Электрофоретический анализ рестриктов плазмиды рCpG-KH11
Число клонированных в плазмиде рCpG-KH11 CpG-мотивов, составляющее 96, определяли по формуле:
D1 280 4 , 40
где:
D1 – размер фрагмента, полученного в результате обработки рCpG-KH11 смесью рестриктаз NdeI и EcoRI и состоящего из клонированной вставки, окруженной фланкирующими участками (п.н.);
280 – суммарный размер фланкирующих участков (п.н.);
40 – размер 1 тандемного повтора CpG-мотивов (п.н.); 4 – количество CpG-мотивов в 1 тандемном повторе.
В результате проведенных экспериментов по молекулярному клонированию получен штамм-продуцент плазмидной ДНК, обогащенной иммунотропными CpG-мотивами, названный E. coli CpG-KH11. Данный штамм характеризуется высокой продуцирующей способностью в отношении плазмидной ДНК (5,5–6,0 мг/л).
Заключение. В результате выполнения данной работы сконструирован вектор рCpG-KH11, несущий 96 повторов иммунотропного CpG-мотива GTCGTT, проявляющего высокую активность в отношении иммунной системы человека. Создан штамм E. coli CpG-KH11 – продуцент плазмидной ДНК,
186
обогащенной иммуностимулирующими CpG-мотивами. Данный штамм может быть использован для получения плазмид, обогащенных CpG-мотивами, с целью создания на их основе лекарственных препаратов для лечения и профилактики онкологических, аллергических и инфекционных заболеваний, а также адъювантов для ряда вакцин.
Литературные источники
1.Krieg A.M. CpG motifs in bacterial DNA and their immune effects // Annu Rev. Immunol. – 2002. – Vol. 20. – P. 709–760.
2.Олишевский С.В., Козак В.В., Яниш Ю.В., Рыбалко С.Л., Шляховенко В.А. Иммуностимулирующая CpG-ДНК: перспективы клинического применения в онкологии // Онкология. – 2006. – Т. 8, № 2. – С. 209–217.
3.Pat. 7935675 US, Immunostimulatory nucleic acid molecules, 2011.
4.Sambrook J., Russell D.W. Molecular Cloning: A Laboratory Manual / 3rd Edition. – Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press, 2001.
5.Chen Y., Xiang L.X., Shao J.Z. Construction of a recombinant plasmid containing multi-copy CpG motifs and its effects on the innate immune responses of aquatic animals // Fish Shellfish Immunol. 2007. Vol. 23, N 3. P. 589–600.
A.S. Korovashkina 1, S.V. Kvach 1, А.I. Zinchenko 1,2
CONSTRUCTION OF ESCHERICHIA COLI STRAIN TO PRODUCE CPGENRICHED PLASMID DNA
1Institute of Microbiology, National Academy of Sciences of Belarus, Minsk
2International Sakharov Environmental University, Minsk
Summary
The plasmid pCpG-KH11 carrying 96 copies of CpG motif GTCGTT was constructed. The cloned motif is considered to be the most effective in stimulation of the human immune system. Using methods of genetic engineering E. coli CpG-KH11 strain was obtained. The strain is potent in pCpG-KH11 production and makes it possible to produce 5,5–6,0 mg of target plasmid DNA per 1 L of culture broth.
187
УДК 631.547:581.19:633.521
С.В. Кубрак 1, Е.А. Флюрик 2, В.Н. Леонтьев 2
ИСПОЛЬЗОВАНИЕ ФИЗИКО-ХИМИЧЕСКИХ МЕТОДОВ ДЛЯ ИДЕНТИФИКАЦИИ ГЕНЕТИЧЕСКИ БЛИЗКИХ ФОРМ ЛЬНА-
ДОЛГУНЦА
1Институт генетики и цитологии НАН Беларуси, Минск
2Белорусский государственный технологический университет, Минск
Актуальность. Методы физико-химического анализа биологических полимеров получили широкое распространение в научных исследованиях и производственной практике благодаря высокой чувствительности и объективности. Электронная микроскопия, термогравиметрия, энергодисперсионный анализ и другие методы позволяют получить точные характеристики компонентов, формирующих биологические объекты. При анализе конкретных образцов в решении задач различных направлений сельского хозяйства необходимо учитывать сложность строения и структурную неоднородность исследуемого материала. Изучение признаков продуктивности и качества волокна льна-долгунца – важнейшей технической культуры – долгое время базировалось на морфологических характеристиках (высота, техническая длина и др.), анатомическом строении стебля, а чаще всего на органолептической оценке льнопродукции. Все перечисленные показатели в той или иной степени зависят от климатических условий и агротехнических приемов выращивания, что необходимо учитывать при их использовании. В настоящее время представляется актуальным подбор и адаптация методов, позволяющих проводить скрининг селекционных и промышленных образцов льна-долгунца для идентификации высококачественных объектов и выявления структурно-функциональных характеристик волокна [1].
Лен-долгунец является культурой с узким генетическим фоном, что является следствием автогамного типа размножения, и использования в скрещивании на протяжении длительного времени ограниченной группы сортов [2]. Получение новых форм льна различными способами, в том числе с использованием биотехнологических методов, приводит в результате к получению близких в генетическом отношении генотипов. Сомаклональные вариации или генетически модифицированные формы отличаются от исходных сортов небольшим количеством генов. Дальнейшее их использование в селекционных программах имеет смысл только при условии точной идентификации генотипов и объективной оценке фенотипических характеристик.
Цель проводимого нами исследования состояла в подборе и использовании физико-химических методов оценки генетически близких форм льна-долгунца, полученных в культуре in vitro. Исследовали возможность применения электронной микроскопии и термогравиметрии для анализа состава и строения клеточной стенки исходных и генетически измененных образцов.
188
Материалом для исследования служили полученные на основе сорта К- 65 линии трансформантов льна-долгунца (образцы № 1, 2, 3, 4, 6, 7, 8, 10, 14, 16).
Методы исследования. Для выявления структурно-морфологических различий образцов волокна растений-трансформантов была использована сканирующая электронная микроскопия, позволяющая производить неразрушающий качественный и количественный элементный анализ участков исследуемого объекта. Термогравиметрический анализ (ТГ) проводили на лубяном волокне льна выделенного из льносоломки щелочным методом [3].
Результаты и обсуждение. В основе каждого признака продуктивности и качества льна-долгунца лежат морфологические, анатомические и биохимические особенности строения волокна, поэтому структура и химический состав элементарных волокон являются эффективными характеристиками, позволяющими дать предварительный прогноз продуктивности и качества.
Метод термогравиметрии позволяет идентифицировать основные полимерные компоненты: целлюлозу, лигнин, гемицеллюлозы, пектиновые вещества, а также воду и зольные элементы. Вычисление энергии активации термоокислительной деструкции (Еа) дает возможность оценивать качество льноволокна. ТГ-анализ волокна, выделенного из стеблей растенийтрансформантов льна-долгунца, проводили на термоанализаторе ТА-4000 (модуль ТГ-50) (Mettler Toledo STARe System, Швейцария), в интервале 25550 С при скорости нагревания 5°С/мин и расходе воздуха 200 мл/мин. Кривые потери массы были рассчитаны при помощи программного обеспечения STARe. Данные ТГ-анализа исследуемых образцов сравнивали с ТГ стандартных образцов льна чесаного марок цветности А и Б, полученных при аналогичных условиях.
ТГ-анализ образцов волокна растений-трансформантов льна-долгунца выявил различия в составе компонентов вторичной клеточной стенки и энергии активации термоокислительной исследуемых образцов. Содержание целлюлозы в образцах (в % от массы навески) составляло 54,97-57,94 %, нецеллюлозных полисахаридов – 21,81-27,12 % (таблица 1).
Таблица 1- Компонентный состав образцов (%) и энергия активации (Ea, кДж/моль) при термогравиметрическом анализе растений-трансформантов льна-долгунца
Образец |
Навеска, |
Вода, % |
Целлюлоза, % |
Лигнин, % |
Зола, |
Еа, |
|
льна |
мг |
(25-185 С) |
(185-385 С) |
(385- |
(430- |
% |
кДж/моль |
|
|
|
|
430 С) |
550 С) |
(550 С) |
|
|
|
|
|
|
|
||
№ 1 |
10,16 |
8,24 |
57,88 |
9,92 |
23,08 |
0,88 |
100 |
№ 2 |
10,22 |
8,33 |
56,50 |
9,21 |
25,26 |
0,71 |
95 |
№ 3 |
10,21 |
7,97 |
57,94 |
10,07 |
22,67 |
1,36 |
93 |
№ 4 |
10,38 |
7,99 |
55,86 |
8,94 |
26,03 |
1,18 |
92 |
№ 6 |
10,60 |
7,24 |
57,47 |
9,34 |
24,88 |
1,09 |
97 |
№ 7 |
10,17 |
9,02 |
55,81 |
8,45 |
25,62 |
1,10 |
94 |
№ 8 |
10,53 |
8,10 |
56,07 |
9,25 |
25,55 |
1,03 |
94 |
№ 10 |
10,18 |
8,76 |
57,62 |
10,66 |
21,81 |
1,15 |
99 |
189
№ 14 |
10,32 |
9,59 |
54,97 |
8,77 |
25,50 |
1,17 |
89 |
№ 16 |
10,58 |
7,93 |
55,23 |
8,21 |
27,12 |
1,52 |
92 |
По относительному содержанию целлюлозы образцы № 1, 3, 6, 10 превосходили остальные анализируемые образцы, при этом содержание нецеллюлозных полисахаридов (гемицеллюлозы и пектиновых веществ) в данных образцах были минимальными в анализируемой группе растений. Содержание лигнина в указанных образцах было также достаточно высоким – 9,92; 10,07; 9,34 и 10,66 % соответственно. Максимальное количество лигнина обнаружено у образца № 10. Образцы № 2, 4, 7, 8, 14 и 16 характеризуются невысокой степенью лигнификации и повышенным содержанием нецеллюлозных полисахаридов в клеточной стенке.
Результаты ТГ-анализа свидетельствуют о различии исследуемых образцов по величине Еа. Выявлено, что наибольшая величина этого показателя обнаружена у образцов № 1, 6 и 10 (100; 97 и 99 кДж/моль, соответственно). Так как величина Еа равна разности энергий переходного и исходного состояний реакции горения, то максимальные ее значения у образцов льняного волокна свидетельствуют о значительной структурной гомогенности и высокой степени полимеризации целлюлозы. Степень полимеризации является важнейшей характеристикой целлюлозы и в значительной степени определяет области практического использования целлюлозного сырья и физикомеханические свойства получаемых из нее волокон.
Образцы волокна растений-трансформантов № 1, 6 и 10, имея относительно высокое содержание целлюлозы и высокие значения Еа, соответствуют по качеству образцам льна чесанного марок № 10А-13А. Полученные данные свидетельствует о том, что указанные образцы обладают достаточной прочностью ввиду высокой степени полимеризации целлюлозы. Значения технической длины стебля у данных генотипов имели самые высокие значения среди исследуемых образцов, что является показателем хорошей продуктивности.
Таким образом, инструментальный метод ТГ-анализа позволил дифференцировать исследуемые образцы в соответствии со стандартными технологическими характеристиками качества льняного волокна. Показано, что величина Еа отражает содержание целлюлозы в исследуемых образцах, позволяет судить о ее структуре и указывает на присутствие других полисахаридов и минеральных компонентов.
Для выявления структурно-морфологических различий образцов волокна растений-трансформантов была использована сканирующая электронная микроскопия, позволяющая производить неразрушающий качественный и количественный анализ участков исследуемого объекта. На рисунке 1 представлены микрофотографии, полученные при помощи сканирующего электронного микроскопа (×500), показаны элементарные лубяные волокна и их реальные морфометрические параметры.
190
