
Научные стремления 2011-1
.pdfТаблица 7 - Фунгицидная активность НАВИСАНА-ДД на суспензию Asp.apis, нанесенную на пластиковые тест-объекты
Экспозиция, мин |
Концентрация НАВИСАНА-ДД (%), эффективность |
|||
0,5 |
1,0 |
1,5 |
||
|
||||
10 |
- |
- |
+ |
|
30 |
- |
- |
+ |
|
60 |
- |
+ |
+ |
|
Примечание: в контроле – сплошной рост; «-»– наблюдается рост микроорганизмов; «+»– роста колоний не отмечается.
Выводы. Новый препарат для дезинфекции и дезинсекции животноводческих помещений является высокоэффективным т.к.:
НАВИСАН-ДД обладает в 0,5%-ной концентрации при экспозиции 15 минут выраженным бактерицидным действием на возбудителей, относящихся к 1-ой группе устойчивости к дезинфицирующим средствам.
Средство НАВИСАН-ДД обладает в 0,75%-ной концентрации и экспозиции 14 минут выраженным бактерицидным действием на возбудителей, относящихся ко 2-ой группе устойчивости к дезинфицирующим средствам.
В1%-ной концентрации при экспозиции 15 минут средство НАВИСАН-
ДДобладает выраженным бактерицидным действием на возбудитель туберкулеза.
Средство НАВИСАН-ДД обладает в 1,5%-ной концентрации при экспозиции 10 минут выраженным фунгицидным действием.
Литературные источники
1.Высоцкий, А.Э. Ветеринарно-санитарные аспекты борьбы с инфекционными болезнями животных / А.Э. Высоцкий // Ветеринарная медицина Беларуси. – 2006. – № 2. – С. 2–4.
2.Шабловский, В.О. Новое дезинфицирующее средство на основе перекиси водорода
имолочной кислоты / В.О. Шабловский, А.В. Тучковская, О.Г. Пап, О.В. Ивашина, Т.В. Ховзун, А.Э. Высоцкий // Сб. науч. тр. / НИИ ФХП БГУ. – Минск, 2008. – Вып. 3: Химические проблемы создания новых материалов и технологий. – С. 512–521.
3.Высоцкий А.Э. Методические указания по контролю качества дезинфекции и санитарной обработки объектов, подлежащих ветеринарно-санитарному надзору / А.Э. Высоцкий [и др.] // Утверждены ГУВсГВиГПИ МСХ и П РБ 13.06.2007 г. (10-1-5/567) – Минск, 2007. – 32с.
A.N. Chistova
RESRARCH OF EFFICIENCY OF PREPARATION NAVISAN-DD FOR SIMULTANEOUS DISINFECTION AND DISINSECTION OF CATTLE-BREEDING
PREMISES
Belarusian State University, Minsk
Summary
It was necessary to research the efficiency of the preparation NAVISAN-DD for simultaneous disinfection and disinsection for introduction in farmal industries practic. It has been established that the preparation possesses the expressed bactericidal action on activators of various groups of stability to disinfectant substances and expressed fungicide action.
271
УДК 577.1: [615.3+632.95+547]
Е.С. Шевчук, О.И. Губич
СКРИНИНГ ЦИТОПРОТЕКТОРНОЙ АКТИВНОСТИ ПРОСТАНОИДОВ ГРУППЫ В IN VITRO
Белорусский государственный университет, Минск
Введение. Хлороформ – один из первых препаратов, широко применявшихся с середины 19 века до середины 20 века в анастезиологической практике. В настоящее время показано наличие у данного галогенометана высокой токсичности и способности вызывать нарушение сердечного ритма, дистрофические изменения в миокарде, цирроз и атрофию печени [1-3]. Длительное воздействие паров хлороформа в условиях промышленного производства способно стимулировать канцерогенез [4]. Между тем, данное соединение до сих пор широко используется в качестве промышленного растворителя и компонента препаратов бытовой химии. Несмотря на многочисленные случаи острого и хронического отравления хлороформом в быту и на производстве, практика оказания первой помощи до сих пор не предусматривает использования антидотов, а предполагает экстренное проведение гемодиализа, гепатодиализа и переливание больших объемов донорской крови [5].
Простагландины (ПГ) – биологически активные производные полиненасыщенных жирных кислот, обеспечивающие регуляцию основных физиологических функций в норме и при патологии [6]. Высокая активность ПГ предполагает потенциальную возможность использования их в медикофармакологической практике, а также в экспериментальной работе в качестве тонких регуляторов физиологических и биохимических процессов. Вместе с тем, относительно низкая стабильность и биологическая селективность природных ПГ серьезно затрудняет их практическое использование и является основной причиной возникновения ряда нежелательных побочных эффектов [7]. Вместе с тем, любые преобразования структуры природных ПГ способны значительно модифицировать функциональную активность соединения [7]. Принимая во внимание полученные ранее данные, согласно которым синтетические аналоги ПГ группы В способны оказывать гепатопротекторное действие в условиях повреждения клеток печени четыреххлористым углеродом
[8].
Целью настоящей работы явилась характеристика цитопротекторных свойств простаноидов группы В на клеточной модели повреждения печени хлороформом.
Материалы и методы. Анализ функциональной активности простаноидов был выполнен с использованием природного ПГI2 и 9 синтетических аналогов ПГВ, синтезированных и предоставленных для исследований Лабораторией химии простагландинов Института биоорганической химии НАН Беларуси.
272
Оценка цитопротекторного действия простаноидов выполнялась на клеточной модели поражения печени, индуцированного 0,14% хлороформом (CНCl3). Выделение гепатоцитов производилось из печени беспородных белых крыс-самцов методом одноэтапной нерециркуляционной неферментативной перфузии согласно [9]. Жизнеспособность и количество гепатоцитов рассчитывали в трипановом тесте [10]. Простаноиды в концентрациях (10-10 – 10-6 моль/л) добавляли к опытным пробам через 30 минут после CНCl3. После 2-ух часовой инкубации в присутствии СНСl3 аликвоты клеточной суспензии отбирали и использовали для измерения параметров клеточного повреждения. Цитопротекторные свойства простаноидов оценивали по их способности предотвращать утечку лактатдегидрогеназы (ЛДГ) из цитозоля и глутаматдегидрогеназы (ГДГ) – из митохондрий гепатоцитов. Активность ЛДГ измеряли по методу D. Weisshaar [11], ГДГ – по методу E. Schmidt [12]. Индекс цитотоксичности рассчитывали по формуле:
Индекс цитотоксичности (%) = |
Высвобождение фермента в опытной пробе 100 |
. |
|
||
|
Максимальное высвобождение фермента |
|
Содержание триеновых конъюгатов в мембранах клеток проводили методом УФ-спектрофотометрии изопропанольных экстрактов липидов [13]. Статистическая обработка результатов выполнялась с помощью пакета программ Stadia 6.0.
Результаты и их обсуждение. Для проведения исследований нами была экспериментально подобрана относительно высокая доза токсиканта (0,14%), вызывающая значительное, зависимое от времени повреждение плазматических мембран и мембран митохондрий (оценка проводилась по выходу ЛДГ и ГДГ, соответственно). Индекс цитотоксичности для указанных ферментов, оцененный после 2 часов воздействия 0,14% хлороформа, составил 76,0±2,6% для ЛДГ; 40,5±0,68% для ГДГ. Наряду с этим, в присутствии хлороформа наблюдалось 13-кратное накопление триеновых конъюгатов в клеточных мембранах. Полученные результаты хорошо согласуются с данными литературы, свидетельствующими о наличии взаимосвязи между клеточной гибелью, индуцированной хлороформом, и интенсификацией в его присутствии перекисного окисления липидов, приводящего к потере митохондриального мембранного потенциала и снижения интенсивности метаболических процессов в культуре гепатоцитов [1].
Обработка клеток ПГI2 и исследованными простаноидами вызывает развитие достоверного дозозависимого защитного эффекта. Максимально эффективными оказались концентрации, равные 1·10-7 – 1·10-8 моль/л. По силе протекторного действия исследованные соединения образуют следующий ряд эффективности: Л6К (-99,0% к эффекту хлороформа) = Л1К (-98,5%) ≥ Л7М (-
97%) > М3Г (-89%) = М2Ц (-89%) > ПГI2 (-57%) ≥ М1Ц (-55,8%) > М8К (-36%) > М3Ц (-24,1%) > Л6М (-19,9%).
273
Максимальный защитный эффект наблюдался в присутствии соединений, обладающих 2-тиенил-пропиловым фрагментом (Л6К, Л7М), метоксикарбонильной группой (Л1К) или бензольным кольцом (М2Ц, М3Г) в α-цепи. Действие этих соединений превосходило эффект ПГI2 – наиболее широко используемого в современной клинической и экспериментальной практике цитопротектора простаноидного типа.
Установлено также, что все простаноиды в максимально эффективных концентрациях на 27-68 % снижали утечку ГДГ из клеток, обработанных хлороформом.
Согласно данным ряда авторов, повреждение клеточных структур, вызванное действием хлороформа, может быть опосредовано его превращением цитохромами Р450 2Е1 и Р450 2В1/2 в свободнорадикальные продукты с последующим вовлечением их в перекисное окисление липидов (ПОЛ) плазматических и внутриклеточных мембран [1]. Таким образом, на следующем этапе работы мы остановились на определении способности простаноидов снижать интенсивность ПОЛ в клетке в присутствии хлороформа. В качестве маркера оксидативного стресса использовалась степень накопления в мембранах гепатоцитов триеновых конъюгатов.
При внесении максимально эффективных концентраций простаноидов М1Ц, Л7М, М3Г, М3Ц в суспензию гепатоцитов спустя 30 мин после добавления хлороформа происходило достоверное снижение накопления уровня триеновых конъюгатов. Максимальный эффект проявляется у природного ПГI2 (-72,0% к эффекту хлороформа), простаноиды снижали накопление триеновых конъюгатов на 21,4 - 28,6%.
Полученные результаты позволяют предположить возможность реализации наблюдаемого цитопротекторного эффекта исследованных простаноидов через снижение интенсивности свободнорадикальных процессов в клеточных мембранах.
Заключение. Оценено защитное действие 9 аналогов простагландинов группы В на клеточной модели повреждения гепатоцитов хлороформом. Выявлен выраженный цитопротекторный эффект 5 простаноидов, установлена корреляция между проявлением простаноидом защитного действия и его способностью снижать интенсивность перекисного окисления липидов, проведен структурно-функциональный анализ.
Работа выполнена в рамках ГПНИ Республики Беларусь ―Фундаментальная и прикладная медицина и фармация‖ (№ задания 4.36).
Литературные источники
1.Constan A. A., Sprankle C. S., Peters J. M. Metabolism of chloroform by cytochrome P450 2E1 is required for induction of toxicity in the liver, kidney, and nose of male mice // Toxicol. Appl. Pharmacol. 1999. Vol. 2. P.120-126.
2.Fang C., Behr M., Xie F. Mechanism of chloroform-induced toxicity // Toxicol. Appl. Pharmacol. 2008. Vol. 227. P 48-55.
3.Kim H. A case of acute toxic hepatitis after suicidal chloroform and dichlormethane ingection // Am. J. Emerg. Med. 2008. Vol. 9. P. 1073 e3-e6.
274
4.Golden R. J., Holm S. E., Robinsjn D. E. Chloroform mode of action: implication for cancer risk assessment // Regul. Toxicol. Pharvacol. 1997. Vol 2. P. 142-155.
5.Матвейков Г.П. Лечение внутренних болезней. Минск: Беларусь,1997. 215 с.
6.Бороян Р.Г. Простагландины: взгляд на будущее. М.: Знание, 1983. 69 с.
7.Шульцев Г. П. Простагландины и их клиническое значение. М.: Минздрав СССР, 1983. 12 с.
8.Sholukh M.V., Hubich A.I., F.S. Pashkovsky, Lakhvich F.A. Structural features of
prostanoid analogues involved in hepatocytes protection against CCl4-induced injury // POLM. 2010. Vol. 93. P. 134-142.
9.Berry M. N., Friend D.S. High-yield preparation of isolated rat liver parenchymal cells // J. Cell Biol. 1969. Vol. 43. P. 506-520.
10.Адамс Р. Методы культуры клеток для биохимиков. М.: Мир, 1983. 156 с.
11.Weisshaar D., Grossnoum E., Faderl B. Normbereiche von α-HBDH, LDH, AP und LAP bei Messung mit substrat-optimierten Testansätzen // Med.Welt. 1975. Vol. 26. P. 387-390.
12.Schmidt E. Glutamate dehydrogenase // Methods of enzymatic analysis. New York: University Press. 1974. P. 496-499.
13.Костюк В.А., Потапович А.И., Лунец Е.Ф. Спектрофотометрическое определение диеновых конъюгатов // Вопросы мед. химии. 1984. Т. 30. С. 125-127.
K.S. Shauchuk, A.I. Hubich
THE INVESTIGATION OF PROSTANOIDS B-GROUP CYTOPROTECTIVE ACTIVITY IN VITRO
Belarusian State University, Minsk
Summary
The cytoprotective effects of 9 synthetic prostaglandin B analogs against СHCl3 as a toxic agent were studied with isolated rat liver hepatocytes. It was determined that five prostanoids, possessing C2-tienyl-propyl-, C2-metoxycarbonyl or C2-benzol-group in -chain were able to decrease a toxic action of this agent more effective than the natural prostaglandin I2. The extent of prostanoids protective activity correlated with a decrease of triene conjugate formation in cellular membranes.
275
УДК 579.841.11:597.2
Ю.А. Шилова, Е.Г. Веремеенко
ИЗУЧЕНИЕ АКТИВНОСТИ КОМПОНЕНТОВ АНТИОКСИДАНТНОГО КОМПЛЕКСА У БАКТЕРИЙ PSEDOMONAS
AURANTIACA, НЕСУЩИХ ДОПОЛНИТЕЛЬНЫЕ КОПИИ phzIR ГЕНОВ
Белорусский государственный университет, Минск, Республика Беларусь
В настоящее время все большее значение приобретает создание и использование биологических препаратов защиты. Основу таких препаратов составляют штаммы ризосферных бактерий, способные продуцировать вещества, обладающие биопестицидным действием. К таким соединениям относятся и феназиновые антибиотики. Данные соединения проявляют активность в отношении ряда фитопатогенов. В связи с этим актуальным является получение штаммов-продуцентов данных соединений, что напрямую зависит от изучения действия данных соединений на синтезирующие их штаммы и механизмов устойчивости к ним.
Целью работы являлось изучение активности основных компонентов антиоксидантного комплекса у бактерий P. aurantiaca, обладающих дополнительными копиями phzIR-генов – положительных регуляторов транскрипции феназинового оперона.
Материалы и методы. В работе использовали штамм P. aurantiaca B- 162, а также его регуляторный мутант В-162/255, способный к сверхсинтезу феназинов и полученные на их основе рекомбинантные штаммы В-162 (pAYC31phzIR) и В-162/255 (pAYC31phzIR). Бактерии выращивали при 28оС в жидкой питательной среде специального состава ПСА при 28оС в течение 5 сут
[M.E.Levitch, E.R. Stadtman, 1964]. Клеточный экстракт получали путем обработки суспензии клеток ультразвуком (30 кHz, 3 раза по 15 сек) при 4°С в 0,015 М фосфатном буфере. Определение активности супероксиддисмутазы (СОД) проводили по методу, основанному на спектрофотометрической регистрации изменения концентрации кверцетина с течением времени [В. А. Костюк и др., 1990]. Определение активности каталазы осуществляли согласно известной методике, предложенной Aebi [H. Aebi, 1984]. Активность СОД выражали в у.е./мг белка (1 у.е. соответствует 50% ингибированию реакции разрушения кверцитина на мг белка). Активность каталазы – ммоль/мин ×мг белка. Спектрофотометрический анализ проводили на спектрофотометре Cary 50 scan (Varian, Australia). Белок определяли по методу, предложенному
Bradford [J.K. Bradford, 1976].
Результаты и обсуждение. Положительная регуляция синтеза феназиновых антибиотиков у бактерий рода Pseudomonas осуществляется с помощью продуктов phzI- и phzR-генов. PhzI-белок представляет собой фермент, осуществляющий синтез ацил-гомосерин лактонов (АГЛ), а РhzR –
активатор транскрипции phz-оперона [L.S. Pierson III, 1996; N.A. Seveno, 2001].
Регуляция транскрипции осуществляется за счет связывания АГЛ-молекул с
276
PhzR-белком, что увеличивает его сродство к phz-боксам, расположенным перед phz-опероном, приводит к активации транскрипции последнего и, соответственно, синтезу феназиновых антибиотиков.
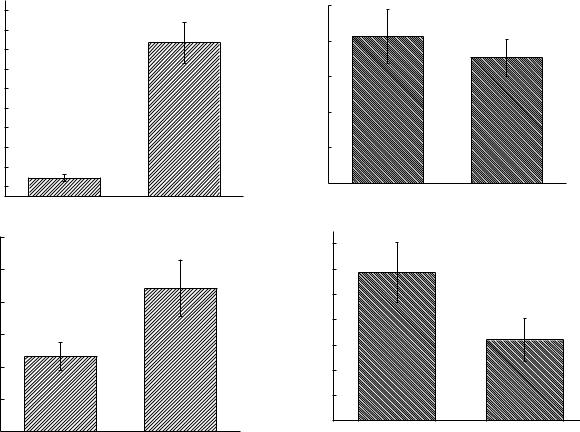
Ранее проведенное клонирование в составе многокопийного вектора pAYC31 хромосомного локуса, содержащего данные гены, и последующее введение его в клетки штаммов В-162 и В-162/255 дало возможность получить рекомбинантных продуцентов В-162 (pAYC31phzIR) и В-162/255 (pAYC31phzIR), уровень синтеза феназинов у которых бы значительно повышен и составлял 410 мг/л и 500 мг/л соответственно. В предыдущих исследованиях также была изучена роль основных компонентов антиоксидантной системы в защите клеток-продуцентов от высоких концентраций собственных феназинов. В связи с этим интересным представлялось провести подобные исследования у штаммов, несущих генноинженерную конструкцию. Для выяснения антиоксидантного статуса штаммов с дополнительными копиями phzIR-генов нами были определены удельные активности каталазы и супероксиддисмутазы (СОД) (рисунок 1).
У.а., ммоль/мин *мг белка
У.а., ммоль/мин *мг белка
45 |
|
50 |
|
|
|
40 |
|
|
|
|
40 |
35 |
|
|
30 |
белка |
|
|
|
30 |
25 |
./мг |
|
|
|
|
20 |
у.е |
20 |
|
У.а., |
|
15 |
|
|
10 |
|
10 |
5 |
|
|
0 |
|
0 |
|
|
|
|
B-162 |
B-162(pAYC31phzIR) |
|
|
a
60 |
|
35 |
|
|
|
50 |
|
30 |
|
белка |
|
|
|
25 |
40 |
./мг |
|
|
20 |
|
|
., у.е |
|
30 |
|
|
|
.а |
15 |
|
У |
|
|
|
|
20 |
10 |
|
|
10 |
5 |
|
|
|
0 |
0 |
|
B-162/255 |
B-162/255(pAYC31phzIR) |
в
B-162 |
B-162(pAYC31phzIR) |
|
б |
B-162/255 |
B-162/255(pAYC31phzIR) |
|
г |
Рисунок 1 – Активность ферментов антиоксидантного комплекса у бактерий
P. aurantiaca
Примечание – Удельная активность каталазы (a) и СОД (б) у штамма B-162 и его рекомбинанта; удельная активность каталазы (в) и СОД (г) у штамма B-162/255 его рекомбинанта. УА – удельная активность, УЕ – условные единицы
277
Показано, что штаммы, несущие дополнительные копии регуляторных генов и обладающие, соответственно более высокими уровнями продукции феназиновых антибиотиков, характеризуются повышенным уровнем удельной активности каталазы. Однако необходимо отметить, что, если рост данного показателя для штамма В-162 (pAYC31phzIR) по сравнению со штаммом В-162 составляет почти 17 раз, то у штамма В-162/255 (pAYC31phzIR) удельная активность каталазы повышается лишь в 1,9 раза по сравнению со штаммом В- 162/255. Удельная активность СОД обоих штаммов несколько снижается, что, по-видимому, является следствием ранее описанного токсического действия высоких концентраций пероксида водорода, образующегося в присутствии повышенных концентраций феназиновых антибиотиков, на активность данного фермента у P. aurantiaca [7]. В тоже время замедление роста удельной активности каталазы может свидетельствовать о том, что и данная система защиты работает на пределе своих возможностей.
Литературные источники
1.Костюк В. А., Потапович А. И., Ковалева Ж. В. Простой и чувствительный метод определения активности супероксиддисмутазы, основанный на реакции окисления кверцетина. // Вопр. мед. химии. – 1990. – Т. 36, №2. – С. 88-91
2.Aebi H. Catalase in vitro. // Methods in Enzymol. – 1984. – V. 105. – P. 121-126
3.Bradford J.K. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. // Anal. Biochem., – 1976. – V.
72.– P. 248-254
4.Levitch M.E., Stadtman E.R. A study of the biosythesis of Phenazine–1–carboxylic acid. // Arch. Biochem. Biophys. – 1964. – V. 106. – P. 194–199.
5.Pierson III L.S Phenazine antibiotic production in Pseudomonas aureofaciens: role in rhizosphere ecology and pathogen suppression / L.S Pierson III, E.A. Pierson // FEMS Microbiol Lett. – 1996. – Vol. 136, № 2. – P. 101-108.
6.Seveno N.A. Growth of Pseudomonas aureofaciens PGS12 and the Dynamics of HHL and Phenazine Production in Liquid Culture, on Nutrient Agar, and on Plant Roots / N.A. Seveno, J.A.W. Morgan, E.M.H. Wellington // Microb. Ecol. – 2001. – Vol. 41, № 4. – P. 314-324.
7.Veremeenko E.G. Activation of the Antioxidant Complex in Pseudomonas aurantiaca — Producer of Phenazine Antibiotics / E.G. Veremeenko, N.P. Maksimova // Microbiology. – 2010. – Vol. 79, № 4. – Р. 439-444.
J.A. Shilova, E.G. Veremeenko
THE STUDY OF THE ACTIVITY OF ANTIOXIDANT COMPLEX COMPONENT IN BACTERIA PSEUDOMONAS AURANTIACA, EXTRAL phzIR COPIES
Belarusian State University, Minsk
Summary
The activity of key enzymes of antioxidant complex SOD and catalase in bacteria P. aurantiaca B-162, В-162/255 and derived recombinant strains P. aurantiaca B-162 (pAYC31phzIR), В-162/255 (pAYC31phzIR) was studied. It was established that the SOD activity increased 17 times, and catalase activity increased 1,9 folds.
278
УДК: 616-097
А.А. Штыров
ПОЛУЧЕНИЕ АНТИГЕНА АДЕНОВИРУСНОГО ДЛЯ СЕРОЛОГИЧЕСКИХ РЕАКЦИЙ
Государственное учреждение «Республиканский научно-практический центр эпидемиологии и микробиологии», Минск, Беларусь
Системный анализ острых респираторных заболеваний показывает наличие совокупности объективных предпосылок и причин, обусловливающих необходимость дальнейшего исследования с целью повышения достоверности диагностирования заболеваний. До настоящего времени острые респираторные заболевания (ОРЗ) остаются одной из актуальных проблем педиатрии и здравоохранения в целом. Возбудителями ОРЗ чаще являются вирусы. Согласно данным Национального центра по гриппу, доля аденовирусов в этиологической структуре ОРВИ достигала выше 30% в 2007-2008 гг. и превышала долю всех остальных вирусов [1, 2].
На начальной стадии заболевания сходство клинических проявлений, отсутствие патогномоничных симптомов не позволяют проводить раннюю этиологическую диагностику острых респираторных вирусных инфекций (ОРВИ) без лабораторных исследований. Используемые в вирусологических лабораториях республики методы диагностики аденовирусной инфекции в материале от больных (экспресс метод (МФА), молекулярный метод (ПЦР)) или по совокупности клинико-эпидемиологические данные не всегда обеспечивают достоверность доказательства этиологической роли выделенного вируса. Поэтому необходимо дополнительное проведение подтверждающих серологических тестов (РСК, РН и ИФА), направленных на выявление антител разных типов. В этой связи получение антигена для серодиагностики аденовируса приобретает в последние годы все большую практическую значимость [3, 4].
Целью работы являлась получение антигена аденовирусного для серологических реакций.
Материалы и методы. Культура клеток. В работе использовали перевиваемую культуру клеток Hep-2C из коллекции клеточных культур ГУ «РНПЦ эпидемиологии и микробиологии».
Заражение культуры клеток биологическим материалом. Перевиваемую культуру клеток, выращенную во флаконах, инфицировали вирусом в необходимом разведении, затем вносили поддерживающую среду DMEM. Через 72 часа инкубации в термостате при температуре 37°С оценивали под микроскопом состояние монослоя клеток [4].
Иммуноферментный анализ. Постановку ИФА осуществляли по методу, описанному Егоровым А.М. (1991) с нашими модификациями.
Реакция связывание комплимента. Постановку РСК осуществляли по методу описанному Здрадовским П.Ф. (1965).
Иммунный блоттинг проводили по стандартной методике, описанной
Towbin H. (1979).
279
Инактивация вируса. Вирус инактивировали 1% теотропином А24. Смесь инкубировали при температуре 37°С в течение 24 часов. Полноту инактивации проверяли методом трехкратных «слепых» пассажей в культуре клеток Hep-2С.
Статистическая обработка данных. Инфекционную активность полученных вирусов определяли путѐм титрования в чувствительных культурах клеток, вычисляя титр вируса в lg TЦД50/мл по общепринятой методике Reed и Mench (1938).
Результаты и обсуждение. Получение аденовирусного антигена занимает важное место в изготовлении инактивированного антигена для серологических реакций. В качестве производственного штамма использовали аденовирус 3 серотипа.
Для накопления высокого титра аденовируса использовали культуру клеток Hep-2C. Культуру инфицировали вирусом с титром 0,1 lg ТЦД50/клетка. При таком условии заражения удалось получить максимальное накопление вирусного агента с титром равный 2,5 0,21 lg ТЦД50/мл.
В качестве инактиватора был выбран 1% теотропин А24. С помощью этого вещества удалось убрать инфекционность вируса уже через 24 часа при
37°С.
Немаловажным фактором при производстве антигена является стабилизирующая среда и режим лиофилизации.С этой целью был отработан режим лиофильной сушки с различными концентрациями белка. До и после сушки определяли титр вируса во всех образцах. Результаты приведены в таблице 1.
Таблица 1 — Влияние различных режимов сушки на инфекционную активность вируса
Вирус* и стабилизатора |
Титр антигена, lg ТЦИД50/мл |
|||
до сушки |
после сушки |
|||
|
|
|||
КС + без стабилизатора |
2,4 |
1,6 |
||
КС + 10% |
сахарозы |
2,4 |
1,3 |
|
КС + 10% |
сахарозы + 1% ЭТС |
2,4 |
1,8 |
|
КС + 10% |
сахарозы + 30% ЭТС |
2,4 |
1,8 |
|
КС + 10% |
ЭТС |
2,4 |
1,1 |
|
* КС — культуральная суспензия.
Как видно из таблицы 1, аденовирус, высушенный без каких либо стабилизаторов, обладал сравнительно высоким остаточным титром. Полученные результаты показали, что сушка в отсутствии белка с 10% сахарозы является менее щадящей, и титр антигена снижается значительно — с 2,4 до 1,3 lg. Лучшим защитным эффектом в лиофилизации антигена обладали стабилизирующие добавки с 10% и 30% содержанием ЭТС, где вирусная активность сохраняется до 1,8 lg. Оптимальным режимом, позволяющим сохранить инфекционность вируса в присутствии незначительного содержания белка, является сушка с 10% сахарозы и 1% белка. При постановке серологических реакций избыток белка может вызывать ложноотрицательные или ложноположительные результаты.
Полученный антиген должен отвечать определенным иммунологическим
280
