
- •6.Биноминальное распределение. Распределения Пуассона и Гаусса. Флуктуации.
- •8.Распределение Максвелла по абсолютному значению скорости. Характерные скорости.
- •12.Процессы переноса в газах. Теплопередача, диффузия и трение. Взаимодиффузия в газе из различных молекул. Основные особенности явлений переноса в твердых телах и жидкостях.
- •13.Физические явления в разреженных газах. Явления в сосудах, сообщающихся через пористую перегородку.
- •16.Броуновское движение.Вращательное броуновское движение
- •17 Степени свободы молекул. Теорема о равнораспределении энергии по степеням свободы. Внутренняя энергия идеального газа.
- •18.Теплоемкость идеального газа.Расхождение теории теплоемкостей.
- •19.Внутренняя энергия тел.Теплоемкость изотропных и однородных тел.Количество теплоты.
- •21.Работа.Первое начало термодинамики.Равновесные и неравновесные процессы.
- •23. Скорость звука в газах. Уравнение Бернулли.
- •24.Тепловая машина.Кпд цикла.Холодильная Машина.Цикл Карно.Кпд Карно.
- •25.Формулировка Клаузиуса и Томсона(Кельвина) второго начала темодинамики.Первая теорема Карно.Равенство Клаузиуса.
- •26.Энтропия,Энтропия идеального.Вторая теорема Карно.Неравенство Клаузиуса.Изменени энтропии при необратимых процессах.
- •27.Формулировка второго начала темодинамики с помощью энтропии.Роль энтропии в производстве.Статистический характер.
- •28.Термодтнамическое равновесие. Эмпирические шкалы температур Международная практическая шкала Термодинамическая шкала Отрицательные абсолютные температуры
- •29.Понятие о термодинамич потенциалах.Принцип Ле-Шателье-Брауна.
- •30.Силы межмолекулярного взаимодействия.Ионная связь.Ковалентная связь.Силы Ван-дер-Ваальса.Потенциал Ленарда-Джонса.
- •31.Ураынение Ван-дер-Вальса. Изотермы газа Ван-дер-Вальса. Правило Максвела. Метостобильное состояние
- •32. Приведенное уравнения Ван-дер-Вальса. Внутрения энергия газа ванн-дер-Вальса.
- •33. Эффект Джоуля-Томсана
- •34.Переход из газообразного в жидкое. Экспериментальные изотермы.
- •35. Поведение 2-х фазной сис-мы. Ур Клапейрона-Клаузиуса
- •36.Зависимость свойств реальных газов от идеальных..
- •37.Вириальное ур состояния.
- •38.Сжижение газов. Свойство веществ при температуре близктй к 0.
- •39.Свойства и структура жидкостей жидкие кристаллы. Теплоёмкость жидкостей.
- •40.Поверхностное натяжение. Условия равновесия на границе двух жидкостей и на границе жидкость – твердое тело.
- •41.Давление под искривленной поверхностью жидкости. Капиллярные явления.
- •43.Кипение. Перегретая жидкость. Пузырьковая камера. Переохлажденный пар. Камера Вильсона.
- •44.Жидкие растворы. Растворимость. Теплота растворения.
- •45.Идеальные растворы. Закон Рауля. Закон Генри. Зависимость растворимости от температуры.
- •46. Диаграмма состояния раствора. Кипение жидких растворов.
- •48. Фазовые переходы первого и второго рода. Кристаллизация и плавление. Сублимация. Фазовые диаграммы. Полиморфизм.
- •49.Симметрия твердых тел. Кристаллические решетки. Примитивная решетка. Элементы симметрии решетки. Обозначения атомных плоскостей и направлений.
- •50.Теплоёмкость твёрдых тел. Физические процессы в кристаллах при деформациях. Дислокации.
25.Формулировка Клаузиуса и Томсона(Кельвина) второго начала темодинамики.Первая теорема Карно.Равенство Клаузиуса.
Формула показывает, что не может быть к. п. д. большего единицы, но сама по себе она не исключает возможности его равенства единице. Это может произойти, если Q(-} = 0, т. е. если теплота, поступившая от термостата в машину, полностью превращается в работу.
Принципом Кельвина называется утверждение о том, что невозможен циклический процесс, единственным результатом которого является производство работы и обмен теплоты с одним тепловым резервуаром: Превращение некоторого количества теплоты в работу обязательно должно сопровождаться передачей теплоты
от нагревателя к холодильнику. Это одно из выражений второго начала термодинамики.
Клаузиуса. Другой из возможных форму-
лировок второго начала термодинамики является следующая: невозможен циклический процесс, единственным
результатом которого была бы передача теплоты от менее нагретого тела к более нагретому. В такой формулировке справедливость второго начала термодинамики почти очевидна: трудно представить себе возможность ситуации, когда не произошло никаких изменений,
а некоторое количество теплоты как бы само собой перешло от тела с меньшей температурой, которое охладилось, к телу с большей температурой, которое еще
больше нагрелось:Первая теорема Карно.
Все обратимын машины, работающие по циклу Карно, имеют одинаковый коэффициент полезного действия.Другими словами, первая теорема Карно не зависит от рабочего вещества и конструктивных деталей осуществления цикла.
26.Энтропия,Энтропия идеального.Вторая теорема Карно.Неравенство Клаузиуса.Изменени энтропии при необратимых процессах.
Разделив обе части равенства, выражающего первое начало термодинамики, на Т, получим

Подставляя р/Т= R/V и учитывая, что dT/T= dlnT dV/V= dln V, получаем1

Правая часть равенства представляет собой полный дифференциал. Следовательно,
левая часть bQ/T также полный дифференциал. Функция состояния, дифференциалом которой является bQ/T, называется энтропией и обозначается S. Таким образом,

Применим формулу для вычисления изменения энтропии в изотермическом процессе (Т— const), где энергетическое состояние газа остается неизменным, а всевозможные изменения характеристик обусловлены лишь изменением объема. Для этого случая

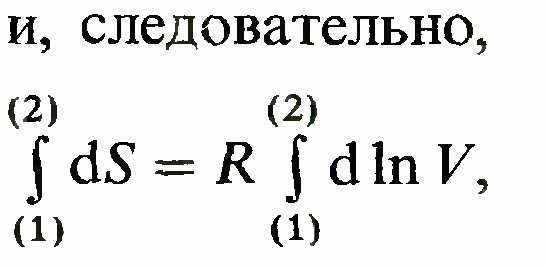
что после интегрирования дает
![]()
После несколькіх преобразованій получаем:


энтропия S определяется логарифмом числа микросостояний, посредством которых реализуется рассматриваемое макросостояние,т.е.

Это равенство называется формулой Больцмана.
Расчет изменения энтропии в процессах идеального газа проводится по формуле 1
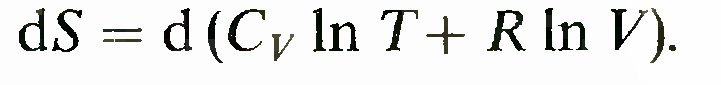
При изохорическом процессе (d.V = 0)
при увеличении
объема энтропия возрастает, при уменьшении
— уменьшается.

т. е. при увеличении температуры энтропия увеличивается. Этот результат объясняется
следующим: средняя энергия частиц растет с ростом температуры, а поэтому увеличивается и число возможных энергетических состояний.
При адиабатическом процессе получаем



Тогда формула принимает вид

Таким образом, при адиабатическом обратимом процессе энтропия не изменяется. Нетрудно
понять, почему это происходит. При адиабатическом расширении газа за счет увеличения объема энтропия увеличивается, однако за счет уменьшения температуры, которое при этом происходит, она уменьшается и эти две тенденции полностью компенсируют друг друга.
Вторая теорема Карно. к. п. д. обратимого цикла Карно больше к. п. д. любого другого обратимого цикла, в котором максимальные и минимальные температуры равны соответственно температуре нагревателя и температуре холодильника цикла Карно.
Математически формулируется.
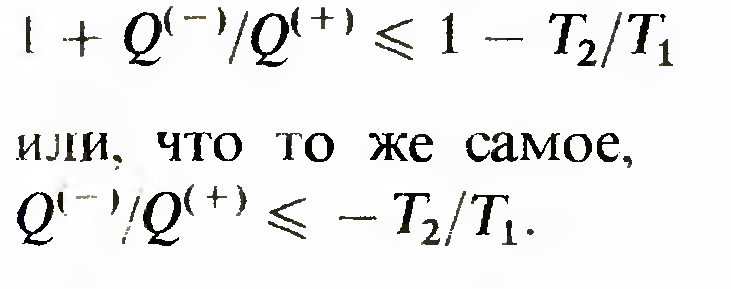
Знак минус в этом неравенстве учитывает, что знаки Q(+) и Q( -} различны.

Соотношение 2 , переписанное в виде
называется неравенством Клаузиуса для цикла Карно. Очевидно, что знак равенства относится к обратимому циклу.Неравенство Клаузиуса
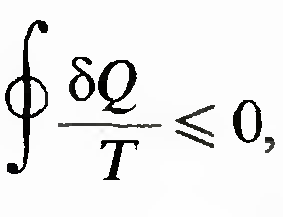
в неравенстве Клаузиуса знак равенства относится к обратимым процессам, а знак неравенства — к необратимым.
Изменение энтропии в необратимых процессах. Вычисление основывается на том,
что энтропия является функцией состояния. Если система перешла из одного состояния
в другое посредством необратимого процесса, то логично мысленно перевести систему из первого состояния во второе с помощью некоторого обратимого процесса и рассчитать происходящее при этом изменение энтропии. Оно равно
изменению энтропии при необратимом процессе.
Рассмотрим изменение энтропии при выравнивании температуры двух тел, приведенных в тепловой контакт. Обозначим массы, удельные теплоемкости при постоянном
объеме и температуры первого и второго тел соответственно m1,cv1, T1 и m2, cv2,
Т2. При тепловом контакте температуры тел выравниваются. Будем считать для упрощения расчета, что теплообмен происходит при постоянном объеме (Vi2 = const) каждого из тел, теплоемкости сv1 и cv2 не зависят от температуры, T1> Т2. Для определения температуры T3, которую будут иметь тела после достижения термодинамического равновесия, можно написать уравнение
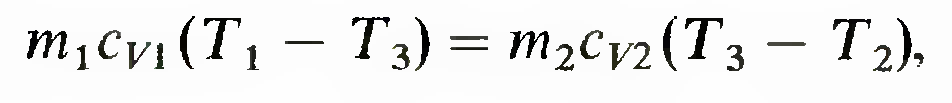
из которого следует, что
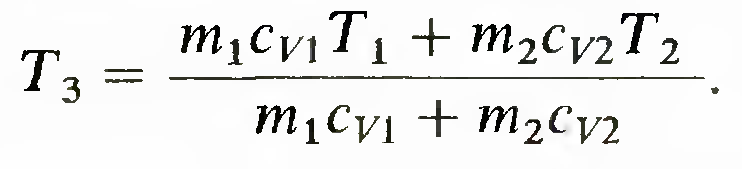
изменение энтропии можно рассчитать с помощью обратимого процесса по формуле

где bQ — mcvdT. Вычислив интегралы, получим
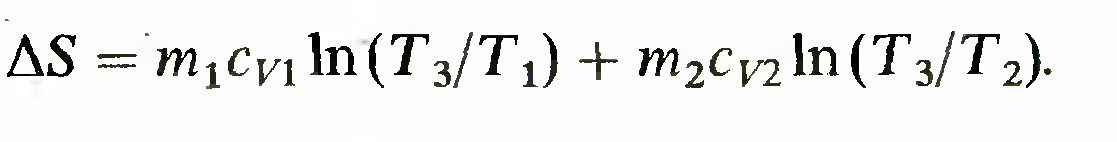
Это и есть изменение энтропии в необратимом процессе
28.Термодинамическое равновесие.Термометры.Шкала Кельвина. Термодинамическая шкала температур. Доказано, что
к. п. д.
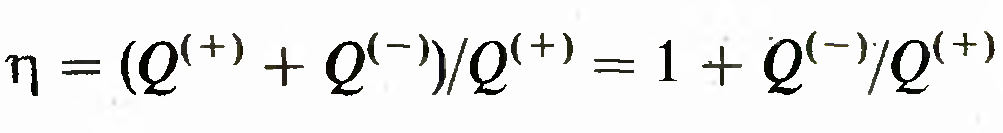
имеет одинаковое значение для всех обратимых машин,
работающих с нагревателем температуры Т1 и с холодильником температуры Т2. Поэтому Q(-)/Q{+) является функцией тлько от T1 и Т2:

Две обратимые машины а и b в комбинации составляют одну обратимую машину, к. п. д. которой должен быть равным к. п. д. машины с. Это означает, что

Соотношение для этих машин имеет вид

При преобразованиях получаем.

где ф — новая функция. Тем самым доказано, что отношение количеств теплоты в цикле Карно выражается в виде
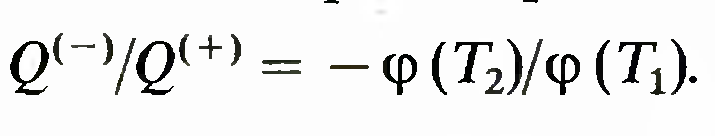
В принципе функцию ф можно выбрать бесчисленными способами и тем самым
получить множество различных шкал температур. Кельвин предложил выбрать простейшую зависимость5
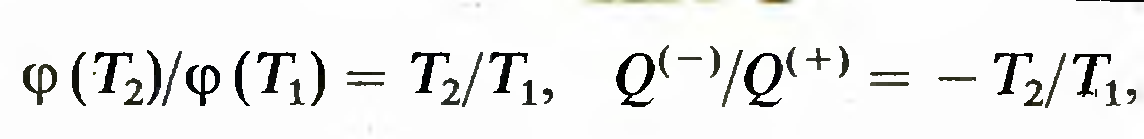
которая фиксирует термодинамическую шкалу температур. В ней коэффициент полезного действия обратимой машины, работающей по циклу Карно, равен
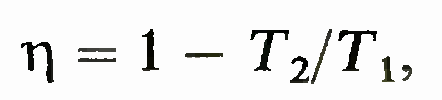
во всем предшествующем
изложении буква Т означала температуру в одной и той же шкале и являлась термодинамической температурой.
Отрицательная термодинамическая температура. Исходя из второго начала термодинамики, можно доказать невозможность отрицательных термодинамических температур.
Пусть тело с отрицательной температурой Т2 выбрано в качестве холодильника
в цикле Карно. Тогда правая часть равенства 5 положительна, как и Q{+) — количество теплоты, взятое у нагревателя. Следовательно, Q(-) также положительная величина. Это означает, что такая машина должна брать теплоту также из холодильника, т. е. берется теплота и из нагревателя и из холодильника и нацело превращается в работу. Но это противоречит второму началу термодинамики в формулировке Кельвина и, следовательно, неосуществимо. Поэтому отрицательная температура не возможна.
