
- •Міністерство освіти і науки україни
- •Частина і. Термодинаміка
- •1.1 Основи термодинаміки
- •1.1.1 Основні поняття технічної термодинаміки. Основні термодинамічні параметри. Рівняння стану.
- •1.1.2 Газові суміші
- •1.1.3 Калоричні параметри стану
- •1.1.4 Ентропія
- •1.1.4.1 Робота зміни об’єму
- •1.1.5 Робота і теплота
- •1.1.6 Перший закон термодинаміки
- •1.1.7 Теплоємність
- •1.1.8 Теплоємність металів і металовмісних сполук
- •1.1.9 Термодинамічні процеси ідеальних газів у закритих системах
- •Політропний процес
- •1.1.10 Другий закон термодинаміки
- •Цикл Карно
- •1.1.11 Формулювання другого закону термодинаміки
- •1.2 Основи хімічної кінетики
- •1.2.1 Швидкість хімічних реакцій
- •1.2.2 Вплив температури на швидкість хімічних реакцій
- •1.2.3 Хімічна рівновага
- •1.2.4 Константа рівноваги хімічної реакції залежить від температури.
- •1.3 Основи хімічної термодинаміки, поняття хімічної термодинаміки
- •1.3.1 Основи хімічної термодинаміки
- •1.3.2 Закон Гесса і його наслідки
- •1.3.3 Залежність теплового ефекту хімічної реакції від температури. Закон Кірхгофа
- •1.4 Деякі явища в рідних середовищах і на поверхні розподілу фаз
- •1.4.1 Розчинність газів
- •1.4.2 Розподіл компонента між двома рідинами
- •1.4.3 Поверхневий натяг
- •1.4.4 Адсорбція
- •1.4.5 Умова змочування і незмочування рідин
- •1.4.6 Дисоціація окисів
- •2 Теплообмін при зварюванні
- •2.1 Теплопровідність
- •2.1.1 Теплопровідність під час стаціонарного режиму і граничних умов 1 роду
- •2.1.2 Частинні випадки рівняння теплопровідності
- •Крайові умови
- •2.1.3 Теплопровідність за наявності внутрішніх джерел теплоти
- •Необмежена пластина
- •Циліндричний стержень
- •2.1.4 Необмежена плоска стінка
- •2.1.5 Циліндрична стінка
- •2.1.6 Теплопровідність під час стаціонарного режиму і граничних умовах III роду (теплопередача)
- •2.1.7 Теплопередача через плоску стінку
- •Розв'язання
- •2.2 Конвективний теплообмін
- •2.2.1 Основні поняття та визначення конвективного теплообміну
- •2.2.2 Узагальнюючі залежності (рівняння подібності) конвективного теплообміну
- •2.3 Теплообмін випроміненням
- •2.3.1 Основні поняття і визначення
- •2.3.3 Випромінення сірих тіл
- •2.3.4 Теплообмін випроміненням між твердими тілами
- •2.3.5 Теплові екрани
- •2.3.6 Випромінення газів
- •Перелік використаних і рекомендованих джерел
1.2.3 Хімічна рівновага
Розрізняють реакції оборотні і необоротні. Оборотна хімічна реакція закінчується настанням рівноваги. У цих реакціях швидкість прямої реакції співставна з швидкістю оберненої реакції.
Такі реакції записуються в загальному вигляді рівнянням:
 ↔
↔
А в тому випадку, коли швидкість оберненої реакції дуже мала у порівнянні зі швидкістю прямої реакції, то реакція йде до повного перетворення вихідних речовин у продукти реакції. Така реакція записується в загальному випадку так:

При проходженні оборотних реакцій концентрація вихідних речовин зменшується, а разом з цим зменшується швидкість прямої реакції.

Одночасно зростає швидкість оберненої реакції

Це призводить до того, що зменшується швидкість сумарної реакції

яка в кінці кінців стає рівною нулю. При цьому досягається стан, який називається хімічною рівновагою. У цьому стані швидкість прямої реакції і зворотної однакові


Тут буквами позначено зрівноважені концентрації компонентів реакції.

Внаслідок
того, що константи швидкості
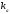 і
і не залежать від концентрації речовин,
які зазнають змін в реакції, то константа
рівноваги
не залежать від концентрації речовин,
які зазнають змін в реакції, то константа
рівноваги не
залежить від концентрації. Константа
рівноваги реакції може бути виражена
через парціальні тиски компонентів
реакції
не
залежить від концентрації. Константа
рівноваги реакції може бути виражена
через парціальні тиски компонентів
реакції

де
 -
алгебраїчна сума стехіометричних
коефіцієнтів газів, які приймають участь
в реакції,
-
алгебраїчна сума стехіометричних
коефіцієнтів газів, які приймають участь
в реакції,
R – універсальна газова стала.
При
обчисленні
 молей
утворених продуктів реакції беруть із
знаком «+», а числа молей вихідних речовин
в реакції із знаком «–».
молей
утворених продуктів реакції беруть із
знаком «+», а числа молей вихідних речовин
в реакції із знаком «–».
Якщо
 ,
то
,
то
З константою рівноваги хімічної реакції пов’язана хімічна спорідненість реагуючих речовин, яка характеризується максимально роботою хімічної реакції. Величина максимальної роботи виражається зміною ізотермічних потенціалів. Для реакції
 ↔
↔

Для ізохорно-ізотермічної реакції зміну ізохорно-ізотермічного потенціалу знаходять за формулою
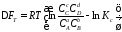
Зміна ізобарно-ізотермічного потенціалу

Тут
 ,
, -
константа рівноваги реакції при
температурі
T;
-
константа рівноваги реакції при
температурі
T;
 ,
, ,
, ,
, - нерівноважені концентрації реагуючих
речовин,
- нерівноважені концентрації реагуючих
речовин,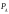 ,
, ,
, ,
, - нерівноважені парціальні тиски
реагуючих речовин. Термодинамічне
співвідношення називають рівняннями
ізотерми хімічної реакції. Ці рівняння
дають можливість визначити, в якому
напрямі і до якої межі може проходити
реакція. Знак «мінус» перед
- нерівноважені парціальні тиски
реагуючих речовин. Термодинамічне
співвідношення називають рівняннями
ізотерми хімічної реакції. Ці рівняння
дають можливість визначити, в якому
напрямі і до якої межі може проходити
реакція. Знак «мінус» перед ,
, вказує на
можливість самочинного протікання
прямої реакції; знак «плюс» вказує на
те, що самочинно реакція може протікати
в зворотному напрямі. Якщо
вказує на
можливість самочинного протікання
прямої реакції; знак «плюс» вказує на
те, що самочинно реакція може протікати
в зворотному напрямі. Якщо
 ,
, ,
то система перебуває в стані термодинамічної
рівноваги.
,
то система перебуває в стані термодинамічної
рівноваги.
Для оцінки хімічної спорідненості різних реакцій використовують величину стандартної спорідненість, при цьому концентрації вихідних речовин і кінцевих продуктів реакцій дорівнюють


За
відомим значенням
 і
і
 реакцій за
стандартних умов, можна знайти константи
хімічної рівноваги
реакцій за
стандартних умов, можна знайти константи
хімічної рівноваги
 і
і
 .
Зміну стандартного ізобарно-ізотермічного
потенціалу можна обчислити за табличними
величинами
.
Зміну стандартного ізобарно-ізотермічного
потенціалу можна обчислити за табличними
величинами і
і реагуючих
речовин
реагуючих
речовин

Ця
формула може бути використана для
наближеного обчислення
 для інших температур, якщо не враховувати
температурну залежність теплоємності
реагуючих речовин.
для інших температур, якщо не враховувати
температурну залежність теплоємності
реагуючих речовин.
1.2.4 Константа рівноваги хімічної реакції залежить від температури.
Установимо зв'язок між константою рівноваги і температурою вико рис-тавши рівняння Гібса-Гельмгольца.

 -
зміна внутрішньої енергій, А – максимальна
робота хімічної реакції.
-
зміна внутрішньої енергій, А – максимальна
робота хімічної реакції.
Для стандартних умов рівняння Гібса-Гельмгольца можна записати у вигляді

Продиференціюємо
рівняння

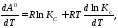

Оскільки
 дане рівняння набуває вигляду
дане рівняння набуває вигляду
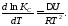
При
 тоді
тоді

Отримане рівняння є рівнянням ізохори реакції.
За
умови
 можна
отримати рівняння ізобари реакції
можна
отримати рівняння ізобари реакції

При інтегруванні рівняння ізохори ізобари хімічної реакції отримаємо рівняння


Отримані рівняння дають можливість обчислити константу рівноваги реакції за заданої температури, якщо відомі її значення для іншої температури і тепловий ефект. За двома константами рівноваги за двох температур можна обчислити середнє значення теплового ефекту реакції.
