
- •Міністерство освіти і науки україни
- •Частина і. Термодинаміка
- •1.1 Основи термодинаміки
- •1.1.1 Основні поняття технічної термодинаміки. Основні термодинамічні параметри. Рівняння стану.
- •1.1.2 Газові суміші
- •1.1.3 Калоричні параметри стану
- •1.1.4 Ентропія
- •1.1.4.1 Робота зміни об’єму
- •1.1.5 Робота і теплота
- •1.1.6 Перший закон термодинаміки
- •1.1.7 Теплоємність
- •1.1.8 Теплоємність металів і металовмісних сполук
- •1.1.9 Термодинамічні процеси ідеальних газів у закритих системах
- •Політропний процес
- •1.1.10 Другий закон термодинаміки
- •Цикл Карно
- •1.1.11 Формулювання другого закону термодинаміки
- •1.2 Основи хімічної кінетики
- •1.2.1 Швидкість хімічних реакцій
- •1.2.2 Вплив температури на швидкість хімічних реакцій
- •1.2.3 Хімічна рівновага
- •1.2.4 Константа рівноваги хімічної реакції залежить від температури.
- •1.3 Основи хімічної термодинаміки, поняття хімічної термодинаміки
- •1.3.1 Основи хімічної термодинаміки
- •1.3.2 Закон Гесса і його наслідки
- •1.3.3 Залежність теплового ефекту хімічної реакції від температури. Закон Кірхгофа
- •1.4 Деякі явища в рідних середовищах і на поверхні розподілу фаз
- •1.4.1 Розчинність газів
- •1.4.2 Розподіл компонента між двома рідинами
- •1.4.3 Поверхневий натяг
- •1.4.4 Адсорбція
- •1.4.5 Умова змочування і незмочування рідин
- •1.4.6 Дисоціація окисів
- •2 Теплообмін при зварюванні
- •2.1 Теплопровідність
- •2.1.1 Теплопровідність під час стаціонарного режиму і граничних умов 1 роду
- •2.1.2 Частинні випадки рівняння теплопровідності
- •Крайові умови
- •2.1.3 Теплопровідність за наявності внутрішніх джерел теплоти
- •Необмежена пластина
- •Циліндричний стержень
- •2.1.4 Необмежена плоска стінка
- •2.1.5 Циліндрична стінка
- •2.1.6 Теплопровідність під час стаціонарного режиму і граничних умовах III роду (теплопередача)
- •2.1.7 Теплопередача через плоску стінку
- •Розв'язання
- •2.2 Конвективний теплообмін
- •2.2.1 Основні поняття та визначення конвективного теплообміну
- •2.2.2 Узагальнюючі залежності (рівняння подібності) конвективного теплообміну
- •2.3 Теплообмін випроміненням
- •2.3.1 Основні поняття і визначення
- •2.3.3 Випромінення сірих тіл
- •2.3.4 Теплообмін випроміненням між твердими тілами
- •2.3.5 Теплові екрани
- •2.3.6 Випромінення газів
- •Перелік використаних і рекомендованих джерел
1.3.2 Закон Гесса і його наслідки
Внаслідок того, що внутрішня енергія і ентальпія є функціями стану, тепловий ефект реакції при сталому об’ємі не залежить від термодинамічного шляху процесу, а визначається лише початковим і кінцевим станом системи. Цю закономірність встановив у 1840 р. Гесс Г.І., який сформулював основний закон термохімії:
Тепловий ефект реакції залежить лише від початкового та кінцевого стану системи і не залежить від шляху, по якому протікає реакція. Із закону Гесса випливають наслідки :
Тепловий ефект утворення складної речовини чисельно дорівнює тепловому ефекту її розкладання.
Якщо із двох різних початкових речовин досягається один і той самий кінцевий результат, то різниця теплових ефектів обох реакцій дорівнює тепловому ефекту переходу із одного початкового стану в другий.
Якщо із одного і того ж початкового стану досягається двох різних кінцевих сигналів, то різниця теплових ефектів цих реакцій дорівнює тепловому ефекту переходу із одного кінцевого стану в інший.
Тепловий ефект хімічної реакції дорівнює різниці між сумою теплот утворення продуктів
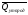 і
сумою теплот утворення вихідних речовин
і
сумою теплот утворення вихідних речовин з
врахуванням стехіометричних коефіцієнтів
речовини в рівнянні реакції:
з
врахуванням стехіометричних коефіцієнтів
речовини в рівнянні реакції:

Тепловий ефект хімічної реакції дорівнює різниці між сумою теплот згорання продуктів реакції
 і
сумою теплот згорання продуктів реакції
і
сумою теплот згорання продуктів реакції
 з
врахуванням стехіометричних коефіцієнтів
речовин у рівнянні реакції:
з
врахуванням стехіометричних коефіцієнтів
речовин у рівнянні реакції:

Закон
Гесса і наслідки з нього дають змогу
обчислити тепловий ефект реакцій на
основі табличних даних про теплоти
утворення неорганічних речовин і теплоти
згоряння органічних сполук за сталих
умов. Внаслідок того, що розрахунки в
хімії виконують для ізобарних процесів,
можна скористатись табличним значенням

Для
простих речовин

Приклад 1. Визначити теплоту згоряння етилену

Розв’язок. Скористаємось двома методами: 1-й метод. Комбінуючи задані термодинамічні рівняння встановимо водень і вуглець. З цією метою рівняння (б) множимо на 2 і віднімаємо із нього рівняння (а):

Отриманий результат почленно додамо до рівняння (в), попередньо помножимо на 2

2-й
метод. Використовуючи третій наслідок
Гесса, внаслідок того, що всі приведені
в умові задач теплові ефекти є теплотами
утворення етилену, діоксину вуглецю і
води із простих речовин


Теплоти утворення простих речовин водню і кисню дорівнюють нулю.
1.3.3 Залежність теплового ефекту хімічної реакції від температури. Закон Кірхгофа
Тепловий
ефект
 є функціями відповідно внутрішньої
енергії та ентальпії, тому вони залежать
від температури і тиску, а для ідеальних
газів, лише від температури. Щоб встановити
залежність від температури теплового
ефекту ізохорної реакції, продиференціюєм
за температурою рівняння
є функціями відповідно внутрішньої
енергії та ентальпії, тому вони залежать
від температури і тиску, а для ідеальних
газів, лише від температури. Щоб встановити
залежність від температури теплового
ефекту ізохорної реакції, продиференціюєм
за температурою рівняння
 .
.

тут
 - сумані
істинні теплоємності відповідно вихідних
і кінцевих компонентів реакції
- сумані
істинні теплоємності відповідно вихідних
і кінцевих компонентів реакції
 отримаємо
отримаємо

отримані
співвідношення можна узагальнити
формулою
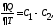 яка означає
математичний вираз закону Кірхгофа.
Закон Кірхгофа формулюється так:
яка означає
математичний вираз закону Кірхгофа.
Закон Кірхгофа формулюється так:
Похідна теплового ефекту по температурі дорівнює різниці сумарної теплоємності вихідних і кінцевих компонентів реакції.
Конкретні значення коефіцієнтів теплоємності С1 і С2 залежить від вигляду рівняння хімічної реакції.
У загальному вигляді і для реакції
аА+вВ+…=сС+dD+…
маємо
C1=аСА+вСВ+…= .
.
С2=сСС+dCD+…=
тут
n1
число
кіломолей кожної із вихідних речовин,
а
 -
мольна істинна теплоємність
-
мольна істинна теплоємність і
і число
кіломолей і мольна теплоємність кожного
із продуктів реакції.
число
кіломолей і мольна теплоємність кожного
із продуктів реакції.
Для отриманої шуканої залежності в явному вигляді проінтегруємо диференціальне рівняння dQ=C1dT- C2dT, тоді одержимо

Це рівняння можна записати у вигляді

Тут
під
 мається на
увазі число кіломолей кожного із
компонентів реакції.
мається на
увазі число кіломолей кожного із
компонентів реакції.
Якщо відомий тепловий ефект реакції за стандартних умов Q0, можна знайти тепловий ефект реакції за будь-якої температури за формулою

Для реакцій, в яких залежність теплоємності від температури виражається поліномом Сіст=а0+а1T+ а2T2+…

Тут
 -
алгебраїчні струми постійних а0,
а1,
а2 індивідуальних
речовин у відповідних рівнях. При
додаванні постійних величин, які
розміщені зліва в рівняннях реакції,
беруть із знаком «-», а величини які
розташовані справа, зі знаком «+». Якщо
температурна залежність теплоємності
від температури виражається рядом
-
алгебраїчні струми постійних а0,
а1,
а2 індивідуальних
речовин у відповідних рівнях. При
додаванні постійних величин, які
розміщені зліва в рівняннях реакції,
беруть із знаком «-», а величини які
розташовані справа, зі знаком «+». Якщо
температурна залежність теплоємності
від температури виражається рядом

При
практичних розрахунках тепловий ефект
знаходять за даними таблиць в яких Н
ентальпії реагуючих речовин. Перехід
системи із одного стану в інший
супроводжується зміною його ентальпії .
.
Різниця між початковими речовинами і вихідними речовинами за заданої температури T рівна

Приклад 1. Тепловий ефект згоряння CO до СО2 при 25 °С дорівнює 283 кДж/моль. Визначити залежність теплового ефекту цієї реакції від температури і його величину при 2000 К. Температурні залежності молярних теплоємностей речовини, які приймають в реакції виражаються рівняннями для СО2


