
- •Міністерство освіти і науки україни
- •Частина і. Термодинаміка
- •1.1 Основи термодинаміки
- •1.1.1 Основні поняття технічної термодинаміки. Основні термодинамічні параметри. Рівняння стану.
- •1.1.2 Газові суміші
- •1.1.3 Калоричні параметри стану
- •1.1.4 Ентропія
- •1.1.4.1 Робота зміни об’єму
- •1.1.5 Робота і теплота
- •1.1.6 Перший закон термодинаміки
- •1.1.7 Теплоємність
- •1.1.8 Теплоємність металів і металовмісних сполук
- •1.1.9 Термодинамічні процеси ідеальних газів у закритих системах
- •Політропний процес
- •1.1.10 Другий закон термодинаміки
- •Цикл Карно
- •1.1.11 Формулювання другого закону термодинаміки
- •1.2 Основи хімічної кінетики
- •1.2.1 Швидкість хімічних реакцій
- •1.2.2 Вплив температури на швидкість хімічних реакцій
- •1.2.3 Хімічна рівновага
- •1.2.4 Константа рівноваги хімічної реакції залежить від температури.
- •1.3 Основи хімічної термодинаміки, поняття хімічної термодинаміки
- •1.3.1 Основи хімічної термодинаміки
- •1.3.2 Закон Гесса і його наслідки
- •1.3.3 Залежність теплового ефекту хімічної реакції від температури. Закон Кірхгофа
- •1.4 Деякі явища в рідних середовищах і на поверхні розподілу фаз
- •1.4.1 Розчинність газів
- •1.4.2 Розподіл компонента між двома рідинами
- •1.4.3 Поверхневий натяг
- •1.4.4 Адсорбція
- •1.4.5 Умова змочування і незмочування рідин
- •1.4.6 Дисоціація окисів
- •2 Теплообмін при зварюванні
- •2.1 Теплопровідність
- •2.1.1 Теплопровідність під час стаціонарного режиму і граничних умов 1 роду
- •2.1.2 Частинні випадки рівняння теплопровідності
- •Крайові умови
- •2.1.3 Теплопровідність за наявності внутрішніх джерел теплоти
- •Необмежена пластина
- •Циліндричний стержень
- •2.1.4 Необмежена плоска стінка
- •2.1.5 Циліндрична стінка
- •2.1.6 Теплопровідність під час стаціонарного режиму і граничних умовах III роду (теплопередача)
- •2.1.7 Теплопередача через плоску стінку
- •Розв'язання
- •2.2 Конвективний теплообмін
- •2.2.1 Основні поняття та визначення конвективного теплообміну
- •2.2.2 Узагальнюючі залежності (рівняння подібності) конвективного теплообміну
- •2.3 Теплообмін випроміненням
- •2.3.1 Основні поняття і визначення
- •2.3.3 Випромінення сірих тіл
- •2.3.4 Теплообмін випроміненням між твердими тілами
- •2.3.5 Теплові екрани
- •2.3.6 Випромінення газів
- •Перелік використаних і рекомендованих джерел
1.1.9 Термодинамічні процеси ідеальних газів у закритих системах
Метою аналізу термодинамічного процесу є виявлення закономірностей зміни стану робочого тіла та особливостей перетворення енергії в даному процесі.
Ізохорний процес ( v = const)
Ізохорним називається процес, який проходить за сталого об’єму.



а) б) в)
Рисунок 1.1 - Графічне зображення ізохорного процесу
Запишемо для ізохорного процесу рівняння стану

Розділивши почленно ці рівняння, отримаємо

Перший закон для термодинаміки для ізохорного процесу

Вся теплота в ізохорному процесі витрачається на зміну внутрішньої енергії.
Зміну ентальпії в ізохорному процесі знаходять за формулою
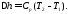
Зміна ентропії

Ізобарний процес ( р = const)
У p-vкоординатах процес зображається прямою 1-2, в T-Sкоординатах –логарифмічною кривою.



а б в
Рисунок 1.2 - Графічне зображення ізобарного процесу
Запишемо рівняння стану для двох точок процесу
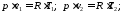
Розділивши почленно ці рівняння, отримаємо

Зміну внутрішньої енергії та ентальпії в ізобарному процесі визначають за формулами

Робота процесу

Для ідеального
газу
 тому
тому

Кількість підвищеної теплоти в ізобарному процесі дорівнює зміні ентальпії

Зміна ентропії

Ізотермічний процес ( T=const)



а б в
Рисунок 1.3 - Графічне зображення ізотермічного процесу
Зміна внутрішньої енергії і ентальпії в ізотермічному процесі дорівнює нулю.
Відповідно до першого закону термодинаміки вся теплота витрачається на виконання роботи

Отже, теплота процесу

Зміна ентропії в процесі

Адіабатний процес
Адіабатним називається процес, який відбувається без теплообміну з навколишнім середовищем ( q=0, δq=0 ).
Рівняння адіабатного процесу можна отримати, використавши перший закон термодинаміки

Для адіабатного процесу δq=0, тому перший закон термодинаміки можна записати

Розділивши почленно ці рівняння, отримаємо

Останнє рівняння після поділення на pv набуває вигляду:

Після інтегрування отримаємо вираз

У p-v діаграмі адіабат зображується нерівнобічною гіперболою, яка має крутіший хід, ніж ізотерма.



а б в
Рисунок 1.4 – Графічне зображення адіабатного процесу
Зв’язок між параметрами pі v

Зв’язок між температурою і об’ємом



З цього рівняння випливає, що при адіабатному процесі розширення температури зменшується.
Зв’язок між тиском і температурою при адіабатному процесі

Робота при адіабатному процесі може бути визначена за формулою

Зміна ентропії в оборотному адіабатному процесі дорівнює нулю.
Політропний процес
Цей процес характеризується тим, що він проходить в ідеальному газі при постійному значенні теплоємності, що може мати будь-яке числове значення від - ∞ до + ∞. Для політропного процесу частка кількості теплоти, що витрачається на зміну внутрішньої енергії, залишається незмінною.

Виведемо рівняння політропи, використавши перший закон термодинаміки

Для політропного процесу

Підставивши замість δq, du, dh їх значення в систему рівнянь після елементарних перетворень отримаємо

Поділивши почленно друге рівняння на перше, отримаємо

Введемо
позначення

Після
інтегрування одержимо
 n
– показник
політропи і знаходиться в межах - ∞ ≤
n
≤ + ∞.
n
– показник
політропи і знаходиться в межах - ∞ ≤
n
≤ + ∞.
За аналогією з відповідних виразів для адіабатного процесу і для політропного процесу справедливий такий зв’язок між параметрами стану:

Роботу політропного процесу можна визначити за формулою

Теплоємність у політропному процесі можна визначити з рівняння

