- •1 Основні поняття та цілі теорії металургійних процесів
- •2 Теоретичні основи утворення і дисоціації складних хімічних сполук
- •2.1 Термодинаміка утворення і дисоціації карбонатів
- •2.2 Термодинаміка реакцій утворення і дисоціації оксидів металів
- •2.3 Термодинаміка реакцій утворення і дисоціації оксидів заліза
- •2.4 Механізм процесів дисоціації і утворення складних хімічних з’єднань
- •2.5 Процеси окислення твердих металів
- •2.6 Будова структури окалини
- •3 Основи теорії горіння
- •3.1 Термодинаміка гомогенного горіння
- •3.2 Механізми горіння гомогенних реакцій
- •3.3 Термодинаміка реакцій горіння твердого вуглецю
- •3.4 Механізми горіння гетерогенних реакцій
- •3.5 Кінетичні закономірності горіння твердого вуглецю
- •4.1 Відновлення оксидів газами
- •4.2 Термодинаміка відновлення оксидів твердим вуглецем
- •4.3 Відновлення з участю розчинів
- •4.4 Відновлення оксидів заліза
- •4.5 Механізм відновлення оксидів металів газами
- •4.6 Механізм відновлення оксидів твердим вуглецем
- •5.Основыокислительных процессов
- •5.1. Состав, свойства и роль шлака в процессе производства стали
- •5.2.Металлический расплав
- •5.3. Важнейшие реакции сталеплавильных процессов
- •5.3.1 Окисление углерода
- •5.3.2 Окисление кремния
- •5.3.3 Поведение марганца
- •5.3.4 Поведение фосфора
- •5.3.5 Поведение серы
- •5.3.6 Газы в стали
- •5.4 Раскисление стали
- •5.4.1 Способы раскисления
- •5.4.2 Продукты раскисления и их удаление
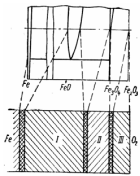
2.6 Будова структури окалини
Окалина складається з трьох основних шарів. Як показав В. І. Архаров, їх склад і порядок розташування такі ж, як у гомогенних областей на діаграмі стану системи Fe-О (рис. 2.11).
|
|
|
Рис. 2.11 –Схема будови окалини |
Якщо окислювачами є тільки СО2або Н2О і газова фаза не містить кисню, то Fe2O3не утворюється, і випадає шар III. При >570С в окалині є два шари, вюститний та магнетитовий, а при t < 570– тільки один магнетитовий.
3 Основи теорії горіння
Газова фаза металургійних агрегатів може бути нейтральною, відновною або окислювальною, залежно від вимог конкретного процесу. В доменному процесі відбувається відновлення залізняку з отриманням передільного чавуну, тому газова фаза доменної печі відновна по відношенню до оксидів заліза. Газова фаза печей для термообробки сплавів є відновною або нейтральною для запобігання окисленню оброблюваного матеріалу. У багатьох процесах газова фаза є реакційною, тобто містить компоненти, що взаємодіють з металургійними фазами - шлаком і металом. Склад газової фази включає три групи складових: продукти повної взаємодії з киснем – СО2, Н2О(пара); продукти неповної взаємодії з киснем, термічної дисоціації, зневуглецювання і дегазації металу – СО, Н2, СН4, О2, N2; інертні складові – Ar, He, Kr, Хе.
Основні компоненти газової фази утворюються за реакціями:
- система С-О
1. Реакція повного горіння вуглецю С +О2 = СО2 + Q
2. Реакція неповного горіння вуглецю С +1/2О2 = СО + Q
3. Реакція догорання СО до СО2 СО +1/2О2 = СО2 + Q
4. Реакція газифікації С газом СО2 С +СО2 = 2СО – Q
- система Н-О
5. реакція повного горіння водню Н2 +1/2О2 = Н2Ог + Q
- система С-Н-О
6. Реакція газифікації С газом Н2О до СО С + Н2О = Н2 + СО – Q
7. Реакція газифікації С газом Н2О до СО2 С + 2Н2О = 2Н2 + СО2 – Q
8. Реакція водяного газу Н2Ог + СО = СО2 + Н2 + Q
3.1 Термодинаміка гомогенного горіння
Горіння водню (реакція 5)
Реакція горіння Н2 описується рівнянням
2Н2 + O2 = 2Н2Oг + Q; ΔG0 = - 492230 + 108,24·Т;
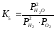 або,
якщо виразити концентрації в газовій
фазі в об'ємних %,
або,
якщо виразити концентрації в газовій
фазі в об'ємних %,
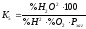 .
.
Число ступенів свободи реакції (5) за правилом фаз Гіббса С = К – Ф + 2, С = 2 – 1 + 2= 3. Рівноважний стан системи визначається трьома незалежними змінними: температурою, тиском і концентрацією в газовій фазі.
Залежність
константи рівноваги реакції (5) від
температури визначається
рівнянням
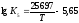 .
.
При підвищенні загального тиску газів і пониження температури в системі рівновага в системі зміщується у бік утворення водяної пари.
Горіння оксиду вуглецю (II) СО (реакція 3)
Реакція горіння СО описується рівнянням:
2СО + О2 = 2СО2 + Q; ΔG0 = - 565390 + 175,17·Т.
Реакція
екзотермічна. Константа рівноваги
реакції (3) рівна
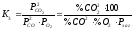 .
По правилу фаз Гіббса число ступенів
свободи для цієї системи складає: С = 2
– 1 + 2 = 3.
.
По правилу фаз Гіббса число ступенів
свободи для цієї системи складає: С = 2
– 1 + 2 = 3.
Залежність
константи рівноваги від температури
визначається рівнянням
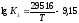 .
.
З підвищенням температури рівновага реакції (3) зміщується в праву сторону.
|
|
|
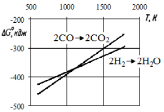
Рис. 3.1 - Залежність G0 від температури реакцій горіння Н2 (5) і СО (3) |
 і
і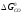 залежно від температури. Можна наголосити
на двох областях: а) до точки перетину
прямих, тобто до 1083
К (810
°С)
залежно від температури. Можна наголосити
на двох областях: а) до точки перетину
прямих, тобто до 1083
К (810
°С)
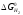 >
>
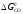 (спорідненість СО до кисню вище, ніж у
Н2, а
значить, і відновна здатність вища); б)
при Т > 1083
К
(спорідненість СО до кисню вище, ніж у
Н2, а
значить, і відновна здатність вища); б)
при Т > 1083
К
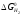 <
<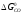 (спорідненість до
кисню і відновні здібності вищі у водню).
При Т
= 1083 К
Н2
і СО мають рівну відновну
здібність і спорідненість
до кисню.
(спорідненість до
кисню і відновні здібності вищі у водню).
При Т
= 1083 К
Н2
і СО мають рівну відновну
здібність і спорідненість
до кисню.Взаємодія водяної пари з монооксидом вуглецю. Реакція водяного газу (реакція 8)
Реакцією водяного газу називається реакція взаємодії
H2O + СО = Н2 + СO2; ΔG0 = - 36580 + 33,46·Т.
Реакція
слабкоекзотермічна. Константа рівноваги
даної реакції рівна
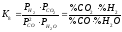 .
.
За правилом фаз Гіббса число ступенів свободи визначається з рівняння: С = 3 – 1 + 2 = 4, тобто рівноважний стан характеризується 4-мя незалежними змінними: температурою і концентраціями трьох компонентів (Н2O – вважаємо газом).
За законом Гесса термодинамічні функції реакції (8) можуть бути одержані підсумовуванням реакцій (5) і (3)
(3) СО + 1/2О2 = СО2
-
 (5)
Н2
+ 1/2О2
= Н2О
(5)
Н2
+ 1/2О2
= Н2О
(8) Н2О + СО = СО2 + Н2
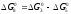 ;
K8
= K3/K5
;
K8
= K3/K5
Залежність
константи рівноваги від температури
визначається рівнянням:
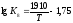 .
При 1083 К
величина К5
=
К3,
отже,
К8
= 1, а
.
При 1083 К
величина К5
=
К3,
отже,
К8
= 1, а
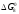 =0.
Реакція водяного газу обратима. При Т
>
1083 К водень володіє
великою спорідненістю до кисню,
ніж СО, рівновага реакції повинна
зміщуватися вліво; при Т
<
1083 К
рівновага зміщується вправо, оскільки
СО володіє великою спорідненістю
до кисню, а СО2
міцніший, ніж Н2О.
=0.
Реакція водяного газу обратима. При Т
>
1083 К водень володіє
великою спорідненістю до кисню,
ніж СО, рівновага реакції повинна
зміщуватися вліво; при Т
<
1083 К
рівновага зміщується вправо, оскільки
СО володіє великою спорідненістю
до кисню, а СО2
міцніший, ніж Н2О.
Кисневий потенціал
Газові суміші СО-СО2, Н2-Н2О залежно від їх складу можуть бути як відновними, так і окислювальними по відношенню до конкретних оксидів
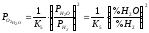 ;
;
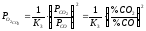 .
.
Рівноважний
парціальний тиск кисню в газових сумішах
(СО-СО2
і Н2-Н2О)
є функцією температури (константи
рівноваги залежать від температури) і
відношення
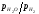 або
або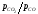 .
Чим вище відношення
.
Чим вище відношення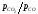 або
або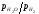 ,
тим вищий парціальний тиск кисню в
газовій суміші.
В цьому ж напрямі впливає і підвищення
температури. Термодинамічно
охарактеризувати
окислювальні властивості атмосфери
можна за допомогою кисневого потенціалу
,
тим вищий парціальний тиск кисню в
газовій суміші.
В цьому ж напрямі впливає і підвищення
температури. Термодинамічно
охарактеризувати
окислювальні властивості атмосфери
можна за допомогою кисневого потенціалу
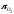 ,
який рівний
,
який рівний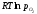 або
або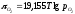 ,
Дж/(мольК).
Чим вище кисневий потенціал газової
суміші, тим вище її окислювальна
здатність. Таким чином, кисневий потенціал
газових сумішей СО-СО2
і Н2-Н2О
залежить від температури і складу
суміші. Порівняння парціального тиску
кисню в газовій суміші (СО-СО2
і Н2-Н2О)
з пружністю дисоціації
оксиду металу дозволяє укласти, чи є
дана суміш по відношенню до металу
окислювальною або до його оксиду –
відновною. При
,
Дж/(мольК).
Чим вище кисневий потенціал газової
суміші, тим вище її окислювальна
здатність. Таким чином, кисневий потенціал
газових сумішей СО-СО2
і Н2-Н2О
залежить від температури і складу
суміші. Порівняння парціального тиску
кисню в газовій суміші (СО-СО2
і Н2-Н2О)
з пружністю дисоціації
оксиду металу дозволяє укласти, чи є
дана суміш по відношенню до металу
окислювальною або до його оксиду –
відновною. При
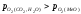 відбуватиметься окислення металу, при
відбуватиметься окислення металу, при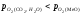 оксид відновлюється.
оксид відновлюється.