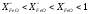- •1 Основні поняття та цілі теорії металургійних процесів
- •2 Теоретичні основи утворення і дисоціації складних хімічних сполук
- •2.1 Термодинаміка утворення і дисоціації карбонатів
- •2.2 Термодинаміка реакцій утворення і дисоціації оксидів металів
- •2.3 Термодинаміка реакцій утворення і дисоціації оксидів заліза
- •2.4 Механізм процесів дисоціації і утворення складних хімічних з’єднань
- •2.5 Процеси окислення твердих металів
- •2.6 Будова структури окалини
- •3 Основи теорії горіння
- •3.1 Термодинаміка гомогенного горіння
- •3.2 Механізми горіння гомогенних реакцій
- •3.3 Термодинаміка реакцій горіння твердого вуглецю
- •3.4 Механізми горіння гетерогенних реакцій
- •3.5 Кінетичні закономірності горіння твердого вуглецю
- •4.1 Відновлення оксидів газами
- •4.2 Термодинаміка відновлення оксидів твердим вуглецем
- •4.3 Відновлення з участю розчинів
- •4.4 Відновлення оксидів заліза
- •4.5 Механізм відновлення оксидів металів газами
- •4.6 Механізм відновлення оксидів твердим вуглецем
- •5.Основыокислительных процессов
- •5.1. Состав, свойства и роль шлака в процессе производства стали
- •5.2.Металлический расплав
- •5.3. Важнейшие реакции сталеплавильных процессов
- •5.3.1 Окисление углерода
- •5.3.2 Окисление кремния
- •5.3.3 Поведение марганца
- •5.3.4 Поведение фосфора
- •5.3.5 Поведение серы
- •5.3.6 Газы в стали
- •5.4 Раскисление стали
- •5.4.1 Способы раскисления
- •5.4.2 Продукты раскисления и их удаление
4.3 Відновлення з участю розчинів
Окислювально-відновні реакції в реальних процесах протікають, як правило, з участю компонентів, що знаходяться в твердих і рідких розчинах.
Відновлення з розчину (FeO) + CO = Feк+ СО2.
Вираз
константи рівноваги має вигляд
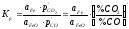 ,
звідки
,
звідки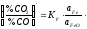 .
Прийнявши, що активність розчинникааFe
1 і враховуючи,
що
.
Прийнявши, що активність розчинникааFe
1 і враховуючи,
що
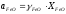 ;Кр
=
;Кр
=
 (для чистих компонентів), де
(для чистих компонентів), де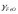 і
і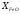 – коефіцієнт активності і концентрація
(молярна частка)FeO
в розчині, одержимо
– коефіцієнт активності і концентрація
(молярна частка)FeO
в розчині, одержимо
 .
Звідки витікає, що в ненасичених розчинах
(коли
.
Звідки витікає, що в ненасичених розчинах
(коли
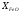 < 1)
< 1) ,
тобто рівноважний газ бідніший СО2
і
багатше СО, ніж у разі реакції
з
чистими фазами. Із зменшенням концентрації
FeO зменшується
,
тобто рівноважний газ бідніший СО2
і
багатше СО, ніж у разі реакції
з
чистими фазами. Із зменшенням концентрації
FeO зменшується
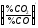 ,
тобто %СО2
прагне до нуля, % СО – 100%. Таким чином,
чим нижчий
вміст
оксиду в розчині, тим його важче
відновлювати і тим
багатше
відновником повинна бути газова суміш.
,
тобто %СО2
прагне до нуля, % СО – 100%. Таким чином,
чим нижчий
вміст
оксиду в розчині, тим його важче
відновлювати і тим
багатше
відновником повинна бути газова суміш.
При прямому відновленні процес складається з наступних реакцій
(FeO) + CO = Feк + СО2
+

 СО2
+ Ст
= 2СО
СО2
+ Ст
= 2СО
(FeO) + Ст = Feк + СО
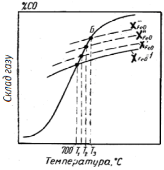
З рис. 4.5 видно, що кожному вмісту FeO в розчині відповідає своя точка перетину з рівноважної кривої реакції взаємодії СО2 з вуглецем (крива б), або своя температура початку реакції прямого відновлення Тр, і чим нижче XFeO, тим вище Тр.
У міру зменшення концентрації оксиду його стає все важче відновлювати твердим вуглецем, що виявляється в підвищенні температури початку реакції.
Перехід продукту
відновлення в розчин MnOк
+ СОг
= [Mn] + CO2;
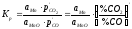 .
.
Для
MnO, як
чистої фази
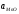 = 1;
= 1;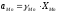 ,
отже,
,
отже,
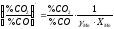 .
У присутності розчинника, коли
.
У присутності розчинника, коли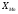 < 1,
рівноважний склад газу бідніший СО, ніж
при отриманні чистого металу. Інакше,
під час переходу продукту
реакції в розчин умови
відновлення оксиду полегшується. На
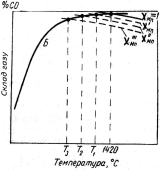
рис. 4.6 кожному вмісту
марганцю в залізі відповідає своя
рівноважна крива складу
газової фази реакції
непрямого відновлення: чим менше
< 1,
рівноважний склад газу бідніший СО, ніж
при отриманні чистого металу. Інакше,
під час переходу продукту
реакції в розчин умови
відновлення оксиду полегшується. На
рис. 4.6 кожному вмісту
марганцю в залізі відповідає своя
рівноважна крива складу
газової фази реакції
непрямого відновлення: чим менше
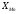 ,
тим нижче розташовується крива. При
прямому відновленні полегшення умов
для протікання реакції
MnOк
+ Ст
= [Mn]Fe
+ CO виявляється
в зниженні температури, вище за яку стає
можливою взаємодія: Т3
< Т2
< Т1
< 1420С.
,
тим нижче розташовується крива. При
прямому відновленні полегшення умов
для протікання реакції
MnOк
+ Ст
= [Mn]Fe
+ CO виявляється
в зниженні температури, вище за яку стає
можливою взаємодія: Т3
< Т2
< Т1
< 1420С.
|
|
|
|
Рис.
4.5 - Рівноважний
склад газу і температури початку
відновлення в реакціях непрямого і
прямого відновлення FeO
|
Рис.
4.6 - Рівноважний
склад газу і температури рівноваги в
реакціях непрямого і прямого відновлення
оксиду марганцю
|
4.4 Відновлення оксидів заліза
Вище 570С
3Fe2O3 + H2 = 2Fe3O4 + H2O + Q
Fe3O4 + H2 = 3FeO + H2O - Q
FeO + H2 = FeO + H2O - Q
Нижче 570 0С
3Fe2O3 + H2 = 2Fe3O4 + H2O + Q
1/4Fe3O4 + H2 = 3/4Fe + H2O - Q
Константа рівноваги цих реакцій, у разі коли тверді або рідкі фази не утворюють між собою розчинів і не розчинені в інших речовинах, записується в наступним вигляді
Kp
=
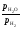 =
=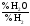 ;
%H2O
+ %H2
= 100; %H2O
=
;
%H2O
+ %H2
= 100; %H2O
=
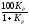 .
.
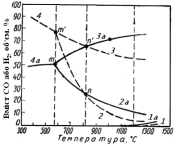
Зміна рівноважного складу газу з температурою для даних реакцій представлена на рис. 4.7.
При 570С оксиди FeO і Fe3O4 рівноміцні, тому рівноважні газові суміші в реакціях (2), (3) і (4) мають однаковий склад і відповідні криві перетинаються при 570С (точка m). В області нижчих температур закисна фаза нестійка і реакції (2) і (3) втрачають значення. При температурі вище 570С відпадає перетворення (4). По графіку можна встановити області існування різних фаз в системі Fe – О. Так, поле між кривими 2 і 3 належить газовим сумішам з недоліком Н2 по відношенню до рівноважного змісту для реакції (3) і з лишком – для реакції (2). Отже, дані суміші окислювальні для заліза і відновні для Fe3O4. Вони обумовлюють переходи Fe FeO і Fe3О4 FeO і забезпечують стабільність закисної фази. Так само можна встановити, що в областях вище за криві 3 і 4 стійке залізо, а нижче за лінії 4 і 2 – Fe3О4. Поле стабільності Fe2О3 вельми обмежено і розташовується під кривою 1.
Відновлення оксидів заліза газом СО
Вище 570С
1а. 3Fe2O3 + CO = 2Fe3O4 + CO2 + Q
2а. Fe3O4 + CO = 3FeO + CO2 - Q
3а. FeO + CO = Fe + CO2 - Q
Нижче 570С
1а. 3Fe2O3 + CO = 2Fe3O4 + CO2 + Q
4а. 1/4Fe3O4 + CO = 3/4Fe + CO2 - Q
У
складі газової фази два гази CO і CO2,
тоді можна записати %CO
+ %CO2
= 100; а склад газової фази визначиться
з виразу %CO2
=
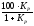 .
.
Всі
реакції, за винятком реакції (1a),
ендотермічні, їх константа
рівноваги Kp
=
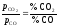 зростає з температурою, а відповідні
рівноважні криві 2а,
3а
і 4а
виходять низхідними
(див. рис. 4.7)
і перетинаються при
тій же температурі 570С
(точка m),
як і при відновленні оксидів заліза
воднем.
зростає з температурою, а відповідні
рівноважні криві 2а,
3а
і 4а
виходять низхідними
(див. рис. 4.7)
і перетинаються при
тій же температурі 570С
(точка m),
як і при відновленні оксидів заліза
воднем.
|
|
|
Рис. 4.7 - Залежність рівноважного складу газу від температури в реакціях відновлення оксидів заліза СО (суцільні лінії) та Н2 (пунктиром) |
Відновлення оксидів заліза твердим вуглецем
Сумарний процес прямого відновлення складається з реакцій непрямого відновлення оксидів заліза і взаємодії СО2 з твердим вуглецем.
|
|
|
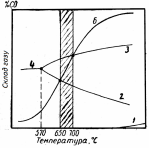
Рис. 4.8 - Температури рівноваги реакцій прямого відновлення оксидів заліза |
1. Fе3О4 + С = 3FeO + CO- Q
2. FeO + С = Fe + СО-Q
За наявності чистих фаз і постійному тиску температури рівноваги цих реакцій можна знайти з графіка (рис. 4.8). З графіка видно, що рівновага реакції (1) при Р = 1 ат досягається при 650С, а реакції (2) – при 700С. В області температур нижче 650С перетворення (1) повинне протікати необоротно вліво, у бік окислення FeO до Fе3О4, а при >650 – у протилежному напрямі, Fе3О4 FеО. Реакції (2) відповідають перетворення: при <700С Fe FeO, а при >700С FеО Fе. Таким чином, при рівновазі в системі Fe–С–О встановлюються наступні температурні межі стійкості фаз: при t > 700С – металеве залізо (вірніше, розчини кисню в ньому); в інтервалі 650–700С – закисна фаза; при t < 650С – магнетит.