
- •Фізична хімія
- •Розчини електролітів. Електрохімія
- •Основні поняття, рівняння і символи
- •Приклади розв’язку типових задач
- •Завдання для самостійної роботи Задача 1.1
- •Варіанти завдань до задачі 1.1
- •Приклад розв’язку задачі 1.1
- •А) Розв’язок задачі для слабкого електроліту.
- •Значення питомої і молярної електропровідності
- •Б) Приклад розв’язку задачі для сильного електроліту
- •Контрольні задачі
- •Хімічна кінетика
- •Основні рівняння і символи
- •Приклади розв’язку типових задач
- •0.25 Моль/л
- •Задачі для самостійної роботи Задача 2.1
- •Варіанти завдань до задачі 2.1
- •Задача 2.2
- •Варіанти завдань до задачі 2.2
- •Задача 2.3
- •Варіанти завдань до задачі 2.3
- •Задача 2.4
- •Варіанти завдань до задачі 2.4
- •Вихідні дані до задачі 2.4
- •Приклад розв’язку задачі 2.1
- •Експериментальні значення кінетичних досліджень
- •Результати розрахунку констант швидкості
- •Дані для побудови графіків
- •Приклад розв’язку задачі 2.2
- •Приклад розв’язку задачі 2.3
- •Константи швидкості та термодинамічні параметри реакції
- •Приклад розв’язку задачі 2.4
- •Вихідні дані до задачі 2.4
- •Результати розрахунку квантового виходу реакції
- •Контрольні задачі
- •Список літератури
- •Фізична хімія
0.25 Моль/л
Приклад 8. Для реакції піролізу метану був запропонований наступний механізм:
СН4
 k1
k1
 +
+

СН4
+
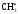
 k2
С2Н6
+
k2
С2Н6
+


СН4
+
 k3
k3
 +H2
+H2
 +
+
 +M
k4
СН4
+ M
+M
k4
СН4
+ M
М
– частинка, що відводить енергію
рекомбінації
 і
і .
Вивести рівняння для швидкості утворення
етану, приймаючи концентрації
.
Вивести рівняння для швидкості утворення
етану, приймаючи концентрації і
і дуже малими і стаціонарними.
дуже малими і стаціонарними.
Розв’язок. Етилен утворюється на другий стадії і швидкість його утворення за законом дії мас дорівнює:
 k2
[СН4][
k2
[СН4][ ];
(a)
];
(a)
В
одержаному рівнянні присутня активна
частинка
 ,
концентрацію якої необхідно виразити
через концентрації стабільних частинок.
Для цього записуємо швидкість утворення
,
концентрацію якої необхідно виразити
через концентрації стабільних частинок.
Для цього записуємо швидкість утворення в ході даної реакції і прирівнюємо її
до нуля:
в ході даної реакції і прирівнюємо її
до нуля:
 k1[СН4]–k2[СН4][
k1[СН4]–k2[СН4][ ]+k3[
]+k3[ ][
][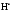 ]-k4[
]-k4[ ][
][ ][M]=0
(b)
][M]=0
(b)
В
одержаному рівнянні необхідно виразити
концентрацію активної частинки
 через концентрації стабільних реагентів.
Аналогічно попередньому запишемо
швидкість її утворення і прирівняємо
до нуля:
через концентрації стабільних реагентів.
Аналогічно попередньому запишемо
швидкість її утворення і прирівняємо
до нуля:
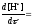 k1[СН4]
+ k2[СН4][
k1[СН4]
+ k2[СН4][
 ]
–k3[СН4][
]
–k3[СН4][ ]
–k4[С
]
–k4[С ][
][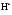 ][M]=0
(с)
][M]=0
(с)
Додамо рівняння " b " до рівняння "с" і одержимо:
k1[СН4]
– k4[С ][
][ ][M]=
0
][M]=
0
[С ][
][ ]=
]= (d)
(d)
Віднімемо від рівняння " b " рівняння "с":
-k2[СН4][
 ]
+k3[СН4][
]
+k3[СН4][ ]
=0
]
=0
звідки
[ ]
= [
]
= [ ]
] (е)
(е)
Підставимо
значення [ ]
з рівняння (е)
в рівняння (d):
]
з рівняння (е)
в рівняння (d):
[ ]2
=
]2
=
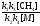 чи [
чи [ ]
=
]
= (f)
(f)
Після
підстановки значення [ ]
з рівняння (f)
в рівняння (a)
одержуємо вираз для швидкості утворення
етану:
]
з рівняння (f)
в рівняння (a)
одержуємо вираз для швидкості утворення
етану:
 k2
[СН4]
k2
[СН4]
 =
=
Приклад 9. Реакція розкладу трихлороцтової кислоти є реакцією першого порядку. За температури 250С константа швидкості реакції дорівнює k1 = 1.7·10-7 с-1, а за температури 450С k2 = 1.33·10-5 с-1. Розрахуйте енергію активації, температурний коефіцієнт Вант-Гоффа реакції і передекспонентний множник константи швидкості в рівнянні Арреніуса.
Розв’язок. Для розв'язку задачі скористуємось рівнянням Арреніуса:

Розділімо змінні і проінтегруємо визначеним інтегралом (E= const):


звідки:
 = 171740 Дж/моль.
= 171740 Дж/моль.
Визначення температурного коефіцієнту реакції проводимо за рівнянням:
 =
=
 = 2.18
= 2.18
Для розрахунку передекспонентний множника скористаємось інтегральною формою рівняння Арреніуса:
 ,
звідки
,
звідки

 =
2.16·1023
с-1
=
2.16·1023
с-1
 =
2.16·1023
с-1
=
2.16·1023
с-1
Середнє значення передекспонентний множника:
k0 = 2.16·1023 с-1
Приклад 10. Бімолекулярна реакція 2НІ = Н2 + І2 має енергію активації Е=185000 Дж/моль. Реакція відбувається за температури Т = 570 К. Діаметр молекули НІ становить σ1,2 = 3.5·10-8 см. Концентрація НІ дорівнює 1 моль/л. Розрахуйте константу швидкості реакції за температури 570 К, якщо стеричний фактор дорівнює р=1.
Розв’язок. Для визначення константи швидкості скористаємось рівнянням теорії активних зіткнень для розрахунку константи швидкості реакції, в якій відбуваються зіткнення між однаковими частинками:
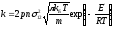
Число частинок в 1 м3 становить: n = 1(моль/л)·NA·1000 = 6.023·1026.
Середній ефективний діаметр зіткнення молекул НІ дорівнює:
σ12 = 3.5·10-8 см =3.5·10-10 м
Масу одної молекули НІ в кг визначаємо за формулою:

Істинна енергія активації (Е') відрізняється від ефективної енергії активації (Е) на величину середньої енергії теплового руху молекул:
Е' = Е - 0.5RT= 185000 - 0.5·8.314·570 =182630 Дж/моль
Після підстановки розрахованих величин, констант і температури в рівняння константи швидкості, одержимо:

Приклад
11.
Для реакції Н·(г)
+ Н2(г)↔
(Н−Н−Н)→ Н2(г)
+ Н·(г)
за температури 298К
енергія активації дорівнює Е=23000 Дж/моль,
передекспонентний множник в рівнянні
Арреніуса k0=1.5·1010
л/(моль·с). Розрахуйте зміну ентальпії
( )
і ентропії (
)
і ентропії ( )
при утворенні активного комплексу
(Н−Н−Н). Трансмісійний множник дорівнюєχ
= 1.
)
при утворенні активного комплексу
(Н−Н−Н). Трансмісійний множник дорівнюєχ
= 1.
Розв’язок. Величину зміни ентальпії за температури Т при утворенні активного комплексу можна визначити за відомим значенням енергії активації (Е) (х – число молекул у вихідному стані):
 =
Е
– хRT
= 23000 – 2·8.314·298
=
18045 Дж/моль.
=
Е
– хRT
= 23000 – 2·8.314·298
=
18045 Дж/моль.
Для визначення зміни ентропії утворення активного комплексу скористаємось рівнянням:
 ,
,
звідки:
 =R
=R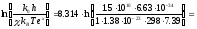 -66.7
Дж/(моль·К)
-66.7
Дж/(моль·К)
Приклад 12. Визначено, що для розпізнання об'єкта, в людське око повинно попасти мінімальна кількість світлової енергії, рівна 1·10 -17 Дж. Яка кількість фотонів світла жовтого кольору (λ = 590 nm) необхідна для перенесення такої кількості енергії?
Розв’язок. Енергія одного фотону з такою довжиною хвилі дорівнює:
 3.37·10-19
Дж
3.37·10-19
Дж
Звідки число необхідних фотонів дорівнює:
 фотонів.
фотонів.
Приклад 13. Чому дорівнює довжина хвилі світла, що поглинається зв'язком С=О в молекулі ацетону, якщо енергія зв’язку дорівнює 728 кДж/моль? Чи можливо розірвати цей зв'язок енергією світла ртутної лампи, якщо довжина світла, що випромінюється лампою дорівнює 254 nm?
Розв’язок. Згідно закону Ейнштейна-Штарка на кожну активовану молекулу (зв'язок) припадає один квант радіації. Енергія, що необхідна для розриву 6.023·1023 (1 моль) зв'язків, дорівнює:
 ,
звідки:
,
звідки:

Розрахунок показує, що довжина світла не є ефективною для розриву цього зв’язку.
