
- •Фізична хімія
- •Розчини електролітів. Електрохімія
- •Основні поняття, рівняння і символи
- •Приклади розв’язку типових задач
- •Завдання для самостійної роботи Задача 1.1
- •Варіанти завдань до задачі 1.1
- •Приклад розв’язку задачі 1.1
- •А) Розв’язок задачі для слабкого електроліту.
- •Значення питомої і молярної електропровідності
- •Б) Приклад розв’язку задачі для сильного електроліту
- •Контрольні задачі
- •Хімічна кінетика
- •Основні рівняння і символи
- •Приклади розв’язку типових задач
- •0.25 Моль/л
- •Задачі для самостійної роботи Задача 2.1
- •Варіанти завдань до задачі 2.1
- •Задача 2.2
- •Варіанти завдань до задачі 2.2
- •Задача 2.3
- •Варіанти завдань до задачі 2.3
- •Задача 2.4
- •Варіанти завдань до задачі 2.4
- •Вихідні дані до задачі 2.4
- •Приклад розв’язку задачі 2.1
- •Експериментальні значення кінетичних досліджень
- •Результати розрахунку констант швидкості
- •Дані для побудови графіків
- •Приклад розв’язку задачі 2.2
- •Приклад розв’язку задачі 2.3
- •Константи швидкості та термодинамічні параметри реакції
- •Приклад розв’язку задачі 2.4
- •Вихідні дані до задачі 2.4
- •Результати розрахунку квантового виходу реакції
- •Контрольні задачі
- •Список літератури
- •Фізична хімія
Контрольні задачі
1. Розрахуйте іонну силу і середні іонні коефіцієнти активності для розчинів суміші електролітів за 298 К, якщо моляльність електролітів в розчинах становлять: a) Na2SO4 – 0.005, MgSO4 – 0.003; b) MgSO4 – 0.005, LaCl3 – 0.006.
2. Розрахуйте моляльність розчину Al(NO3)3 іонна сила якого дорівнює 0.3 моль/кг.
3. Іонна сила розчину NaNO3 становить 0.30 моль/кг. Чому дорівнює моляльність розчину Al2(SO4)3 з такою самою іонною силою.
4. Обчисліть іонну силу і середні коефіцієнти активності солей в розчинах 1 і 2. Моляльні концентрації солей вказані в таблиці.
|
№ розчину |
Na2SO4 |
CeCl3 |
ZnSO4 |
|
1 |
0,015 |
0,05 |
0,025 |
|
2 |
0.001 |
0.003 |
0.006 |
5. Розрахуйте іонну силу розчину, що містить 0.1 моль/кг КСІ і 0.20 моль/кг ZnSO4.
6. Чому дорівнює моляльність розчину К3РО4, що має таку ж іонну силу, що і 0.38 моль/кг розчин КСІ?
7. Константа дисоціації NH4OH дорівнює 1.79∙10-5. Визначити концентрацію NH4OH, за якої ступінь дисоціації дорівнює 0.01 і еквівалентну електропровідність розчину, якщо рухливості іонів NH+ OHвідповідно дорівнюють 73.5 і 198.3 Ом-1см2моль-1.
8. Розчин слабкої кислоти Н2А за температури 298К і розбавленні 63 л/г-екв має еквівалентну електропровідність 7.9 Ом-1см2г-екв-1, а за нескінченного розбавлення вона дорівнює 399.8 Ом-1см2г-екв-1. Розрахуйте константу дисоціації і рН кислоти.
9. Питома електропровідність нескінченно розбавлених розчинів KCl, KNO3 і AgNO3 за температури 25 oC дорівнює відповідно 149.9, 145.0 і 133.4 Ом-1·м-1. Чому дорівнює питома електропровідність нескінченно розбавленого розчину AgCl за 25ОC?
10. Еквівалентні електропровідності нескінченно розбавлених розчинів НСІ, NaCl і CH3COONa за температури 25 0С дорівнюють 425.0 128.1 і 91.0 Ом-1.см2.моль-1 відповідно. Чому дорівнює еквівалентна електропровідність оцтової кислоти (CH3COOН) за нескінченного розбавлення і температури 250С?
11.Еквівалентні електропровідності нескінченно розбавлених розчинів КСІ, KNO3 i AgNO3 за температури 250С дорівнюють, відповідно, 149.9, 145.0 і 133.4 Ом-1.см2.моль-1.Чому дорівнює еквівалентна електропровідність нескінченно розбавленого розчину AgСІ за температури 250С ?
12. Яку частку загальної кількості зарядів переносить іон Li+ у водному розчині LiBr за температури 250С, якщо рухливості Li+ і Br¯ дорівнюють відповідно 6.87 і 7.81 Ом-1.см2.моль-1?
13. Розрахуйте питому і еквівалентну електропровідності 0.01н розчину КСІ, якщо питомий опір розчину становить ρ = 709.22 Ом·см.
14. Еквівалентна електропровідність розчину електроліту за 298К дорівнює:
|
С·103, моль/л |
0.1 |
0.05 |
0.03 |
0.01 |
∞ |
|
, Ом-1см2г-екв-1 |
193.9 |
282.6 |
347.0 |
386.1 |
399.8 |
Розрахуйте середнє значення константи дисоціації для електролітів: а) НА; б) Н2А; в) Н3А; г) Н2А3..
15. Еквівалентна електропровідність 1.59.10-4 моль/л розчину оцтової кислоти за температури 250С дорівнює 12.77 Ом-1.см2 .моль-1. Розрахуйте константу дисоціації кислоти і рН розчину.
16. Еквівалентна електропровідність розчину гідроксиду етиламонію C2H5NH3OH за нескінченного розбавлення становить 232.6 Ом-1.см2 . моль-1. Розрахуйте константу дисоціації гідроксиду етиламонію, еквівалентну електропровідність розчину, ступінь дисоціації і концентрацію іонів гідроксилу в розчині за розбавлення V=16 л·моль-1, якщо питома електропровідність за даного розбавлення дорівнює 1.312.10-3 Ом-1 .см-1.
17. Еквівалентна електропровідність AgNO3 за температури 298К і нескінченному розбавленні становить 133.36 Ом-1·см2· моль-1. Число перенесення Ag+ дорівнює 0.464. Розрахуйте рухливості іонів Ag+ і NO3-.
18. Розрахуйте еквівалентну електропровідність за температури 298К і за нескінченного розбавлення для дихлороцтової кислоти (СНСІ2СООН), якщо константа дисоціації дорівнює К=3.32·10-2 моль/м3, а еквівалентна електропровідність за розбавлення V = 32 л/моль становить 69.8 Ом-1см2моль-1.
19. Розрахуйте ступінь дисоціації і рН 1.5·10-4 М розчину СНСІ2СООН, якщо константа дисоціації кислоти дорівнює К = 3.32·10-2.
20.
Розрахуйте ступінь дисоціації води за
температури 298К
якщо питома електропровідність води
становить χ
= 6.33·10-8
Ом-1·см-1.
Рухливості катіону водню і аніону
гідроксилу за нескінченного розбавлення
дорівнюють:
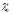 =349.8
Ом-1·см2·моль-1,
=349.8
Ом-1·см2·моль-1,
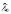 =
198.3 Ом-1·см2·моль-1.
Густина води дорівнює ρ=0.997
г/см3.
=
198.3 Ом-1·см2·моль-1.
Густина води дорівнює ρ=0.997
г/см3.
21.
За температури 298К
питома
електропровідність масляної кислоти
С3Н7СООН
з концентрацією 0.016 моль/м3
становить χ
= 1.81·10-2
Ом-1·м-1.
Еквівалентна електропровідність розчину
кислоти за нескінченного розбавлення
дорівнює
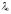 =380·10-4
Ом-1·м2·кмоль-1.
Розрахуйте ступінь дисоціації, константу
дисоціації та рН розчину кислоти за
даних умов.
=380·10-4
Ом-1·м2·кмоль-1.
Розрахуйте ступінь дисоціації, константу
дисоціації та рН розчину кислоти за
даних умов.
22. Абсолютні рухливості іонів Н+ і ОCl в розбавленому розчині за 291 К дорівнюють відповідно 31.3·10-8 і 6.1·10-8 м2/(с·В). Розрахуйте еквівалентні електропровідності і числа перенесення іонів розчину НОCl.
23. Для нескінченно розбавленого розчину NaCl за температури 298 K число перенесення катіону дорівнює t+=0.382. Розрахуйте еквівалентну електропровідність і абсолютну рухливість аніону СІ-, якщо еквівалентна електропровідність нескінченно розбавленого розчину NaCl становить λ0=0.01265 Ом-1·моль-1·м2.
24. Розрахуйте еквівалентну електропровідність за 298К і за нескінченного розбавлення для водного розчину оцтової кислоти, якщо константа дисоціації К=1.754·10-5, а еквівалентна електропровідність за концентрації с=0.03 моль/л дорівнює 9.58 Ом-1см2 моль-1.
25. Залежність добутку розчинності електроліту типу КА від температури записується рівнянням lnLKA =-A/Т - BlnT - CT + D. Виведіть рівняння залежності теплоти дисоціації електроліту від температури. За якої температури розчинність досягає максимального значення?
26. Залежність іонного добутку води від температури має вигляд:
lnKW =-12073.2/T – 27.24lnT – 0.0196T + 81.513.
Виведіть рівняння залежності теплоти дисоціації від температури. За якої температури іонний добуток води досягає максимального значення?
27.
Стандартні електродні потенціали
мідного і цинкового електродів відповідно
дорівнюють:
 .
Розрахуйте ЕРС гальванічного елементу,
складеного з електродівZn2+|
Zn
(
.
Розрахуйте ЕРС гальванічного елементу,
складеного з електродівZn2+|
Zn
(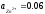 )i
Cu2+|
Cu
(
)i
Cu2+|
Cu
(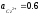 ).
).
28. Стандартні електродні потенціали електродів, на яких відбуваються реакції Fe2+ + 2e = Fe i Fe3+ + e = Fe2+, дорівнюють -0.440 В і +0.771 В відповідно. Розрахуйте стандартний електродний потенціал електроду, на якому відбувається реакція Fe3+ + 3e = Fe.
29. Напишіть рівняння реакцій, що відбуваються в наведених гальванічних елементах:
a) Zn | ZnSO4 || CuSO4 | Cu
b) Сs | СsСI || KCl| AgCl | Ag
c) K | KNO3 || AgNO3 | Ag
d) Ag |AgI |KI || {FeCl3, FeCI2} | Pt
e) Pt | {Cu2+, Cu+} || Cl־| Cl2 | Pt
30. Запишіть гальванічні елементи в яких відбуваються наступні реакції:
a) Zn + 2Fe3+ = Zn2+ + Fe2+
b) H2 +Cl2 = 2HCl
c) 2Ag+ + H2 = 2Ag + 2H+
d) CuSO4 + Cd = CdSO4 + Cu
31. Запишіть рівняння реакцій , що відбуваються в наведених гальванічних елементах, та розрахуйте для них константи рівноваги за температури 298К:
1) Zn|ZnSO4||AgNO3|Ag
2) Pt|{Sn4+;Sn2+}||{Fe3+;Fe2+}|Pt
Стандартні електродні потенціали за даної температури дорівнюють:
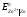 =
-0.763 В;
=
-0.763 В;
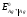 = 0.799 В;
= 0.799 В;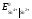 =
0.15 В;
=
0.15 В; =
0.771 В.
=
0.771 В.
32. Розрахуйте рН розчину, якщо за температури Т = 298 К ЕРС елементу
Pt | Hg | Hg2Cl2| KCl || H+, хінгідрон| Pt
становить 0.15 В. Стандартний електродний потенціал хінгідронного електроду дорівнює + 0.6994 В, каломельного + 0.3341 В.
33.
Електрорушійна сила елементу
( =
1атм,
=
1атм,
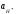 =1,[КСІ]
= 0.1 М.)
=1,[КСІ]
= 0.1 М.)
Pt | H2|H+|| KCl | Hg2Cl2 | Hg |Pt
дорівнює 0.4 В за температури 298 К. Розрахуйте рН розчину кислоти, якщо електродний потенціал каломельного електроду становить 0.3341 В.
34. ЕРС гальванічного елементу ZnZnСІ2;Hg2СІ2Hg за 298 К дорівнює 1.23В. Концентрація ZnСІ2 в розчині дорівнює 0.52М. Розрахуйте середній іонний коефіцієнт активності ZnСІ2 в даному розчині за 298 К. Величини стандартних електродних потенціалів знайдіть у довіднику.
35. ЕРС гальванічного елементу CdCdCl2;PbCl2Pb за 298 К дорівнює 0.277В, а температурний коефіцієнт становить -4.8·10-4В/К.Напишіть рівняння реакції, що відбувається в цьому елементі, і розрахуйте S, G і H для цієї реакції за 298 К.
36. Під яким тиском поступає хлор в лівий електрод, якщо ЕРС елементу
Pt СІ2 HCl, aq СІ2 Pt
PСІ =?
0.01М PСІ
=?
0.01М PСІ =1атм.
=1атм.
за температури 298 К дорівнює 0.0059В.
37. Яким чином повинен бути складений гальванічний елемент в якому відбувається реакція
Ag+ + Cl- = AgCl.
38. Чи можливе протікання за стандартних умов реакції Fe3+ + Ag = Ag+ + Fe2+ (Т=298 К), якщо стандартні електродні потенціали дорівнюють:
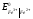 =
0.771В,
=
0.771В,
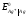 =0.799
В.
=0.799
В.
39. Розрахуйте стандартний електродний потенціал електроду AgAglKl за 298К, якщо при цій температурі добуток розчинності AgI дорівнює 8.3·10-17. Стандартний електродний потенціал срібного електроду 0.799В.
40. Розрахуйте константу рівноваги реакції ZnSO4 + Cd = CdSO4 + Zn за температури 25oC, якщо стандартні електродні потенціали електродів Zn2+Zn і Cd2+Cd відповідно дорівнюють -0.763 В і -0.403 В.
41. Розрахуйте константу рівноваги реакції ZnSO4 + Cd = CdSO4 + Zn за температури 250С по даних про стандартні електродні потенціали.
42. По значеннях стандартних електродних потенціалів за температури 298 К розрахуйте константу рівноваги реакції:
CuSO4 + Sn = SnSO4 + Cu
43. По значеннях стандартних електродних потенціалів визначить ймовірність протікання реакції Mn + Fe3+ = Fe2+ + Mn 2+. Розрахуйте константу рівноваги реакції за температури 298 К.
44. ЕРС елементу в якому за температури 298 К відбувається реакція 0.5Hg2Cl2 + Ag = AgCl + Hg, дорівнює 0.456В і 0.439В за температури 293 К. Розрахуйте S, G і H реакції.
45. За температури 298К електрорушійна сила елементу Cd(тв)|CdI2|AgI(тв)|Ag дорівнює Е = 0.285 В. Розрахуйте активність CdI2 в розчині.
46. Розрахуйте тепловий ефект реакції Zn + 2AgCl = ZnCl2 + 2Ag, що відбувається у гальванічному елементі за температури 273 К, якщо ЕРС елементу становить E= 1.015 В і температурний коефіцієнт ЕРС дорівнює
 =-4.02·10-4
В/K.
=-4.02·10-4
В/K.
47. Електрорушійна сила елементу
AgAgСІ HCl, aq Hg2СІ2 Hg
дорівнює
Е
= 0.046 В, температурний коефіцієнт ЕРС за
температури 298 К становить
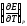 =3.38·10-4В/К.
Розрахуйте зміну ізобарно-ізотермічного
потенціалу, ентропії і ентальпії реакції,
що відбувається в елементі.
=3.38·10-4В/К.
Розрахуйте зміну ізобарно-ізотермічного
потенціалу, ентропії і ентальпії реакції,
що відбувається в елементі.
48. ЕРС елементу PtH2HClAgClAg за температури 25 0С дорівнює 0.322 В. Чому дорівнює рН розчину НСІ?
49. Залежність ЕРС від температури для елементу, в якому протікає реакція
Zn + Hg2SO4 = Zn SO4 + 2Hg
має вигляд: Е = 1.4328 – 0.0011(Т – 298) - 7·10-6(Т – 298)2.
Розрахуйте значення ΔG, ΔS, і ΔH реакції за температури 303 К.
50. В гальванічному елементі за температури 298 К оборотно протікає реакція Cd+2AgCl=CdCl2+2Ag. Розрахуйте зміну ентропії, якщо стандартна ЕРС елементу становить Eo= 0.6753 В, а стандартні ентальпії утворення CdCl2 і AgCl дорівнюють -389.7 і -126.9 кДж./моль відповідно.
51. Три гальванічні елементи мають стандартні ЕРС за температури 298К 0.01, 0.1 і 1.0 В відповідно. Розрахуйте константи рівноваги реакцій, що відбуваються в елементах, якщо кількість електронів, що приймають участь в елементарних окисно-відновних реакціях елементів, n = 1.
52. ЕРС елементу, в якому оборотно відбувається реакція 0.5Hg2Cl2+Ag=AgCl+Hg, дорівнює 0.456 В за температури 298К і 0.439 за температури 293К. Розрахуйте ΔG, ΔS, і ΔH реакції за температури 300 К.
53.
Розрахуйте константу рівноваги реакції
Cd
+ Cu2+
= Cu
+ Cd2+,
якщо стандартні потенціали мідного і
кадмієвого електродів дорівнюють:
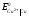 =+0.337В,
=+0.337В,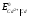 =
- 0.403В.
=
- 0.403В.
54. Розрахуйте тепловий ефект реакції Zn + 2AgCl = ZnCl2 + 2Ag , що відбувається в гальванічному елементі за температури 273 К, якщо ЕРС елементу дорівнює 1.015В, а температурний коефіцієнт - -4.02·10-4 В/К.
55. В гальванічному елементі за температури 298К оборотньо протікає реакція Cd+2AgCl=CdCl2+2Ag. Розрахуйте зміну ентропії реакції, якщо стандартна ЕРС елементу Е0 = 0.6753В, а стандартні ентальпії утворення CdCl2 i AgCl дорівнюють -389.7 і -126.9 кДж/моль відповідно.
56. ЕРС елементу, в якому відбувається реакція H2 + 2AgBr = 2HBr + 2Ag, змінюється з температурою згідно рівнянню:
Е = 0.07131 – 4.99·10-4(Т – 298) – 3.45·10-6(Т – 298)2
Розрахуйте для даної реакції,ΔU за температури 308 К.
57. Для елементу Pt|{A;B}|| {C;D}| Pt за температури 298 К по довідникових даних про стандартні електродні потенціали і активності реагентів запишіть рівняння, що відбувається в гальванічному елементі і розрахуйте електрорушійну силу елементу, енергію Гіббса і константу рівноваги окисно-відновної реакції:
|
№ |
А |
В |
С |
D |
aA |
aB |
aC |
aD |
|
1 |
Tl3+ |
Tl+ |
Cr3+ |
Cr2+ |
0.002 |
0.1 |
0.06 |
0.02 |
|
2 |
Sn4+ |
Sn2+ |
Ce4+ |
Ce3+ |
0.03 |
0.001 |
0.02 |
0.05 |
|
3 |
Fe3+ |
Fe2+ |
Co3+ |
Co2+ |
0.01 |
0.03 |
0.1 |
0.05 |
|
4 |
V3+ |
V2+ |
Pu4+ |
Pu3+ |
0.02 |
0.05 |
0.6 |
0.02 |
|
5 |
UO22+ |
UO2+ |
S2O82- |
SO42- |
0.1 |
0.5 |
0.03 |
0.08 |
58. Для реакції, що відбувається оборотньо в гальванічному елементі, дається рівняння залежності електрорушійної сили Е від температури. За заданої температури Т розрахуйте електрорушійну силу елементу (Е), зміну енергії Гіббса (ΔG), ентальпії (ΔH), ентропії (ΔS), енергії Гельмгольця (ΔA) і теплоту (Q), що виділяється, чи поглинається при роботі елементу. Розрахунки проводити для 1 моля реагуючої речовини.
|
№ |
Т,К |
Реакція |
Рівняння Е = f(T) |
|
1 |
310 |
Pb+PbO2+2H2SO4=2PbSO4+2H2O |
E = 2.1191 + 1.62·10-4(T-273) + + 8.5·10-7(T-273)2 |
|
2 |
363 |
Hg2SO4+Cd= CdSO4+2Hg |
E = 1.0183-4.06·10-5(T-298) |
|
3 |
350 |
2AgI+Pb=2Ag+PbI2 |
E=0.259-1.38·10-4T |
|
4 |
298 |
Hg2Cl2+Pb=2Hg+PbCl2 |
E=0.5353+1.45·10-4T |
|
5 |
350 |
ZnCl2+2Hg=Hg2Cl2+Zn |
E=1.0045+9.4·10-5(T-298) |
|
6 |
290 |
2Hg+2Cl-=Hg2Cl2+2e |
E=0.2415-6.5·10-4(T-298) |
59. В гальванічному елементі протікає реакція CuSO4 + Zn = ZnSO4 + Cu. Розрахуйте ΔH і ΔS реакції, якщо ЕРС елементу дорівнює 1.960 В і 1.961 В за температур 273 К і 276 К відповідно.
60. В елементі Вестона відбувається реакція Cd + Hg2SO4 = Cd2+ + 2Hg. Розрахуйте ЕРС цього елементу за температури 303 К, якщо ΔH і ΔS реакції дорівнюють -198.8 кДж/моль и -7.8 Дж/(моль∙K)
61. Тепловий ефект реакції Pb + 2AgCl = PbCl2 + 2Ag, що відбувається у гальванічному елементі, дорівнює ΔH = -105.1 кДж/моль. За температури 298.2К ЕРС елементу дорівнює 0.4901 В. Розрахуйте ЕРС елементу за температури 293.2К.
