
- •Фізична хімія
- •Розчини електролітів. Електрохімія
- •Основні поняття, рівняння і символи
- •Приклади розв’язку типових задач
- •Завдання для самостійної роботи Задача 1.1
- •Варіанти завдань до задачі 1.1
- •Приклад розв’язку задачі 1.1
- •А) Розв’язок задачі для слабкого електроліту.
- •Значення питомої і молярної електропровідності
- •Б) Приклад розв’язку задачі для сильного електроліту
- •Контрольні задачі
- •Хімічна кінетика
- •Основні рівняння і символи
- •Приклади розв’язку типових задач
- •0.25 Моль/л
- •Задачі для самостійної роботи Задача 2.1
- •Варіанти завдань до задачі 2.1
- •Задача 2.2
- •Варіанти завдань до задачі 2.2
- •Задача 2.3
- •Варіанти завдань до задачі 2.3
- •Задача 2.4
- •Варіанти завдань до задачі 2.4
- •Вихідні дані до задачі 2.4
- •Приклад розв’язку задачі 2.1
- •Експериментальні значення кінетичних досліджень
- •Результати розрахунку констант швидкості
- •Дані для побудови графіків
- •Приклад розв’язку задачі 2.2
- •Приклад розв’язку задачі 2.3
- •Константи швидкості та термодинамічні параметри реакції
- •Приклад розв’язку задачі 2.4
- •Вихідні дані до задачі 2.4
- •Результати розрахунку квантового виходу реакції
- •Контрольні задачі
- •Список літератури
- •Фізична хімія
Дані для побудови графіків
|
τ, хв |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
ln c |
0,69 |
-0,56 |
-0,88 |
-1,08 |
-1,22 |
-1,33 |
-1,42 |
-1,49 |
-1,56 |
|
|
0,50 |
1,75 |
2,42 |
2,94 |
3,38 |
3,77 |
4,13 |
4,44 |
4,76 |
|
|
0,25 |
3,05 |
5,83 |
8,65 |
11,41 |
14,24 |
17,08 |
19,75 |
22,68 |
За даними табл. 2.8 будуємо графіки відповідних залежностей - рис. 2.2-2.4.
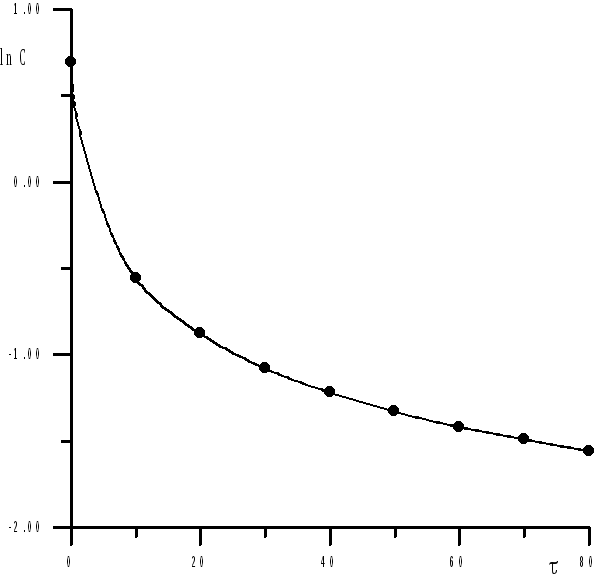
Рис. 2.6. Кінетичні дані в координатах реакції першого порядку.
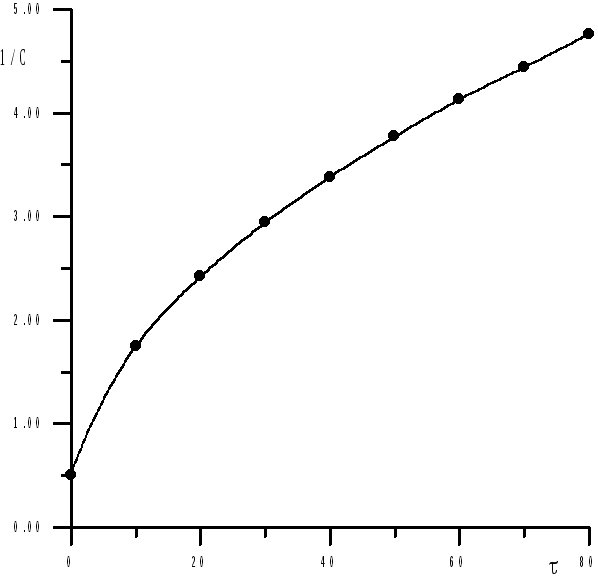
Рис. 2.7. Кінетичні дані в координатах реакції другого порядку.

Рис. 2.8. Кінетичні дані в координатах реакції третього порядку.
Тільки в координатах для реакції третього порядку (рис.2.4). графічна залежність є лінійною. Отже, ця реакція є реакцією третього порядку. Константу швидкості в даному випадку визначаємо за тангенсом кута нахилу прямої до осі абсцис:
kIII = 0,5·tgα.
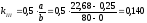 ,
,
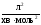
Розраховані двома методами константи швидкості співпадають з точністю до третього знака.
3. Для побудови графіка lnk=f(1/T) розраховуємо дані та заносимо в табл. 2.9.
Таблиця 2.17
Величини для побудови графіка lnk=f(1/T)
|
kIII,
|
Т, К |
lnk |
|
|
2,55·10-2 |
300 |
-3,669 |
3,333 |
|
5,97·10-2 |
310 |
-2,818 |
3,225 |
|
1,40·10-2 |
320 |
-1,966 |
3,125 |
За даними табл. 2.9 будуємо графік

Рис. 2.9.Залежність логарифму константи швидкості від оберненої температури
За тангенсом кута нахилу прямої знаходимо енергію активації цієї реакції:
E = – R·tgα
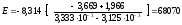 ,
,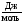
Передекспонентний
множник знайдемо з рівняння Арреніуса:
 ,
звідки
,
звідки
 ;
; ;
;

Середнє
значення 1,80·1010
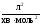 .
.
4. Температурний коефіцієнт Вант-Гоффа показує, у скільки разів зростає швидкість реакції при підвищенні температури на 10о:
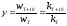
У випадку, коли різниця температур не дорівнює 10 градусів, застосовують наступне рівняння:

В наведеному прикладі різниця становить 10К, тому використовуємо наступне рівняння:


За правилом Вант-Гоффа при підвищені температури на 10К швидкість реакції зростає у 2-4 рази. За результатами проведеного розрахунку швидкість зросла у 2,34 рази. Отже, дана реакція підпорядковується правилу Вант-Гоффа.
Приклад розв’язку задачі 2.2
Для хімічної реакції
C2H4 + H2 → C2H6 ,
що відбувається за температури 650 К, розрахуйте значення енергії активації за допомогою теорії активних зіткнень, якщо константа швидкості реакції дорівнює k = 2.12∙10-7 м3/(моль·с), середній діаметр реагуючих частинок становить σ=2∙10-10 м, а стеричний фактор Р=0,05.
 Константа
швидкості бімолекулярної хімічної
реакції згідно теорії активних зіткнень
дорівнює:
Константа
швидкості бімолекулярної хімічної
реакції згідно теорії активних зіткнень
дорівнює:

Звідси енергія активації дорівнює:
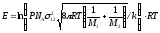
Підставимо в цей вираз значення наведені в умові задачі, сталу Авогадро та молярні маси реагентів і розрахуємо значення енергії активації:
 =
=
=151627 Дж
Приклад розв’язку задачі 2.3
Для хімічної реакції
CO + H2O → CO2 + H2
визначено температурну залежність констант швидкості:
|
Т, К |
325 |
335 |
345 |
355 |
365 |
|
k, м3/(моль·с) |
0,0452 |
0,1153 |
0,3512 |
0,9879 |
2,6464 |
За наведеними даними розрахуйте значення:
а) енергії активації;
б) передекспонентного множника;
в) теплоти активації;
г) ентропії активації;
д) температурного коефіцієнту швидкості реакції.
Згідно рівняння Ареніуса
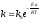
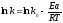
константа швидкості в координатах ln k=f(1/T) має лінійну залежність. Для побудови графіка розраховуємо значення ln k і 1/T та заносимо їх у таблицю.
|
1/Т ∙103 |
3,077 |
2,985 |
2,899 |
2,817 |
2,740 |
|
ln (k) |
-3,0967 |
-2,1602 |
-1,0464 |
-0,0122 |
0,9732 |
За розрахованими значеннями будуємо графік ln k=f(1/T):

Рис. 2.10. Залежність логарифму константи швидкості від оберненої температури
а) за графіком знаходимо тангенс кута нахилу прямої лінії та розраховуємо енергію активації:
 1/К;
1/К;
Ea = -R tg a = 100408 Дж/моль
б) за рівнянням Ареніуса розраховуємо передекспонентний множник для середини температурного інтервалу:
 м3/моль/с;
м3/моль/с;
Аналогічно розраховуємо для інших значень температур і відповідних констант швидкостей та заносимо значення у таблицю 2.10.
Середнє значення передекспонентного множника становить 5,825∙1014 м3/(моль·с)
в) розраховуємо теплоту активації:
ΔH≠ = Ea – RT = 100408 – 8,314∙345 = 97540 Дж/моль
Аналогічно розраховуємо для інших температур та заносимо значення у таблицю 2.10.
г) розраховуємо ентропію активації, за умови, що трансмісійний коефіцієнт дорівнює одиниці, а х для бімолекулярної реакції приймаємо рівним двом:
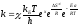
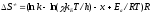

Аналогічно розраховуємо для інших температур та заносимо значення у таблицю 2.10.
д) розраховуємо температурний коефіцієнт швидкості реакції:
 =
= =
=
 =
0.2766
=
0.2766
Таблиця 2.18
