
- •Фізична хімія
- •Розчини електролітів. Електрохімія
- •Основні поняття, рівняння і символи
- •Приклади розв’язку типових задач
- •Завдання для самостійної роботи Задача 1.1
- •Варіанти завдань до задачі 1.1
- •Приклад розв’язку задачі 1.1
- •А) Розв’язок задачі для слабкого електроліту.
- •Значення питомої і молярної електропровідності
- •Б) Приклад розв’язку задачі для сильного електроліту
- •Контрольні задачі
- •Хімічна кінетика
- •Основні рівняння і символи
- •Приклади розв’язку типових задач
- •0.25 Моль/л
- •Задачі для самостійної роботи Задача 2.1
- •Варіанти завдань до задачі 2.1
- •Задача 2.2
- •Варіанти завдань до задачі 2.2
- •Задача 2.3
- •Варіанти завдань до задачі 2.3
- •Задача 2.4
- •Варіанти завдань до задачі 2.4
- •Вихідні дані до задачі 2.4
- •Приклад розв’язку задачі 2.1
- •Експериментальні значення кінетичних досліджень
- •Результати розрахунку констант швидкості
- •Дані для побудови графіків
- •Приклад розв’язку задачі 2.2
- •Приклад розв’язку задачі 2.3
- •Константи швидкості та термодинамічні параметри реакції
- •Приклад розв’язку задачі 2.4
- •Вихідні дані до задачі 2.4
- •Результати розрахунку квантового виходу реакції
- •Контрольні задачі
- •Список літератури
- •Фізична хімія
Приклади розв’язку типових задач
Приклад 1. Необоротна хімічна реакція відбувається за першим порядком. За 15 хвилин прореагувало 67% вихідної речовини. Чому дорівнює константа швидкості реакції і час напіврозпаду?
Розв’язок. Для реакції першого порядку константа швидкості може бути розрахована за формулою:
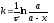 ,
,
де а – початкова кількість вихідної речовини, х – кількість речовини, що прореагувала на момент часу τ. х = 0.67 а. Тоді:
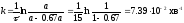
Час напіврозпаду для реакції першого порядку дорівнює:
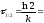
 9.38
хв.
9.38
хв.
Приклад 2. Для бімолекулярної реакції О·(г) + ОН·(г) → О2(г) + Н·(г) константа швидкості дорівнює k = 1.3·1010 л·моль-1·с-1. Порівняйте швидкості даної реакції а)за еквімолярного співвідношення вихідних реагентів на початку реакції ([О·]0 = [ОН·]0 = 1.0·10-4 моль·л-1 ) і б) за нееквімолярного співвідношення їх початкових концентрацій ( [О·]0 = 1.0·10-4 моль·л-1, [ОН·]0 = 2.0·10-4 моль·л-1). Чому буде дорівнювати концентрація О·(г) через 1.0·10-6 секунди у ціх двох випадках?
Розв’язок. Швидкість реакції за законом дії мас для елементарної стадії реакції дорівнює:
а)
 1.3·1010·1.0·10-4
1.0·10-4
= 130 моль·л-1
с-1;
1.3·1010·1.0·10-4
1.0·10-4
= 130 моль·л-1
с-1;
б)
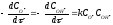 =
1.3·1010·1.0·10-4
2.0·10-4
= 260 моль·л-1
с-1;
=
1.3·1010·1.0·10-4
2.0·10-4
= 260 моль·л-1
с-1;
Розрахунки показують, що збільшення концентрації одного з реагентів вдвічі, прискорює і швидкість реакції вдвічі.
Кінетичні рівняння для реакції другого порядку за еквімолярного (а) і нееквімолярного (б) співвідношеннях реагентів розрізняються. Для еквімолярного співвідношення між концентраціями О·(г) і ОН·(г) скористаємось рівнянням:
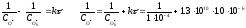 =
2.3·104
л·моль-1.
=
2.3·104
л·моль-1.
Звідки
 =
4.35·10-5
моль л-1.
=
4.35·10-5
моль л-1.
Для випадку нееквімолярного співвідношення вихідних реагентів (варіант б) кінетичне рівняння набуває вигляду:
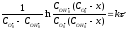 ;
;
де х – кількість вихідної речовини, що прореагувала на момент часу τ. Після підстановки вихідних даних одержуємо:
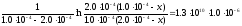
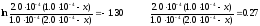
Звідки
х
= 8.44·10-5
моль л-1
і концентрація О·(г)
на момент часу 1.0·10-6
с дорівнює:
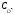 =
=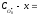 1.0·10-4
- 8.4·10-5
= 1.6·10-5
моль л-1.
1.0·10-4
- 8.4·10-5
= 1.6·10-5
моль л-1.
Приклад 3. При дослідженні термічного розкладу AsH3 (Т = 3500С) за рівнянням 2AsH3(г) = 2 As(тв) + 3Н2 вимірювали зміну загального тиску газової фази з часом:
|
τ, год. |
0 |
3.84 |
17.1 |
25.00 |
39.91 |
45.02 |
|
Заг.тиск(РΣ), см Hg |
39.2 |
40.3 |
43.65 |
45.35 |
48.05 |
48.85 |
Визначіть порядок реакції і розрахуйте константу швидкості реакції.
Розв’язок.
Тиск на початку реакції становить Р0
(Р0
=39.2
см Hg).
В ході реакції парціальний тиск AsH3
зменшиться і буде становити на момент
часу τ:
 =
Р0–2х.
Парціальний тиск водню на цей момент
буде дорівнювати 3х,
а загальний тиск в системі дорівнює
сумі парціальних тисків компонентів,
що знаходяться у газовій фазі: РΣ
= Р0–2х
+ 3х
= Р0
+
х.
Значення х
на момент часу τ
буде дорівнювати: х
= РΣ
- Р0.
=
Р0–2х.
Парціальний тиск водню на цей момент
буде дорівнювати 3х,
а загальний тиск в системі дорівнює
сумі парціальних тисків компонентів,
що знаходяться у газовій фазі: РΣ
= Р0–2х
+ 3х
= Р0
+
х.
Значення х
на момент часу τ
буде дорівнювати: х
= РΣ
- Р0.
|
τ, год. |
3.84 |
17.1 |
25.00 |
39.91 |
45.02 |
|
х, см Hg |
1.1 |
4,45 |
6,15 |
8,85 |
9,65 |
Для визначення порядку реакції скористаємось методом підстановки. Для цього в кінетичні рівняння реакцій різних порядків підставимо значення тисків і відповідного часу. Рівняння, розрахунок за яким дасть стабільні значення константи швидкості, вкаже на порядок реакції. Для необоротної реакції першого порядку кінетичне рівняння має вигляд:
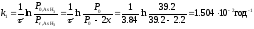
Аналогічні розрахунки для інших моментів часу і відповідних величин "х" дають наступні значення констант швидкостей: τ = 17.1год. х = 4.45 см, k2=1.506·10-2год-1; τ = 25.00 год. х =6.15 см, k3=1.506·10-2 год-1; τ = 39.91год. х =8.85 см, k4=1.505·10-2год-1; τ = 45.02год. х = 9.65 см, k2=1.506·10-2год-1.
Константа практично не змінюється. Розрахунок проводився за рівнянням необоротної реакції першого порядку. Таким чином дана реакція є реакцією першого порядку. Середнє значення константи швидкості kсер=1.506·10-2год-1.
Приклад 4. Розрахуйте порядок реакції хлорування пропанолу, якщо відомі наступні кінетичні дані:
|
τ, хв. |
0 |
3 |
|
С1(пропанол), моль/л |
0.00924 |
0.0050 |
|
С2(пропанол), моль/л |
0.00481 |
0.00259 |
Розв’язок. Для розв'язку скористаємось методом Вант-Гоффа:
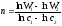 .
.
Середні швидкості реакції дорівнюють w = Δc/Δτ :
W1 = (0.00924 - 0.00500)/ 3= 1.413·10-3моль·л-1·с-1,
W2 = (0.00481 - 0.00259)/ 3 = 7.400·10-4моль·л-1·с-1,
Середні швидкості відповідають середнім значенням концентрацій:
С1(сер) = (0.00924 + 0.00500)/ 2 = 0.00712 моль·л-1
С2(сер) = (0.00481 + 0.00259)/ 2 = 0.0037 моль·л-1
Порядок реакції становить:
 =
0.991≈ 1.
=
0.991≈ 1.
Дана реакція проходить за першим порядком.
Приклад 5. Швидкість реакції (С2Н5)3N + CH3I → [(С2Н5)3N+( CH3)]I- у нітробензолі визначалась за температури 250С і були одержані значення:
|
τ, с |
1200 |
1800 |
2400 |
3600 |
4500 |
5400 |
|
х, моль·л-1 |
0,00876 |
0,01066 |
0,01208 |
0,01392 |
0,01476 |
0,01538 |
де τ – час; х – кількість триетиламіну чи йодистого метилу, що прореагували на момент часу τ. Початкові концентрації вихідних реагентів однакові і дорівнюють С0 = 0.0198 моль л-1. Реакція проходить за другим порядком. Розрахуйте константу швидкості реакції.
Розв’язок. Дана реакція відноситься до реакцій другого порядку з еквімолярним співвідношенням реагентів. Для таких реакцій константу швидкості розраховуємо за рівнянням:
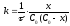
де х – кількість вихідної речовини, що вступила в реакцію на момент часу τ.
Розрахунок константи швидкості на момент часу τ = 1200 с одержуємо:
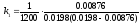 =
0.0334 л·моль-1·с-1;
=
0.0334 л·моль-1·с-1;
На момент часу τ = 1800 с константа становить:
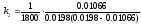 =
0.0327 л·моль-1·с-1;
=
0.0327 л·моль-1·с-1;
Аналогічні розрахунки для інших проміжків часу дають значення констант:
k = 0.0329; 0.0332; 0.0329; 0.0325 л·моль-1·с-1.
Середнє значення константи швидкості дорівнює 0.0329 л·моль-1·с-1.
Приклад 6. Константа швидкості хімічної реакції нульового порядку А→В становить k = 5·10-8 моль л-1·c-1. За який час концентрація вихідної речовини зміниться: а) від 4·10-4 моль л-1 до 2·10-4 моль л-1: б) від 2·10-4 моль л-1 до 1·10-4 моль л-1 ?
Розв’язок. В обох випадках концентрація вихідного реагенту зменшується вдвічі, тому цей час дорівнює напівперіоду реакції τ1/2. Для реакції нульового порядку напівперіод реакції можна розрахувати за формулою:
τ1/2
=
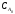 /(2k)
/(2k)
де
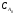 - початкова концентрація вихідної
речовини.
- початкова концентрація вихідної
речовини.
Для варіанту "а" напівперіод реакції становить:
τ1/2
=
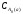 /(2k)
=
/(2k)
=
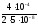 = 4·103
с.
= 4·103
с.
Для
варіанту "б"
τ1/2
=
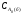 /(2k)
=
/(2k)
=
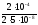 = 2·103
с.
= 2·103
с.
З
аналізу рівнянням τ1/2
= f( )та
одержаних результатів можна зробити
висновок, що початкова концентрація
речовини впливає на величину напівперіоду
реакції нульового порядку і при зростанні
початкової концентрації цей час
збільшується прямопропорційно.
)та
одержаних результатів можна зробити
висновок, що початкова концентрація
речовини впливає на величину напівперіоду
реакції нульового порядку і при зростанні
початкової концентрації цей час
збільшується прямопропорційно.
Приклад 7. Послідовна реакція першого порядку проходить за схемою:
k1 k 2
А → В → С
За температури 298 К константи швидкостей дорівнюють: k1 = 0.05 хв-1, k2 = 0.1 хв-1. Початкова концентрація вихідної речовини "А" дорівнює СА(0) =1 моль/л. Розрахуйте: 1) час досягнення максимальної концентрації проміжної речовини "В"; 2) максимальну концентрацію речовини "В" в ході реакції; 3) концентрації речовин "А" і "С" на момент часу τмакс.
Розв’язок. 1) Час досягнення максимальної концентрації проміжної речовини розраховуємо за формулою:
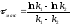 =
=
 =
13.86 хв.
=
13.86 хв.
2) Максимальна концентрація речовини "В" відповідає часу τмакс і дорівнює:
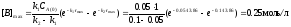 3)
Концентрації речовин "А" і "С"
на цей момент часу дорівнюють:
3)
Концентрації речовин "А" і "С"
на цей момент часу дорівнюють:
СА
=
СА(0)
 =
1·
=
1· =
0.5
моль/л
=
0.5
моль/л
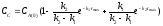 =
=
