
- •Фізична хімія
- •Розчини електролітів. Електрохімія
- •Основні поняття, рівняння і символи
- •Приклади розв’язку типових задач
- •Завдання для самостійної роботи Задача 1.1
- •Варіанти завдань до задачі 1.1
- •Приклад розв’язку задачі 1.1
- •А) Розв’язок задачі для слабкого електроліту.
- •Значення питомої і молярної електропровідності
- •Б) Приклад розв’язку задачі для сильного електроліту
- •Контрольні задачі
- •Хімічна кінетика
- •Основні рівняння і символи
- •Приклади розв’язку типових задач
- •0.25 Моль/л
- •Задачі для самостійної роботи Задача 2.1
- •Варіанти завдань до задачі 2.1
- •Задача 2.2
- •Варіанти завдань до задачі 2.2
- •Задача 2.3
- •Варіанти завдань до задачі 2.3
- •Задача 2.4
- •Варіанти завдань до задачі 2.4
- •Вихідні дані до задачі 2.4
- •Приклад розв’язку задачі 2.1
- •Експериментальні значення кінетичних досліджень
- •Результати розрахунку констант швидкості
- •Дані для побудови графіків
- •Приклад розв’язку задачі 2.2
- •Приклад розв’язку задачі 2.3
- •Константи швидкості та термодинамічні параметри реакції
- •Приклад розв’язку задачі 2.4
- •Вихідні дані до задачі 2.4
- •Результати розрахунку квантового виходу реакції
- •Контрольні задачі
- •Список літератури
- •Фізична хімія
Приклад розв’язку задачі 2.1
У табл. 2.6 вносимо експериментальні дані зміни концентрації реагуючих речовин внаслідок протікання хімічної реакції.
Таблиця 2.14
Експериментальні значення кінетичних досліджень
|
Номер досліду |
Т,К |
Експериментальні дані кінетичних досліджень τ, хв; с, моль/л | |||||||||
|
1 |
300 |
τ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
с |
2,00 |
1,147 |
0,887 |
0,750 |
0,661 |
0,598 |
0,550 |
0,512 |
0,481 | ||
|
2 |
310 |
τ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
с |
2,00 |
0,832 |
0,616 |
0,511 |
0,446 |
0,401 |
0,367 |
0,341 |
0,319 | ||
|
3 |
320 |
τ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
с |
2,00 |
0,573 |
0,414 |
0,340 |
0,296 |
0,265 |
0,242 |
0,225 |
0,210 | ||
1. За експериментальними даними, наведеними у таблиці 2.6, будуємо графік залежності с = f (τ) (Рис. 2.1).

Рис. 2.5. Експериментальні кінетичні криві: ○– за температури 300К;
□– за температури 310К; Δ– за температури 320К;
2. Для знаходження порядку реакції скористаємося двома методами: методом підстановки та графічним методом.
а) метод підстановки полягає в тому, що дані кінетичних досліджень підставляють у рівняння для розрахунку константи швидкості реакції першого, другого та третього порядку. Рівняння, розраховані за яким константи швидкості, найменше відрізняються при різних концентраціях, відповідає порядку за яким відбувається дана реакція.
Отже,
підставляємо експериментальні величини,
визначені за температури 300К
в рівняння для першого порядку:
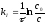 ,
,
 ,
,
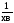 ;
;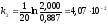 ,
,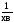
 ,
,
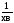 ;
; ,
,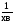
 ,
, ;
; ,
,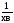
 ,
, ;
;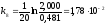 ,
,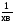
Рівняння
для другого порядку:
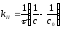 ,
,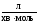
 ,
,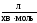 ;
;
 ,
,
 ,
,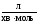
 ,
,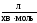
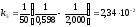 ,
,
 ,
,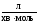
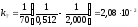 ,
,
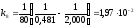 ,
,
в
рівняння для третього порядку:
 ,
,
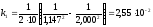 ,
,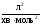
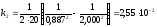 ,
,
 ,
,
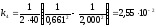 ,
,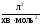
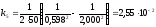 ,
,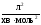
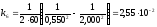 ,
,
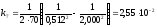 ,
,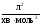
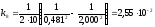 ,
,
Аналіз одержаних результатів показує, що тільки значення константи швидкості, розраховані за рівнянням для третього порядку, є величиною сталою. Отже дана реакція є реакцією третього порядку.
Так само за кінетичним рівнянням третього порядку розраховуємо константи швидкості за температур 310 та 320К. Визначені значення констант швидкості заносимо в таблицю 2.7.
Таблиця 2.15
Результати розрахунку констант швидкості
|
Константа швидкості |
Т,К |
τ, хв | |||||||
|
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 | ||
|
kI·102,
|
300 |
5,56 |
4,07 |
3,27 |
2,80 |
2,41 |
2,15 |
1,95 |
1,78 |
|
kII·102,
|
300 |
3,72 |
3,14 |
2,78 |
2,53 |
2,34 |
2,20 |
2,08 |
1,97 |
|
kIII
·102,
|
300 |
2,55 |
2,55 |
2,55 |
2,55 |
2,55 |
2,55 |
2,55 |
2,55 |
|
kIII
·102,
|
310 |
5,97 |
5,96 |
5,97 |
5,97 |
5,97 |
5,98 |
5,96 |
5,99 |
|
kIII,
|
320 |
0,14 |
0,14 |
0,14 |
0,14 |
0,14 |
0,14 |
0,14 |
0,14 |
Визначаємо
середнє значення констант швидкості:
kIII(300)=
2,55·10-2,
![]()
kIII(310)
=5,97·10-2,
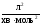 ,kIII(320)=
0,14,
,kIII(320)=
0,14,

б) графічний метод
За цим методом необхідно побудувати графіки залежності концентрації реагентів від часу у відповідних координатах:
а) для першого порядку lnc = f(τ);
б) для другого порядку 1/c = f(τ);
в) для третього порядку 1/c2 = f(τ).
Розраховуємо відповідні величини за Т=320К та записуємо в табл. 2.8.
Таблиця 2.16
