
- •Міністерство освіти і науки україни національний університет харчових технологій
- •Методи контролю біотехнологічних, фармацевтичних і харчових виробництв лабораторний практикум
- •Київ нухт 2014
- •Інструкція з охорони праці при проведенні робіт у навчальних лабораторіях кафедри
- •1. Загальні вимоги до техніки безпеки
- •2. Правила техніки безпеки
- •3. Вимоги безпеки у аварійних ситуаціях
- •4. Надання першої допомоги
- •5. Вимоги до оформлення лабораторних робіт
- •Лабораторна робота 1 розділення амінокислот методом тшх на силуфолових пластинках
- •Реактиви
- •Матеріали та обладнання
- •Загальні відомості
- •Хід роботи
- •Завдання для виконання
- •Контрольні запитання
- •Матеріали та обладнання
- •Загальні відомості
- •Хід роботи
- •Завдання для виконання
- •Контрольні запитання
- •Хід роботи
- •Завдання для виконання
- •Контрольні запитання
- •Розчинність речовин у воді при різних температурах (г/100 г h2o)
- •Залежність густини і концентрації розчинів NaCl від температури
- •Густина речовин
- •Залежність густини розчинів h2so4 від її масової долі у водному розчині при 25 °c
- •Хід роботи
- •Густина розчинів NaCl та kCl в г/см3, що відповідає різним концентраціям у %
- •Завдання на виконання
- •Контрольні запитання
- •Рекомендована література
- •Хід роботи
- •Завдання на виконання:
- •Контрольні запитання
- •Матеріали та обладнання
- •Загальні відомості
- •Закон Бугера – Ламберта – Бера. При прохожденні випромінення через розчин світлопоглинаючої речовини світловий потік слабшає.
- •Фотометричні методи аналізу
- •Залежність кольору речовини від довжини хвилі поглинутого світла
- •Приготування робочих розчинів для побудови калібрувальної кривої
- •Хід роботи
- •Завдання для виконання
- •Контрольні запитання
- •Рекомендована література
- •Матеріали та обладнання
- •Загальні відомості
- •Методом Лоурі
- •Хід роботи
- •Завдання для виконання
- •Контрольні запитання
- •Рекомендована література
- •Лабораторна робота 8
- •Коефіцієнт молярної екстинкції деяких цитохромів
- •Хід роботи
- •Завдання для виконання
- •Контрольні запитання
- •3. Методи генної інженерії.
- •Рекомендована література
Розчинність речовин у воді при різних температурах (г/100 г h2o)
|
Температура, °С |
0 |
20 |
50 |
80 |
100 |
|
KBr |
53,5 |
65,2 |
80,8 |
94,6 |
103,3 |
|
NaCl |
35,7 |
35,9 |
36,8 |
38,1 |
39,4 |
|
CaSO4 |
0,176 |
0,206 |
0,180 |
0,102 |
0,066 |
|
Li2CO3 |
1,54 |
1,33 |
1,08 |
0,85 |
0,72 |
Для вираження складу розчину і вмісту розчиненої речовини застосовуються різні способи.
Густина (питома маса) — маса речовини в одиниці об’єму, є фізичною характеристикою будь-якої речовини, з якої складається тіло при даній температурі (таблиця 4.2).
Таблиця 4.2
Залежність густини і концентрації розчинів NaCl від температури
|
Концентрація, %
|
Густина х10-3, кг/м3, при |
Концентра-ція, %
|
Густина х10-3, кг/м3, при | ||
|
100С |
200С |
100С |
200С | ||
|
1 |
1,0071 |
1,0053 |
14 |
1,1049 |
1,1008 |
|
2 |
1,0144 |
1,0125 |
15 |
1,1127 |
1,1065 |
|
3 |
1,0218 |
1,0196 |
16 |
1,1206 |
1,1162 |
|
4 |
1,0292 |
1,0268 |
17 |
1,1285 |
1,1241 |
|
5 |
1,0366 |
1,0340 |
18 |
1,1364 |
1,1319 |
|
6 |
1,0441 |
1,0413 |
19 |
1,1445 |
1,1398 |
|
7 |
1,0516 |
1,0486 |
20 |
1,1525 |
1,1478 |
|
8 |
1,0591 |
1,0559 |
21 |
1,1607 |
1,1559 |
|
9 |
1,0666 |
1,0633 |
22 |
1,1689 |
1,1639 |
|
10 |
1,0742 |
1,0707 |
23 |
1,1772 |
1,1722 |
|
11 |
1,0819 |
1,0782 |
24 |
1,1856 |
1,1804 |
|
12 |
1,0895 |
1,0857 |
25 |
1,1940 |
1,1888 |
|
13 |
1,0972 |
1,0933 |
26 |
1,2025 |
1,1972 |
Знаючи густину розчину, можна за таблицею визначити масову долю речовини (%) в розчині. Для випадку однорідних тіл густина ρ визначається як відношення маси тіла m до об'єму V, який воно займає і виражається в кг/м3 або г/л

В таблиці 4.3 наведена густина твердих, рідких та газоподібних речовин.
Таблиця 4.3
Густина речовин
|
Речовина |
Густина (кг/м3) |
Речовина |
Густина (кг/м3) |
|
Платина |
21 500 |
Кальцій |
1 530 |
|
Золото |
19 300 |
Морська вода |
1025 |
|
Ртуть |
13 546 |
Вода |
998 |
|
Свинець |
11 300 |
Лід |
917 |
|
Срібло |
10 500 |
Поліетилен |
910 |
|
Мідь |
8 960 |
Кисень |
1,43 |
|
Залізо |
7 870 |
Повітря |
1,2255 |
|
Алюміній |
2 700 |
Водень |
0,09 |
|
Граніт |
2 600 |
|
|
Примітка. Щільність це якісна характеристика розташування частин тіла або об'єктів без прогалин. Характеризує кількість елементів, що припадає на одиницю довжини, площі, об’єму.
Ареометр. У розчинах, що складаються з двох компонентів з різною температурою кипіння, існує функціональна залежність між густиною розчину і його концентрацією при даній температурі. Це дає можливість визначати на практиці концентрацію розчинів за допомогою ареометрів (інша назва денситометр) (рис.4.2).
Застосування ареометра засноване на тому, що плаваюче тіло занурюється в рідину до тих пір, поки маса витісненої ним рідини не стане дорівнювати масі самого тіла (закон Архімеда). У розширеній нижній частині ареометра вміщений вантаж, на вузькій верхній частині нанесені поділки, що вказують щільність рідини в г/см3де знаходиться ареометр. Ціна поділки звичацно 0,001 г/см3.
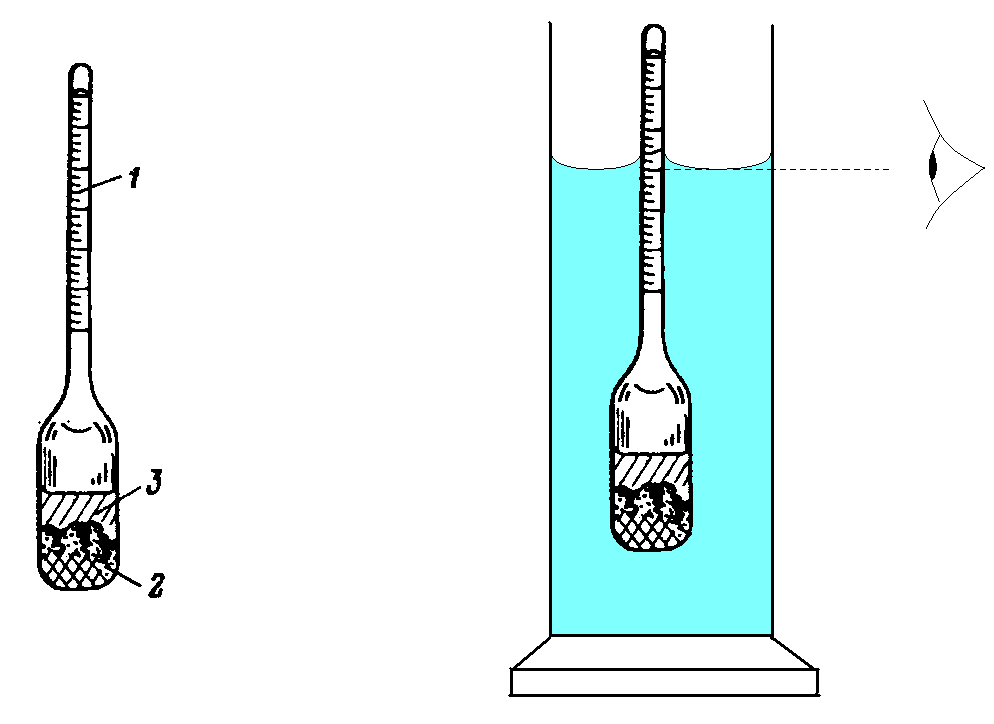
а б
Рис. 4.2. Ареометр (а) та вимірювання густини ареометром (б):
1 – шкала; 2 – баласт; 3 – визначувана рідина
Ареометри загального призначення дозволяють вимірювати щільність рідин в діапазоні 0,700 - 1,840 г/см3. Випускають набори, що містять від 10 до 25 ареометрів, кожен з яких розрахований на свій інтервал вимірів щільності, наприклад від 0,700 до 0,760 г/см3.
Перед визначенням щільності необхідно вибрати ареометр з потрібною межею вимірів. Якщо ареометр призначений для виміру щільності більшої, ніж вимірювана, то він тоне в розчині, якщо навпаки, то рідина виштовхує його. Слід пам'ятати, що щільність води складає 1 г/см3 при температурі 20оС, а водні розчини солей і більшості неорганічних кислот мають більш високу щільність.
Для виміру щільності розчину рідину наливають в скляний циліндр з діаметром, що перевищує діаметр ареометра, і заввишки не меншою, ніж довжина ареометра. Потім ареометр обережно опускають в рідину. Вимір роблять, якщо ареометр вільно плаває в розчині, не торкаючись дна і стінок циліндра. Показання визначають по нижньому краю меніска рідини (мал. 2, б). Відлік ділень шкали робиться зверху вниз.
Концентрацію досліджуваного розчину знаходять, користуючись табличними даними про щільність залежно від концентрації розчину. Щільність водних розчинів хлориду натрію приведена в таблиці 3.
Ареометри можуть бути проградуйовані не в одиницях густини, а в одиницях концентрації певного розчину для визначення концентрації якого вони призначені. Такі прилади мають назву, що відповідає їх призначенню:
- для вимірювання розчинів етилового спирту застосовують спиртометри;
- для визначення вмісту жиру в молоці - бутирометри;
- для виміру концентрації цукру - цукрометри.
Часто для вираження концентрації речовини (наприклад, сірчаної кислоти) користуються значенням густини її розчину (таблиця 4.4).
Таблиця 4.4
