
- •2 Аминокислоты, входящие в состав белков, их строение и свойства. Биологическая
- •1. Общие структурные особенности аминокислот, входящих в состав белков
- •2. Классификация аминокислот по химическому строению радикалов
- •3. Классификация аминокислот по растворимости их радикалов в воде
- •2.Характеристика пептидной связи
- •4. Вторичная структура белков. Связи стабилизирующие вторичную структуру.
- •1. Классификации шаперонов (ш)
- •2. Роль шаперонов в фолдинге белков
- •8 . Физико-химические свойства белков. Молекулярная масса, размеры и форма, растворимость, гидротация и ионизация. Денатурация, признаки и факторы ее вызывающие.
- •10. Принципы классификации белков. Классификация по составу и биологическим функциям, примеры представителей отдельных классов.
- •11. Иммуноглобулины, классы иммуноглобулинов, особенности доменного строения и
- •13. Классификация и номенклатура ферментов, примеры
- •1. Оксидоредукпшзы
- •2.Трансферты
- •3.Гидролазы
- •4. Лиазы
- •5. Изомеразы
- •6. Лигазы (синтетазы)
- •15. Кинетика ферментативных реакций. Зависимость скорости ферментативной реакции от температуры, рН среды, концентрации ферментов и субстрата. Уравнение Михаэлиса-Ментен, Кm.
- •16. Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр, в2 на примере трансаминаз и дегидрогеназ.
- •17. Ингибирование активности ферментов: обратимое (конкурентное и неконкурентное)
- •1. Конкурентное ингибирование
- •2. Неконкурентное ингибирование
- •19. Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования.
- •20. Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции протеолитической активности ферментов.
- •21. Изоферменты: происхождение, биологическое значение, примеры. Определение ферментов и изоферментного спектра плазмы крови с целью диагностики заболеваний.
- •22. Энзимопатии наследственные (фенилкетонурия) и приобретенные (цинга). Применение ферментов для лечения болезней.
- •23. Общая схема синтеза и распада пиримидиновых нуклеотидов. Регуляция. Оротоцидурия.
- •24. Общая схема синтеза и распада пуриновых нуклеотидов. Регуляция. Подагра.
- •27. Гибридизация нуклеиновых кислот. Денатурация и ренативация днк. Гибридизация (днк-днк, днк-рнк). Методы лабораторной диагностики, основанные на гибридизации нуклеиновых кислот.
- •29. Репликация. Принципы репликации днк. Стадии репликации. Инициация. Белки и ферменты, принимающие участие в формировании репликативной вилки.
- •30. Элонгация и терминация репликации. Ферменты. Асимметричный синтез днк. Фрагменты Оказаки. Роль днк-лигазы в формировании непрерывной и отстающей цепи.
- •31. Повреждения и репарация днк. Виды повреждений. Способы репарации. Дефекты репарационных систем и наследственные болезни.
- •32. Транскрипция. Характеристика компонентов системы синтеза рнк. Структура днк-зависимой рнк-полимеразы: роль субъединиц. Инициация процесса. Элонгация, терминация, транскрипция.
- •33. Первичный транскрипт и его процессинг. Рибозимы как пример каталитической активности нуклеиновых кислот. Биороль.
- •34. Генетический код и его свойства. Основные компоненты белоксинтезирующей системы: аминокислоты, аминоацил-т-рнк синтетазы т-рнк, рибосомы, источник энергии, белковые факторы, ферменты.
- •35. Сборка полипептидной цепи на рибосоме. Образование инициаторного комплекса. Элонгация: образование пептидной связи (реакция транспептидации). Транслокация. Транслоказа. Терминация.
- •1. Инициация
- •2. Элонгация
- •3. Терминация
- •36. Особенности синтеза и процессинга секретируемых белков (на примере коллагена и инсулина).
- •37. Биохимия питания. Основные компоненты пищи человека, их биороль, суточная потребность в них. Незаменимые компоненты пищи.
- •38. Белковое питание. Биологическая ценность белков. Азотистый баланс. Полноценность белкового питания, нормы белка в питании, белковая недостаточность.
- •39. Переваривание белков: протеазы жкт, их активация и специфичность, оптимум рН и результат действия. Образование и роль соляной кислоты в желудке. Защита клеток от действия протеаз.
- •40. Всасывание продуктов переваривания. Транспорт ак в клетки кишечника. Особенности транспорта ак в гепатоцитах. Y-глутамильный цикл. Нарушение переваривания и всасывания ак.
- •42. Минеральные вещества пищи, макро- и микроэлементы, биологическая роль. Региональные патологии, связанные с недостатком микроэлементов.
- •43. Биологические мембраны, строение, функции и общие свойства: жидкостность, поперечная ассиметрия, избирательная проницаемость.
- •1. Структура и свойства липидов мембран
- •2. Трансмембранная асимметрия липидов
- •3. Жидкостностъ мембран
- •4. Функции мембранных липидов
- •45. Механизм переноса веществ через мембраны: простая диффузия, пассивный симпорт и антипорт, активный транспорт, регулируемые каналы. Мембранные рецепторы.
- •1. Первично-активный транспорт
- •2. Вторично-активный транспорт
- •46. Эндергонические и экзергонические реакции живой клетки. Макроэргические соединения, определение, пример.
- •4. Сопряжение экзергонических и эндергонических процессов в организме
- •2. Цепь переноса электронов от nadh и fadh2 на кислород
- •50. Образование активных форм кислорода(синглетный кислород, пероксид водорода, гидроксильный радикал). Место образоваия, схемы реакций. Физиологическая роль афк.
- •51. Механизм повреждающего действия активных форм кислорода на клетки (пол, окисление белков и нуклеиновых кислот). Примеры реакций.
- •1. Строение пируватдегидрогеназного комплекса
- •2. Окислительное декарбоксилирование пирувата
- •3. Связь окислительного декарбоксилирования пирувата с цпэ
- •53. Цикл лимонной кислоты: последовательность реакций и характеристика ферментов. Роль цикла в метаболизме.
- •57. Аэробный гликолиз. Последовательность реакций до образования пирувата (аэробный гликолиз). Использование глюкозы для синтеза жиров. Энергетический эффект аэробного распада глюкозы.
- •1. Этапы аэробного гликолиза
- •2. Реакции аэробного гликолиза
- •1. Реакции анаэробного гликолиза
- •60. Гликоген, биологическое значение. Биосинтез и мобилизация гликогена. Регуляция синтеза и распада гликогена. Обмен гликогена в анте- и неонатальном периоде.
- •61. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, непереносимость фруктозы и дисахаридов, эссенциальная фруктоземия. Гликогенозы и агликогенозы.
- •62. Липиды. Общая характеристика. Биологическая роль. Классификация липидов. Высшие жирные кислоты, особенности строения. Полиеновые жирные кислоты. Триацилглицеролы.
- •65. Депонирование и мобилизация жиров в жировой ткани, физиологическая роль этих процессов. Роль инсулина, адреналина и глюкагона в регуляции метобализма жира.
- •67. Биосинтез жирных кислот. Основные стадии процесса. Регуляция обмена жирных кислот.
- •69. Холестерин. Пути поступления, использования и выведения из организма. Уровень холестерина в сыворотке крови. Биосинтез холестерина, его этапы. Регуляция синтеза.
- •74. Непрямое дезаминирование аминокислот. Схема процесса, субстраты, ферменты, кофакторы.
- •1. Синтез и биологическая роль серотонина
- •1. Окислительное дезаминирование
- •2. Непрямое дезаминирование (трансдезаминирование)
- •3. Неокислительное дезамитровате
- •1. Метаболизм феиилаланина
- •2. Особенности обмена тирозина в разных тканях
- •3. Заболевания, связанные с нарушением обмена фенилаланина и тирозина
- •1. Классификация гормонов по химическому строению
- •2. Классификация гормонов по биологическим функциям
- •3. Передача сигналов через рецепторы, сопряжённые с ионными каналами
- •1. Гормон роста, пролактин
- •2. Тиреотропин, лютеинизирующий гормони фолликулостимулирующий гормон
- •3. Группа гормонов, образующихсяиз проопиомеланокортина
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •2. Роль системы ренин-ангиотензин- альдостерон в регуляции водно-солевого обмена
- •3. Восстановление объёма крови при обезвоживании организма
- •4. Гиперальдостеронтм
- •1. Синтез и секреция птг
- •2. Роль паратгормона в регуляции обмена кальция и фосфатов
- •3. Гиперпаратиреоз
- •4. Гипопаратиреоз
- •1. Строение и синтез кальцитриола
- •2. Механизм действия кальцитриола
- •3. Рахит
- •2. Биологические функции инсулина
- •3. Механизм действия инсулина
- •1. Изменения метаболизма в печени в абсорбтивном периоде
- •2. Изменения метаболизма в адипоцитах
- •3. Изменение метаболизма в мышцах в абсорбтивном периоде
- •1. Изменения метаболизма в печени
- •2. Изменения метаболизма в жировой ткани
- •1. Инсулинзависимый сахарный диабет
- •2. Инсулинонезависимый сахарный диабет
- •1. Симптомы сахарного диабета
- •2. Острые осложнения сахарного диабета. Механизмы развития диабетической комы
- •3. Поздние осложнения сахарного диабета
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •2. Функционирование цитохрома р450
- •3. Свойства системы микросомального окисления
- •1. Причины, приводящие к увеличению количества ферментов в крови
- •2. Изоферменты
- •3. Энзимодиагностика при инфаркте миокарда
- •1. Простые белки
- •1. Безмиелиновое волокно
- •2. Миелиновое волокно
6. Лигазы (синтетазы)
Катализируют реакции присоединения друг к другу двух молекул с образованием ковалент-ной связи. Этот процесс сопряжён с разрывом фосфоэфирной связи в молекуле АТФ (или других нуклеозидтрифосфатов) или с разрывом макроэргических связей других соединений. В первом случае (при использовании энергии гидролиза АТФ) такие ферменты называют ли-газами, или синтетазами (см. схему Г).
В случае, когда источником энергии служит любое другое макроэргическое соединение (не АТФ), ферменты называют синтазами.
В. Систематическое название
В соответствии с классификацией каждый фермент получил систематическое название, однозначно характеризующее катализируемую им химическую реакцию. Например, D-глицеральдегид-3-фосфат: NAD-оксидоредуктаза (рабочее название - глицеральдегидфосфат дегидрогеназа). Из названия фермента следует, что субстратом этого фермента служит D-глицеральдегид-3-фосфат, тип катализируемой реакции - окислительно-восстановительная в присутствии кофермента NAD+.
В 1972 г. комиссией по номенклатуре биохимических соединений Международного союза теоретической и прикладной химии были предложены "Правила номенклатуры ферментов", имеющие кодовое четырёхзначное цифровое обозначение, где первая цифра обозначает класс фермента, вторая цифра (подкласс) уточняет преобразуемую группировку, третья (подподкласс) - уточняет дополнительных участников реакции (например, донора и акцептора) и четвёртая - порядковый номер фермента в данной подгруппе. Так, фермент малатдегидрогеназа имеет систематическое название L-малат: NAD-оксидоредуктаза и кодовый шифр 1.1.1.38. Шифр означает, что этот фермент относят к первому классу ферментов - оксидоредуктаз, окисляемая группа - гидроксильная группировка (1) в присутствии кофермента NAD+ (1) и порядковый номер фермента в этой подгруппе - 38. Кодовую номенклатуру ферментов в основном используют в научной литературе.
14. Строение ферментов. Каталитический и регуляторный центры. Взаимодействие ферментов с лигандами. Механизм действия ферментов. Формирование фермент-субстратного комплекса. Гипотеза «ключ-замок» и гипотеза индуцированного соответствия.
Все ферменты это белки с молекулярной массой от 15 000 до нескольких млн Да. По химическому строению различают простыеферменты (состоят только из АК) исложныеферменты (имеют небелковую часть или простетическую группу). Белковая часть носит название –апофермент, а небелковая, если она связана ковалентно с апоферментом, то называется кофермент, а если связь нековалентная (ионная, водородная) – кофактор. Функции простетической группы следующие: участие в акте катализа, осуществление контакта между ферментом и субстратом, стабилизация молекулы фермента в пространстве.
В
роли кофактора обычно выступают
неорганические вещества - ионы цинка,
меди, калия, магния, кальция, железа,
молибдена.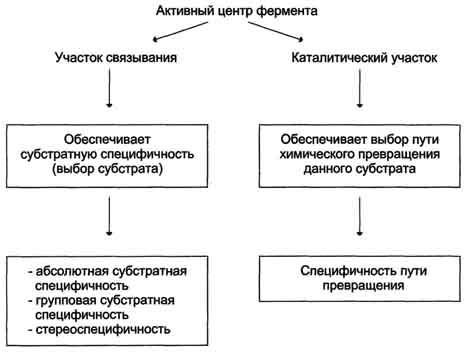
Коферменты можно рассматривать как составную часть молекулы фермента. Это органические вещества, среди которых различают: нуклеотиды (АТФ,УМФ, и пр), витамины или их производные (ТДФ– из тиамина (В1), ФМН– из рибофлавина (В2), коэнзим А– из пантотеновой кислоты (В3), НАД и пр) и тетрапиррольные коферменты – гемы.
В процессе катализа реакции в контакт с субстратом вступает не вся молекула фермента, а определенный ее участок, который называется активным центром. Эта зона молекулы не состоит из последовательности аминокислот, а формируется при скручивании белковой молекулы в третичную структуру. Отдельные участки аминокислот сближаются между собой, образуя определенную конфигурацию активного центра. Важная особенность строения активного центра - его поверхность комплементарна поверхности субстрата, т.е. остатки АК этой зоны фермента способны вступать в химическое взаимодействие с определенными группами субстрата. Можно представить, что активный центр фермента совпадает со структурой субстрата как ключ и замок.
В активном центре различают две зоны: центр связывания, ответственный за присоединение субстрата, и каталитический центр, отвечающий за химическое превращение субстрата. В состав каталитического центра большинства ферментов входят такие АК, как Сер, Цис, Гис, Тир, Лиз. Сложные ферменты в каталитическом центре имеют кофактор или кофермент.
Помимо активного центра ряд ферментов снабжен регуляторным (аллостерическим) центром. С этой зоной фермента взаимодействуют вещества, влияющие на его каталитическую активность.
Ферменты обладают высокой специфичностью, поэтому выдвинули гипотезу, согласно которой активный центр фермента комплементарен субстрату, т.е. соответствует ему как "ключ замку". После взаимодействия субстрата ("ключ") с активным центром ("замок") происходят химические превращения субстрата в продукт. Активный центр при этом рассматривался как стабильная, жёстко детерминированная структура.
В 1959 г. был предложен другой вариант гипотезы "ключ-замок", объясняющий события в активном центре фермента. По этой гипотезе активный центр является гибкой структурой по отношению к субстрату. Субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации, приводя к формированию фермент-субстратного комплекса, благоприятного для химических модификаций субстрата. При этом молекула субстрата также изменяет свою конформацию, что обеспечивает более высокую эффективность ферментативной реакции. Эта "гипотеза индуцированного соответствия" впоследствии получила экспериментальное подтверждение.
