
- •2 Аминокислоты, входящие в состав белков, их строение и свойства. Биологическая
- •1. Общие структурные особенности аминокислот, входящих в состав белков
- •2. Классификация аминокислот по химическому строению радикалов
- •3. Классификация аминокислот по растворимости их радикалов в воде
- •2.Характеристика пептидной связи
- •4. Вторичная структура белков. Связи стабилизирующие вторичную структуру.
- •1. Классификации шаперонов (ш)
- •2. Роль шаперонов в фолдинге белков
- •8 . Физико-химические свойства белков. Молекулярная масса, размеры и форма, растворимость, гидротация и ионизация. Денатурация, признаки и факторы ее вызывающие.
- •10. Принципы классификации белков. Классификация по составу и биологическим функциям, примеры представителей отдельных классов.
- •11. Иммуноглобулины, классы иммуноглобулинов, особенности доменного строения и
- •13. Классификация и номенклатура ферментов, примеры
- •1. Оксидоредукпшзы
- •2.Трансферты
- •3.Гидролазы
- •4. Лиазы
- •5. Изомеразы
- •6. Лигазы (синтетазы)
- •15. Кинетика ферментативных реакций. Зависимость скорости ферментативной реакции от температуры, рН среды, концентрации ферментов и субстрата. Уравнение Михаэлиса-Ментен, Кm.
- •16. Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр, в2 на примере трансаминаз и дегидрогеназ.
- •17. Ингибирование активности ферментов: обратимое (конкурентное и неконкурентное)
- •1. Конкурентное ингибирование
- •2. Неконкурентное ингибирование
- •19. Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования.
- •20. Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции протеолитической активности ферментов.
- •21. Изоферменты: происхождение, биологическое значение, примеры. Определение ферментов и изоферментного спектра плазмы крови с целью диагностики заболеваний.
- •22. Энзимопатии наследственные (фенилкетонурия) и приобретенные (цинга). Применение ферментов для лечения болезней.
- •23. Общая схема синтеза и распада пиримидиновых нуклеотидов. Регуляция. Оротоцидурия.
- •24. Общая схема синтеза и распада пуриновых нуклеотидов. Регуляция. Подагра.
- •27. Гибридизация нуклеиновых кислот. Денатурация и ренативация днк. Гибридизация (днк-днк, днк-рнк). Методы лабораторной диагностики, основанные на гибридизации нуклеиновых кислот.
- •29. Репликация. Принципы репликации днк. Стадии репликации. Инициация. Белки и ферменты, принимающие участие в формировании репликативной вилки.
- •30. Элонгация и терминация репликации. Ферменты. Асимметричный синтез днк. Фрагменты Оказаки. Роль днк-лигазы в формировании непрерывной и отстающей цепи.
- •31. Повреждения и репарация днк. Виды повреждений. Способы репарации. Дефекты репарационных систем и наследственные болезни.
- •32. Транскрипция. Характеристика компонентов системы синтеза рнк. Структура днк-зависимой рнк-полимеразы: роль субъединиц. Инициация процесса. Элонгация, терминация, транскрипция.
- •33. Первичный транскрипт и его процессинг. Рибозимы как пример каталитической активности нуклеиновых кислот. Биороль.
- •34. Генетический код и его свойства. Основные компоненты белоксинтезирующей системы: аминокислоты, аминоацил-т-рнк синтетазы т-рнк, рибосомы, источник энергии, белковые факторы, ферменты.
- •35. Сборка полипептидной цепи на рибосоме. Образование инициаторного комплекса. Элонгация: образование пептидной связи (реакция транспептидации). Транслокация. Транслоказа. Терминация.
- •1. Инициация
- •2. Элонгация
- •3. Терминация
- •36. Особенности синтеза и процессинга секретируемых белков (на примере коллагена и инсулина).
- •37. Биохимия питания. Основные компоненты пищи человека, их биороль, суточная потребность в них. Незаменимые компоненты пищи.
- •38. Белковое питание. Биологическая ценность белков. Азотистый баланс. Полноценность белкового питания, нормы белка в питании, белковая недостаточность.
- •39. Переваривание белков: протеазы жкт, их активация и специфичность, оптимум рН и результат действия. Образование и роль соляной кислоты в желудке. Защита клеток от действия протеаз.
- •40. Всасывание продуктов переваривания. Транспорт ак в клетки кишечника. Особенности транспорта ак в гепатоцитах. Y-глутамильный цикл. Нарушение переваривания и всасывания ак.
- •42. Минеральные вещества пищи, макро- и микроэлементы, биологическая роль. Региональные патологии, связанные с недостатком микроэлементов.
- •43. Биологические мембраны, строение, функции и общие свойства: жидкостность, поперечная ассиметрия, избирательная проницаемость.
- •1. Структура и свойства липидов мембран
- •2. Трансмембранная асимметрия липидов
- •3. Жидкостностъ мембран
- •4. Функции мембранных липидов
- •45. Механизм переноса веществ через мембраны: простая диффузия, пассивный симпорт и антипорт, активный транспорт, регулируемые каналы. Мембранные рецепторы.
- •1. Первично-активный транспорт
- •2. Вторично-активный транспорт
- •46. Эндергонические и экзергонические реакции живой клетки. Макроэргические соединения, определение, пример.
- •4. Сопряжение экзергонических и эндергонических процессов в организме
- •2. Цепь переноса электронов от nadh и fadh2 на кислород
- •50. Образование активных форм кислорода(синглетный кислород, пероксид водорода, гидроксильный радикал). Место образоваия, схемы реакций. Физиологическая роль афк.
- •51. Механизм повреждающего действия активных форм кислорода на клетки (пол, окисление белков и нуклеиновых кислот). Примеры реакций.
- •1. Строение пируватдегидрогеназного комплекса
- •2. Окислительное декарбоксилирование пирувата
- •3. Связь окислительного декарбоксилирования пирувата с цпэ
- •53. Цикл лимонной кислоты: последовательность реакций и характеристика ферментов. Роль цикла в метаболизме.
- •57. Аэробный гликолиз. Последовательность реакций до образования пирувата (аэробный гликолиз). Использование глюкозы для синтеза жиров. Энергетический эффект аэробного распада глюкозы.
- •1. Этапы аэробного гликолиза
- •2. Реакции аэробного гликолиза
- •1. Реакции анаэробного гликолиза
- •60. Гликоген, биологическое значение. Биосинтез и мобилизация гликогена. Регуляция синтеза и распада гликогена. Обмен гликогена в анте- и неонатальном периоде.
- •61. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, непереносимость фруктозы и дисахаридов, эссенциальная фруктоземия. Гликогенозы и агликогенозы.
- •62. Липиды. Общая характеристика. Биологическая роль. Классификация липидов. Высшие жирные кислоты, особенности строения. Полиеновые жирные кислоты. Триацилглицеролы.
- •65. Депонирование и мобилизация жиров в жировой ткани, физиологическая роль этих процессов. Роль инсулина, адреналина и глюкагона в регуляции метобализма жира.
- •67. Биосинтез жирных кислот. Основные стадии процесса. Регуляция обмена жирных кислот.
- •69. Холестерин. Пути поступления, использования и выведения из организма. Уровень холестерина в сыворотке крови. Биосинтез холестерина, его этапы. Регуляция синтеза.
- •74. Непрямое дезаминирование аминокислот. Схема процесса, субстраты, ферменты, кофакторы.
- •1. Синтез и биологическая роль серотонина
- •1. Окислительное дезаминирование
- •2. Непрямое дезаминирование (трансдезаминирование)
- •3. Неокислительное дезамитровате
- •1. Метаболизм феиилаланина
- •2. Особенности обмена тирозина в разных тканях
- •3. Заболевания, связанные с нарушением обмена фенилаланина и тирозина
- •1. Классификация гормонов по химическому строению
- •2. Классификация гормонов по биологическим функциям
- •3. Передача сигналов через рецепторы, сопряжённые с ионными каналами
- •1. Гормон роста, пролактин
- •2. Тиреотропин, лютеинизирующий гормони фолликулостимулирующий гормон
- •3. Группа гормонов, образующихсяиз проопиомеланокортина
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •2. Роль системы ренин-ангиотензин- альдостерон в регуляции водно-солевого обмена
- •3. Восстановление объёма крови при обезвоживании организма
- •4. Гиперальдостеронтм
- •1. Синтез и секреция птг
- •2. Роль паратгормона в регуляции обмена кальция и фосфатов
- •3. Гиперпаратиреоз
- •4. Гипопаратиреоз
- •1. Строение и синтез кальцитриола
- •2. Механизм действия кальцитриола
- •3. Рахит
- •2. Биологические функции инсулина
- •3. Механизм действия инсулина
- •1. Изменения метаболизма в печени в абсорбтивном периоде
- •2. Изменения метаболизма в адипоцитах
- •3. Изменение метаболизма в мышцах в абсорбтивном периоде
- •1. Изменения метаболизма в печени
- •2. Изменения метаболизма в жировой ткани
- •1. Инсулинзависимый сахарный диабет
- •2. Инсулинонезависимый сахарный диабет
- •1. Симптомы сахарного диабета
- •2. Острые осложнения сахарного диабета. Механизмы развития диабетической комы
- •3. Поздние осложнения сахарного диабета
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •2. Функционирование цитохрома р450
- •3. Свойства системы микросомального окисления
- •1. Причины, приводящие к увеличению количества ферментов в крови
- •2. Изоферменты
- •3. Энзимодиагностика при инфаркте миокарда
- •1. Простые белки
- •1. Безмиелиновое волокно
- •2. Миелиновое волокно
3. Свойства системы микросомального окисления
Важнейшие свойства ферментов микросомального окисления: широкая субстратная специфичность, которая позволяет обезвреживать самые разнообразные по строению вещества, и регуляция активности по механизму индукции.
Широкая субстратная специфичность. Изоформы Р450
К настоящему времени описано около 150 генов цитохрома Р450, кодирующих различные изоформы фермента. Каждая из изоформ Р450 имеет много субстратов. Этими субстратами могут быть как эндогенные липофильные вещества, модификация которых входит в путь нормального метаболизма этих соединений, так и гидрофобные ксенобиотики, в том числе лекарства. Определённые изоформы цитохрома
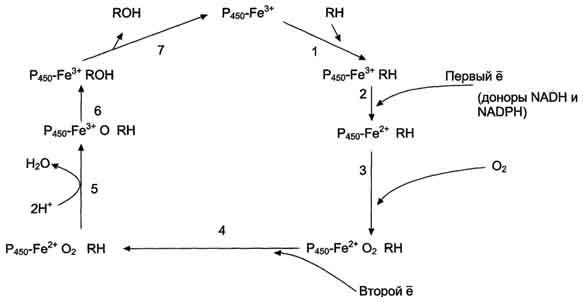
Рис. 12-3. Транспорт электронов при монооксигеназном окислении с участием Р450. Связывание (1) в активном центре цитохрома Р450 вещества RH активирует восстановление железа в теме - присоединяется первый электрон (2). Изменение валентности железа увеличивает сродство комплекса P450-Fe2+·RH к молекуле кислорода (3). Появление в центре связывания цитохрома Р450 молекулы О2 ускоряет присоединение второго электрона и образование комплекса P450-Fe2+O2--RH (4). На следующем этапе (5) Fe2+ окисляется, второй электрон присоединяется к молекуле кислорода P450-Fe3+O22-. Восстановленный атом кислорода (О2-) связывает 2 протона, и образуется 1 молекула воды. Второй атом кислорода идёт на построение ОН-группы (6). Модифицированное вещество R-OH отделяется от фермента (7).
Р450 участвуют в метаболизме низкомолекулярных соединений, таких как этанол и ацетон.
Регуляция активности микросомальной системы окисления
Регуляция активности микросомальной системы осуществляется на уровне транскрипции или посттранскрипционных изменений. Индукция синтеза позволяет увеличить количество ферментов в ответ на поступление или образование в организме веществ, выведение которых невозможно без участия системы микросомального окисления.
В настоящее время описано более 250 химических соединений, вызывающих индукцию микросомальных ферментов. К числу этих индукторов относят барбитураты, полициклические ароматические углеводороды, спирты, кетоны и некоторые стероиды. Несмотря на разнообразие химического строения, все индукторы имеют ряд общих признаков; их относят к числу липофильных соединений, и они служат субстратами для цитохрома Р450.
Б. Конъюгация - вторая фаза обезвреживание веществ
Вторая фаза обезвреживания веществ - реакции конъюгации, в ходе которых происходит присоединение к функциональным группам, образующимся на первом этапе, других молекул или групп эндогенного происхождения, увеличивающих гидрофильность и умеНbшающих токсичность ксенобиотиков (табл. 12-2).
93. Распад гема. Схема процесса, место протекания. Понятие «прямой» и «непрямой» билирубин. Диагностическое значение определения билирубина в крови и моче.
Первая
реакция катаболизма гема происходит
при участии NADPH-зависимого ферментативного
комплекса гемоксигеназы. Ферментная
сисгема локализована в мембране ЭР, в
области электронтранспортных цепей
микросомального окисления. Фермент
катализирует расщепление связи между
двумя пиррольными кольцами, содержащих
винильные остатки.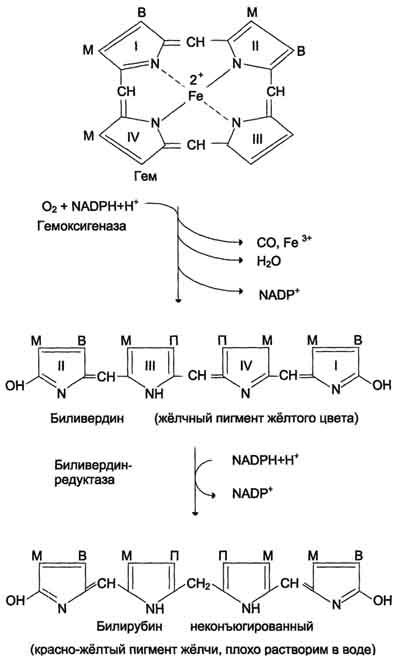
В ходе реакции образуются линейный тетрапир-рол - биливердин(пигмент жёлтого цвета) и монооксид углерода (СО), который получается из углерода метениловой группы. Гем индуцирует транскрипцию гена гемоксигеназы, абсолютно специфичной по отношению к тему.
Ионы железа, освободившиеся при распаде гема, могут быть использованы для синтеза новых молекул гемоглобина или для синтеза других железосодержащих белков. Биливердин восстанавливается до билирубина NADPH-зависимым ферментом биливердинредуктазой.
М - (-СН3) - метильная группа; В - (-СН=СН2) - винильная группа; П - (-CH2-CH2-COOH) - остаток пропионовои кислоты. В ходе реакции одна метильная группа превращается в окись углерода и, таким образом, раскрывается структура кольца. Образованный биливердин под действием биливердинредуктазы превращается в билирубин.
Билирубин плохо растворяется в воде, поэтому в печень транспортируется в виде комплекса с белками крови - альбуминами («непрямой» или неконьюгированный билирубин).
В печень билирубин переносится через мембрану гепатоцитов белками – лигандом и протеином Z. Эти белки обнаружены так же в клетках почек и кишечника.
В гладком ЭПР гепатоцитов к билирубину присоединяются две глюкуроновой кислоты, образуя билирубиндиглюкуронид («прямой», или коньюгированный билирубин). Этот коньюгат хорошо растворим в воде.
Донором глюкуроновой кислоты служит УДФ-глюкуронат. Реакция катализируется уридинфосфоглюкуронилтрансферазой.
Индукция синтеза УДФ-глюкуронилтрансферазы происходит под действием фенобарбитала.
Билирубин
– диглюкуронид активным транспортом
переносится с желчью в кишечник.
В кишечнике билирубинглюкуронид гидролизуется бактериальными ферментами β-глюкуронидазами. Освободившийся билирубин под действием кишечной микрофлоры восстанавливается в уробилиногены.
(прямой билирубин) Билирубин в сыворотке (плазме) крови определяется по методу Ван дер Берга (1916 год), основанным на диазореакции.
В норме содержание билирубина в плазме составляет 1.7 -17 мкмоль/л, 75% от него составляет «непрямой» билирубин.
«Прямой» билирубин называется так потому, что он прямо взаимодействует с диазореагентом, будучи хорошо растворимым в воде.
Не прямой билирубин гидрофобен, поэтому перед его измерением необходимо осадить альбумин, с которым он связан. Такой билирубин даёт цветную реакцию диазотирования только после осаждения альбумина.
Гипербилирубинемия – повышение содержания билирубина в крови.
При достижении концентрации билирубина в крови более 50 мкмоль/л он начинает диффундировать в ткани и окрашивает их в жёлтый цвет. Пожелтение тканей из-за отложения в них билирубина называется желтухой.
94. Нарушения обмена гема. Желтухи: гемолитическая, паренхиматозная, обтурационная, желтуха новорожденных. Причины развития синдрома, дифференциальная диагностика.
Нарушения синтеза гема – Порфирии
Порфирии – болезни, связанные с нарушением работы ферментов синтеза гема. Первичные порфирии обусловлены генетическими дефектами ферментов синтеза гема, вторичные связаны с нарушениями регуляции синтеза гема.
В зависимости от основной локализации патологического процесса различают печёночные и эритропоэтические наследственные порфирии. При этом эритропоэтические порфирии сопровождаются накоплением порфиринов в нормобластах и эритроцитах, а печёночные – в гепатоцитах.
Порфириногены не окрашены, но на свету они легко переходят в порфирины, которые проявляют красную флуоресценцию в ультрафиолетовых лучах.
В коже на солнце кислород реагирует с порфиринами и переходит в синглетное состояние. В этой форме он вызывает ПОЛ клеточных мембран и разрушение клеток, поэтому порфирии часто сопровождаются фотосенсибилизацией и изъязвлением открытых участков кожи.
Аминолевулинат и порфириногены являются нейротоксинами, что приводит к нейропсихическим расстройствам.
Приём лекарств – индукторов АЛК – синтетазы – сульфаниламидов, барбитуратов, диклофенака, вольтарена, стероидов, истогенов – может вызвать обострение порфирии.
В период полового созревания при повышении образования β-стероидов идёт индукция синтеза АЛК-синтетазы и проявляются симптомы порфирий.
Порфирии наблюдаются и при отравлении солями свинца, т.к. свинец ингибирует АЛК-дегидратазу и феррохелатазу.
Некоторые виды порфирий:
Острая перемежающая (острая интермитирующая). Начинается после наступления половойзрелости. Причиной является блокада превращения порфобилиногена в уропорфириноген III, дефект фермента уропорфириноген 1-синтетазы. При этом идёт накопление АЛК и порфобилиногена. Симптомы: моча на воздухе имеет вишнёвый цвет, острые боли в животе, нарушение сердечной деятельности, артериальная гипертензия. Поражены клетки печени, но поражение кожи отсутствует. Причиной этих симптомов является вегетативная нейропатия вследствие биохимического поражения нервной системы.
Острая эритропоэтическая порфирия. Начинается до 5 лет. Причиной является дисбаланс между работой промежуточных реакций образования уропорфирина I и III. Уропорфирин легко окисляется и даёт окрашенные продукты. Симптомы: поражение кожи, чувствительность к свету, свечение зубов в ультрафиолетовых лучах.
Тяжёлая кожная порфирия. Может начаться в любом возрасте, но, как правило, не ранее 35 лет. Причиной служит снижение активности печёночной уропорфириногендекарбоксилазы, болезнь печени.
Симптомы: Отсутствие неврологических нарушений, но на коже появляются язвы, везикулы, нарушение пигментации. Восприимчивость кожи к повреждению при малейшей травме. Повышено содержание уропорфирина и конропорфирина.
Желтухи
Гемолитическая (надпечёночная) желтуха обусловлена усилинным распадом эритроцитов, наблюдается избыток «непрямого» билирубина, увеличивается выделение стеркобилиногена и уробилиногена с мочой. «Непрямой» билирубин повышен до 103-171 мкмоль/л. Причины: основной причиной являются наследственные или приобретённые гемолитические анемии при сепсисе, лучевой болезни, дефиците глюкозо-6-фосфатдегидрогеназы эритроцитов, талласемиях, отравлении сульфаниламидами).
Обтурационная (механическая или подпечёночная) желтуха обусловлена закупоркой оттока желчи в кишечник, в крови повышается «прямой» и непрямой билирубин, уробилина и стеркобилина в моче нет, кал бесцветен. Билирубин придаёт моче оранжево-коричневый цвет. Причины: закупорка желчных протонов камней, опухоли, послеоперационное сужение общего желчного протока.
Паренхиматозная печёночная желтуха обусловлена поражением печени при острых вирусных инфекциях, хроническом и токсическом гепатите. Причины: поражение и некроз части печёночных клеток. Происходит задержка билирубина в печени, снижается перевод прямого билирубина из клеток в желчь. В поражённых гепатоцитах преобладают моноглюкурониды. В крови общий билирубин повышен, кал меньше окрашен, моча приобретает более интенсивную окраску.
Желтуха новорождённых (физиологическая) обусловлена усиленной скоростью распада эритроцитов и замедленное удаление печенью билирубина крови. Причина: недостаточность функций белков и ферментов печени, ответственных за поглощение, коньюгацию и секрецию пряиого билирубина. Новорождённым с физиологической желтухой вводят лекарственный препарат фенобарбитал (индуктор УДФ-глюкуронилтрансферазы). Осложнением физиологической желтухи может быть билирубиновая энцефалопатия.
Наследственные желтухи. Причина: генетические нарушения в структуре белков и ферментов, ответственных за транспорт (захват) «непрямого» билирубина в печень и его коньюгацию с глюкуроновой кислотой.
Первый тип наследственных желтух – полное отсутствие УДФ-глюкуронилтрансферазы (аутосомно-рецессивный тип). Введение фенобарбитала не приводит к снижению уровня билирубина.
Второй тип наследственных желтух – снижение (недостаточности) УДФ – глюкуронилтрансферазы. Повышен «непрямой» билирубин. Желтуха хорошо поддаётся лечению фенобарбиталом.
Желтухи, связанные с нарушением активного траспорта билирубинглюкуронидов из печени в желчь наследуется по аутосомно-доминантному типу. Проявляется гипербилирубинемией за счёт «прямого» билирубина и билирубинурией (в моче определяется «прямой» билирубин).
Семейная гипербилирубинемия новорождённых связана с наличием конкурентных ингибиторов коньюгации билирубина (эстрогенов, свободных жирных кислот, в материнском молоке). Это транзиторная гипербилирубинемия. Она исчезает при переводе ребёнка на грудное вскармливание.
Не поддающаяся лечению гипербилирубинемия приводит к развитию билирубиновой энцефалопатией и ранней смерти.
Дифференциальная диагностика желтух
Чаще встречаются сочетания разных типов желтух; при концентрации билирубина меньше 100 мкмоль/л при других нормальных результатах функции печени предполагают повышение «непрямого» билирубина. Параллельно проводят анализ мочи на отсутствие «прямого» билирубина; при недостаточной функции печени с мочой выделяется повышенное количество уробилиногенов (печёночная или гемолитическая желтуха); при поражении печени в моче присутствуют и уробилиногены, и «прямой» билирубин.
95. Метаболизм эндогенных и чужеродных токсических веществ. Основные этапы обезвреживания ксенобиотиков. Фаза конъюгации. Схемы реакций конъюгации с ФАФС и УДФ-глюкуроновой кислотой. Обезвреживание продуктов гнеения АК в кишечнике.
96. Гемоглобины человека, структура. Транспорт кислорода и диоксида углерода. Гемоглобин плода и его физиологическое значение.
Гемоглобины - родственные белки, находящиеся в эритроцитах человека и позвоночных животных. Эти белки выполняют 2 важные функции:
перенос О2 из лёгких к периферическим тканям;
участие в переносе СО2 и протонов из периферических тканей в лёгкие для последующего выведения из организма.
Кровь ежедневно должна переносить из лёгких в ткани около 600 л ,О2. Так как О2 плохо растворим в воде, то практически весь кислород в крови связан с гемоглобином эритроцитов.
От способности гемоглобина насыщаться О2 в лёгких и относительно легко отдавать его в
Рис. 1-30. Расположение гема в активном центре апомиоглобина и протомеров апогемоглобина.
капиллярах тканей зависят количество получаемого тканями О2 и интенсивность метаболизма. С другой стороны, О2 - сильный окислитель, избыток поступления О2 в ткани может привести к повреждению молекул и нарушению структуры и функций клеток. Поэтому важнейшая характеристика гемоглобина - его способность регулировать сродство к О2 в зависимости от тканевых условий.
Гемоглобины, так же как миоглобин, относят к гемопротеинам, но они имеют четвертичную структуру (состоят из 4 полипептидных цепей), благодаря которой возникает возможность регуляции их функций.
1. Гемоглобины человека
Гемоглобины взрослого человека
В эритроцитах взрослого человека гемоглобин составляет 90% от всех белков данной клетки.
Гемоглобин А - основной гемоглобин взрослого организма, составляет около 98% от общего количества гемоглобина, тетрамер, состоит из 2 полипептидных цепей ? и 2 ? (2?2?).
Гемоглобин A2 находится в организме взрослого человека в меньшей концентрации, на его долю приходится около 2% общего гемоглобина. Он состоит из 2 ?- и 2 ?-цепей.
Гемоглобин А1с - гемоглобин А, модифицированный ковалентным присоединением к нему глюкозы (так называемый гликозилированный гемоглобин).
Гемоглобины, синтезирующиеся в период внутриутробного развития плода:
Эмбриональный гемоглобин синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Представляет собой тетрамер 2?2?. Через 2 нед после формирования печени плода в ней начинает синтезироваться гемоглобин F, который к 6 мес замещает эмбриональный гемоглобин.
Гемоглобин F - фетальный гемоглобин, синтезируется в печени и костном мозге плода до периода его рождения. Имеет тетрамерную структуру, состоящую из 2 ?- и 2 ?-цепей. После рождения ребёнка постепенно замещается на гемоглобин А, который начинает синтезироваться в клетках костного мозга уже на 8-м месяце развития плода.
2. Строение гемоглобина А
Строение протомеров гемоглобина
Конформация отдельных протомеров гемоглобина удивительно напоминает конформацию миоглобина, несмотря на то, что в первичной структуре их полипептидных цепей идентичны только 24 аминокислотных остатка. Протомеры гемоглобина, так же как и апомиоглобин, состоят из 8 спиралей, свёрнутых в плотную глобулярную структуру, содержащую внутреннее гидрофобное ядро и "карман" для связывания гема. Соединение гема с глобином (белковой частью) аналогично таковому у миоглобина - гидрофобное окружение гема, за исключением 2 остатков Гис Е7 и Гис F8 (рис. 1-31). Однако тетрамерная структура гемоглобина представляет собой более сложный структурно-функциональный комплекс, чем миоглобин.
Роль гистидина E7 в функционировании миоглобина и гемоглобина
Гем имеет высокое сродство к оксиду углерода (СО). В водной среде свободный от белковой части гем связывается с СО в 25 000 раз сильнее, чем О2. Высокая степень сродства гема к СО по сравнению с О2 объясняется разным пространственным расположением комплексов Fe2+ гема с СО и О2 (рис. 1-31, А).
В комплексе Fe2+ гема с СО атомы Fe2+, углерода и кислорода расположены на одной прямой, а в комплексе Fe2+ гема с О2 атомы железа и кислорода расположены под углом, что отражает их оптимальное пространственное расположение.
В миоглобине и гемоглобине над Fe2+ в области присоединения О2 расположен Гис Е7, нарушающий оптимальное расположение СО в центре связывания белков и ослабляющий его взаимодействие с гемом. Напротив, тот же Гис Е7 создаёт оптимальные условия для связывания О2 (рис. 1-31, Б). В результате сродство гема к СО в белках всего в 200 раз превышает его сродство к О2.
Снижение сродства гемсодержащих белков к СО имеет важное биологическое значение. СО образуется в небольших количествах при катаболизме некоторых веществ, в частности

Рис. 1-31. Пространственное расположение СО и О2, связанных со свободным гемом (А) и гемом в составе гемоглобина или миоглобина (Б).
гема. Этот эндогенно образующийся СО блокирует около 1% гемсодержащих белков. Если бы сродство тема к СО не уменьшалось под влиянием белкового окружения, эндогенный оксид углерода мог бы вызывать серьёзные отравления.
Четвертичная структура гемоглобина
Четыре полипептидные цепи, соединённые вместе, образуют почти правильную форму шара, где каждая ?-цепь контактирует с двумя ?-цепями (рис. 1-32).
Так как в области контакта между ?1- и ?1-, а также между ?2- и ?2-цепями находится много гидрофобных радикалов, то между этими полипептидными цепями формируется сильное соединение за счёт возникновения в первую очередь гидрофобных, а также ионных и водородных связей. В результате образуются димеры ?1?1, и ?2?2. Между этими димерами в тетрамерной молекуле гемоглобина возникают в основном полярные (ионные и водородные) связи, поэтому при изменении рН среды в кислую или щелочную сторону в первую очередь разрушаются связи между димерами. Кроме того, димеры способны легко перемещаться относительно друг друга.
Так как поверхность протомеров неровная, полипептидные цепи в центральной области не могут плотно прилегать друг к другу, в результате в центре формируется "центральная полость", проходящая сквозь всю молекулу гемоглобина.
3. Связывание гемоглобина с О2 в лёгких и его диссоциация из комплекта в тканях
Основная функция гемоглобина - доставка О2 от лёгких к тканям. Олигомерная структура гемоглобина обеспечивает быстрое насыщение его кислородом в лёгких (образование оксигемоглобина - Нb(О2)4), возможность отщепления кислорода от гемоглобина в капиллярах тканей при относительно высоком парциальном давлении О2, а также возможность регуляции сродства гемоглобина к О2 в зависимости от потребностей тканей в кислороде.
Кооперативные изменения конформации протомеров
О2 связывается с протомерами гемоглобина через Fe2+ , который соединён с четырьмя атомами азота пиррольных колец тема и атомом азота
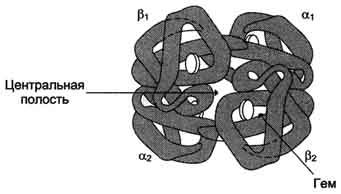
Рис. 1-32. Строение гемоглобина.
Гис F8 белковой части протомера. Связывание О2 с оставшейся свободной координационной связью Fe2+ происходит по другую сторону от плоскости гема в области Гис Е7 (аналогично тому, как это происходит у миоглобина). Гис Е7 не взаимодействует с О2, но обеспечивает оптимальные условия для его связывания (рис. 1-33).
В дезоксигемоглобине благодаря ковалентной связи с белковой частью атом Fe2+ выступает из плоскости гема в направлении Гис F8. Присоединение О2 к атому Fe2+ одного протомера вызывает его перемещение в плоскость гема, за ним перемещаются остаток Гис F8 и полипептидная цепь, в состав которой он входит. Так как протомер связан с остальными протомерами, а белки обладают конформационной лабильностью, происходит изменение конформации всего белка. Конформационные изменения, произошедшие в других протомерах, облегчают присоединение следующей молекулы О2, что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы О2. Четвёртая молекула О2 присоединяется к гемоглобину в 300 раз легче, чем первая молекула (рис. 1-34).
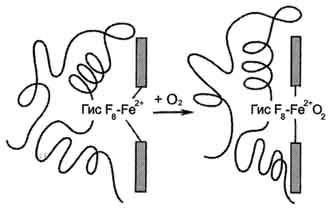
Рис. 1-33. Изменение прложения Fe2+ и белковой части гемоглобина при присоединении О2.
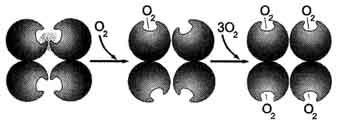
Рис. 1-34. Кооперативные изменения конформации протомеров гемоглобина при присоединении О2.
Изменение конформации (а следовательно и функциональных свойств) всех протомеров олигомерного белка при присоединении лиганда только к одному из них носит название кооперативных изменений конформации протомеров.
Аналогичным образом в тканях диссоциация каждой молекулы О2 изменяет конформацию всех протомеров и облегчает отщепление последующих молекул О2.
Кривые диссоциации О2 для миоглобина и гемоглобина
Кооперативность в работе протомеров гемоглобина можно наблюдать и на кривых диссоциации О2 для миоглобина и гемоглобина (рис. 1-35).
Отношение занятых О2 участков связывания белка к общему числу таких участков, способных к связыванию, называется степенью насыщения этих белков кислородом. Кривые диссоциации показывают, насколько насыщены данные белки О2 при различных значениях парциального давления кислорода.
Кривая диссоциации О2 для миоглобина имеет вид простой гиперболы. Это указывает на то, что миоглобин обратимо связывается с лигандом, и на это не оказывают влияние никакие посторонние факторы (схема ниже).
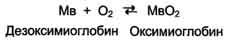

Рис. 1-35. Кривые диссоциации кислорода для миоглобина и гемоглобина в зависимости от парциального давления кислорода.
Процессы образования и распада оксимиоглобина находятся в равновесии, и это равновесие смещается влево или вправо в зависимости от того, добавляется или удаляется кислород из системы. Миоглобин связывает кислород, который в капиллярах тканей высвобождает гемоглобин, и сам миоглобин может освобождать О2 в ответ на возрастание потребностей в нём мышечной ткани и при интенсивном использовании О2 в результате физической нагрузки.
Миоглобин имеет очень высокое сродство к О2. Даже при парциальном давлении О2, равном 1-2 мм рт. ст., миоглобин остаётся связанным с О2 на 50%.
Кривая диссоциации О2 для гемоглобина. Из графика на рис. 1-35 видно, что гемоглобин имеет значительно более низкое сродство к О2; полунасыщение гемоглобина О2 наступает при более высоком давлении О2 (около 26 мм рт. ст.).
Кривая диссоциации для гемоглобина имеет сигмоидную форму (S-образную). Это указывает на то, что протомеры гемоглобина работают кооперативно: чем больше О2 отдают протомеры, тем легче идёт отщепление последующих молекул О2.
В капиллярах покоящихся мышц, где давление О2 составляет около 40 мм рт. ст., большая часть кислорода возвращается в составе оксигемоглобина обратно в лёгкие. При физической работе давление О2 в капиллярах мышц падает до 10-20 мм рт. ст. Именно в этой области (от 10 до 40 мм рт. ст.) располагается "крутая часть" S-образной кривой, где в наибольшей степени проявляется свойство кооперативной работы протомеров.
Следовательно, благодаря уникальной структуре каждый из рассмотренных белков приспособлен выполнять свою функцию: миоглобин - присоединять О2, высвобождаемый гемоглобином, накапливать в клетке и отдавать в случае крайней необходимости; гемоглобин - присоединять О2 в лёгких, где его насыщение доходит до 100%, и отдавать О2 в капиллярах тканей в зависимости от изменения в них давления О2
4. Перенос Н+ и С02 из тканей в лёгкие с помощью гемоглобина. Эффект Бора
Окисление органических веществ с целью получения энергии происходит в митохондриях клеток с использованием О2, доставляемого гемоглобином из лёгких. В результате окисления веществ образуются конечные продукты распада - СО2 и Н2О, количество которых пропорционально интенсивности процессов окисления. СО2, образовавшийся в тканях, транспортируется в эритроциты. Там под действием фермента карбангидразы происходит увеличение скорости образования Н2СО3. Слабая угольная кислота может диссоциировать на Н+и НСО3-
СО2 + Н2О - H2CO 3 - H+ + HCO3-.
Равновесие реакции в эритроцитах, находящихся в капиллярах тканей, смещается вправо, так как образующиеся в результате диссоциации угольной кислоты протоны могут присоединяться к специфическим участкам молекулы гемоглобина: к радикалам Гис146 двух ?-цепей, радикалам Гис122 и концевым ?-аминогруппам двух ?-цепей. Все эти 6 участков при переходе гемоглобина от окси- к дезоксиформе приобретают большее сродство к Н+ в результате локального изменения аминокислотного окружения вокруг этих участков (приближения к ним отрицательно заряженных карбоксильных групп аминокислот).
Присоединение 3 пар протонов к гемоглобину уменьшает его сродство к О2 и усиливает транспорт О2 в ткани, нуждающиеся в нём (рис. 1-36, А). Увеличение освобождения О2 гемоглобином в зависимости от концентрации Н+ называют эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект).
В капиллярах лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина и удалению 6 протонов. Реакция СО2 + Н2О - Н2СО3 - Н+ + НСО3- сдвигается влево и образующийся СО2 выделяется в альвеолярное пространство и удаляется с выдыхаемым воздухом (рис. 1-36, Б).
Следовательно, молекула гемоглобина в ходе эволюции приобрела способность воспринимать и реагировать на информацию, получаемую из окружающей среды. Увеличение концентрации протонов в среде снижает сродство О2 к гемоглобину и усиливает его транспорт в ткани (рис. 1-37).
Большая часть СО2 транспортируется кровью в виде бикарбоната НСО3-. Небольшое количество
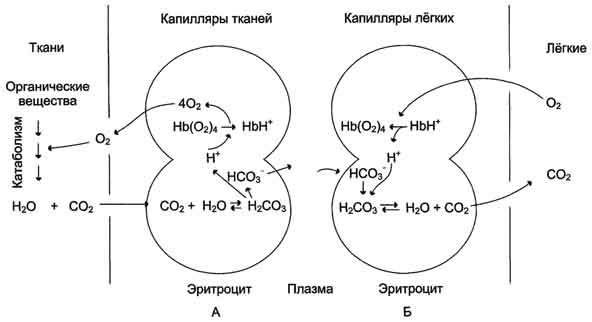
Рис. 1-36. Перенос Н+ и СО2 с кровью. Эффект Бора. А - влияние концентрации СО2 и Н+ на высвобождение О2 из комплекса с гемоглобином в тканях (эффект Бора); Б - оксигенирование дезоксигемоглобина в лёгких, образование и выделение СО2.
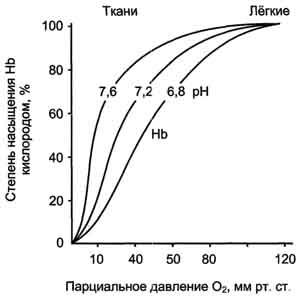
Рис. 1-37. Влияние рН на кривую диссоциации О2 для гемоглобина.
СО2 (около 15-20%) может переноситься в лёгкие, обратимо присоединяясь к неионизированным концевым ?-аминогруппам. R-NH2+ СО2 = R-NH-COO + Н+, в результате образуется карбогемоглобин, где R - полипептидная цепь гемоглобина. Присоединение СО2 к гемоглобину также снижает его сродство к О2.
5. 2,3-Бифосфоглицерат - аллостертеский регулятор сродства гемоглобина к О2
2,3-Бифосфоглицерат (БФГ) - вещество, синтезируемое в эритроцитах из промежуточного продукта окисления глюкозы 1,3-бифосфоглицерата.
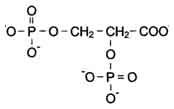
2,3-Бифосфоглицерат
Регуляция с помощью 2,3-бифосфоглицерата сродства гемоглобина к О2
В нормальньж условиях 2,3-бифосфоглицерат присутствует в эритроцитах примерно в той же концентрации, что и гемоглобин. БФГ, присоединяясь к гемоглобину, также может менять его сродство к О2.
В центре тетрамерной молекулы гемоглобина есть полость, образованная аминокислотными остатками всех четырёх протомеров.
Центральная полость - место присоединения БФГ.
Размеры центральной полости могут меняться: отщепление О2 от оксигемоглобина вызывает его конформационные изменения, которые способствуют образованию дополнительных ионных связей между димерами ?1?1 и ?2?2. В результате пространственная структура дезоксигемоглобина становится более жёсткой, напряжённой, а центральная полость расширяется.
Поверхность полости ограничена остатками аминокислот, в числе которых имеются положительно заряженные радикалы Лиз82, Гис143 ?-цепей и положительно заряженные ?-аминогруппы N-концевого валина ?-цепей. В расширенную полость дезоксигемоглобина БФГ, имеющий сильный отрицательный заряд, присоединяется с помощью ионных связей, образующихся с положительно заряженными функциональными группами двух ?-цепей гемоглобина. Присоединение БФГ ещё сильнее стабилизирует жёсткую структуру дезоксигемоглобина и снижает сродство белка к О2 (рис. 1-38).
Присоединение БФГ к дезоксигемоглобину происходит в участке, ином по сравнению с ге-мом, где происходит связывание О2. Такой лиганд называется "аллостерический", а центр, где связывается аллостерический лиганд, - "аллостерический центр" (от греч. "аллос" - другой, иной, "стерос" - пространственный).
В лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина. Разрыв

Рис. 1-38. Взаимодействие 2,3-бифосфоглицерата с аминокислотными остатками центральной полости дезоксигемоглобина.
ионных связей между димерами ?1?1 и ?2?2 приводит к "расслаблению" белковой молекулы, уменьшению центральной полости и вытеснению БФГ.
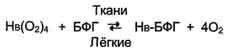
Изменение концентрации БФГ как механизм адаптации организма к гипоксии. Концентрация БФГ в эритроцитах людей, живущих в определённых климатических условиях, - величина постоянная. Однако в период адаптации к высокогорью, когда человек поднимается на высоту более 4000 м над уровнем моря, концентрация БФГ уже через 2 дня возрастает почти в 2 раза (от 4,5 до 7,0 мМ). Это снижает сродство гемоглобина к О2 и увеличивает количестве О2, транспортируемого в ткани (рис. 1-39).
Такую же адаптацию наблюдают у больных с заболеваниями лёгких, при которых развивается общая гипоксия тканей. Так, у больных с тяжёлой обструктивной эмфиземой лёгких парциальное давление в них снижается от 100 до 50 мм рт. ст. Но при этом в эритроцитах усиливается выработка БФГ, и его концентрация повышается с 4,5 до 7,0 мМ, что существенно увеличивает доставку О2 в ткани.

Рис. 1-39. Влияние различных концентраций 2,3-бифосфоглицерата на сродство гемоглобина к О2.
Клиническое значение концентрации БФГ в консервированной крови
В крови, консервированной в некоторых средах, например цитратдекстрозной, за 10 дней концентрация БФГ снижается с 4,5 до 0,5 мМ. Гемоглобин такой крови имеет очень высокое сродство к О2. Если кровь со сниженной концентрацией БФГ переливать тяжелобольным, возникает опасность развития гипоксии тканей. Введённые с кровью эритроциты за 24 ч могут восстановить лишь половину нормальной концентрации БФГ. Добавлением в кровь БФГ нельзя восстановить нормальную концентрацию его в эритроцитах, так как, имея высокий отрицательный заряд, БФГ не может проникать через мембраны эритроцитов. Поэтому в настоящее время в кровь добавляют вещества, способные проникать через мембрану эритроцитов и поддерживать в них нормальную концентрацию БФГ.
6. Регуляторные свойства олигомерного белка гемоглобина
Таким образом, олигомерный белок гемоглобин, в отличие от мономерного родственного белка миоглобина, способен присоединять к специфическим участкам 4 различных лиган-да: О2, Н+, СО2 и БФГ. Все эти лиганды присоединяются к пространственно разобщённым участкам, но конформационные изменения белка в месте присоединения одного лиганда передаются на весь олигомерный белок и изменяют сродство к нему других лигандов. Так, количество поступающего в ткани О2 зависит не только от парциального давления О2, но и концентрации аллостерических лигандов, что увеличивает возможность регуляции функций гемоглобина.
Как мы уже рассматривали выше, в капиллярах работающей мышцы увеличение концентрации СО2 и Н+ уменьшает сродство гемоглобина к О2 и увеличивает отдачу его в ткани. При длительной гипоксии усиливается синтез 2,3-БФГ в эритроцитах, что также снижает сродство гемоглобина к О2 и при том же парциальном давлении О2 увеличивает его транспорт в ткани.
Следовательно, благодаря воздействию регуляторных лигандов олигомерные белки способны приспосабливать свою конформацию и фунцию к изменениям, происходящим в окружающей среде.
7. Особенности строения и функционирования гемоглобина плода
Фетальный гемоглобин (HbF) заменяет эмбриональный гемоглобин, начиная синтезироваться в печени через 2 нед после её формирования у плода. С 6 мес развития плода до его рождения это основной гемоглобин эритроцитов. После рождения ребёнка он интенсивно начинает замещаться на гемоглобин А.
В физиологических условиях HbF имеет более высокое сродство к О2, чем НbА, что создаёт оптимальные условия для транспорта О2 из крови матери в кровь плода. Это свойство HbF обусловлено тем, что он слабее, чем НЬА связывается с 2,3-БФГ. Физиологические особенности HbF связаны с особенностями его строения: вместо ?-глобиновых цепей в НЬА, он содержит две ?-цепи (р-подобные). Связывание 2,3-БФГ с НЬА происходит при участии положительно заряженных радикалов аминокислот двух ?-цепей, некоторые из которых отсутствуют в первичной структуре ?-цепей. В среде, лишённой 2,3-БФГ, НbА и HbF проявляют одинаковое высокое сродство к О2.
Гемоглобинопатии
Серповидноклеточная анемия - тяжёлое наследственное заболевание, обусловленное точечной мутацией гена, кодирующего структуру β-цепи гемоглобина (см. раздел 4). В результате в эритроцитах больных присутствует HbS, β-цепи которого в шестом положении вместо гидрофильной глутаминовой кислоты содержат гидрофобную аминокислоту валин. Появление гидрофобной аминокислоты недалеко от начала молекулы способствует возникновению нового центра связывания, поэтому при низком парциальном давлении кислорода тетрамеры дезокси-HbS ассоциируют, образуя длинные микротрубчатые образования, которые полимеризуются внутри эритроцитов. Полимеризация приводит к нарушению структуры эритроцитов, они приобретают серповидную форму и легко разрушаются. При этом заболевании отмечают анемию, прогрессирующую слабость, отставание в развитии и желтуху.
Носители гена серповидноклеточной анемии чаще всего встречаются среди африканского населения, так как они приобретают некоторое преимущество при заболевании малярией, часто встречающейся в странах с тропическим климатом. Причина сохранения гена серповидноклеточной анемии в популяции связана с тем, что в эритроцитах гетерозигот хуже развивается малярийный плазмодий, часть жизненного цикла которого проходит в эритроцитах человека. В связи с этим гетерозиготные носители дефектного

Рис. 14-5. Схема образования телец Хайнца-агрегация гемоглобина. В норме супероксиддисмутаза катализирует образование пероксида водорода, который под действием глутатионпероксидазы превращается в Н2О. При недостаточной активности ферментов обезвреживания активных форм кислорода между протомерами метгемоглобина образуются дисульфидные связи, и они агрегируют.
663
гена выживали при эпидемиях малярии, однако четверть их потомства погибала от серповиднок-леточной анемии.
Талассемии - наследственные заболевания, обусловленные отсутствием или снижением скорости синтеза α- или β-цепей гемоглобина. В результате несбалансированного образования глобиновых цепей образуются тетрамеры гемоглобина, состоящие из одинаковых протомеров. Это приводит к нарушению основной функции гемоглобина - транспорту кислорода к тканям. Нарушение эритропоэза и ускоренный гемолиз эритроцитов и клеток-предшественников при талассемиях приводит к анемии.
При β-талассемии не синтезируются β-цепи гемоглобина. Это вызывает образование нестабильных тетрамеров, содержащих только α-цепи. При этом заболевании в костном мозге из-за преципитации нестабильных α-цепей усиливается разрушение эритробластов, а ускорение разрушения эритроцитов в циркулирующей крови приводит к внутрисосудистому гемолизу. Как известно, для образования фетального гемоглобина р-цепи не требуются (см. раздел 4), поэтому клинически β-талассемия не проявляется до рождения, после чего происходит переключение синтеза HbF на НBА.
В случае α-талассемии недостаток образования α-глобиновых цепей приводит к нарушению образования HbF у плода. Избыточные γ-цепи образуют тетрамеры, называемые гемоглобином Барта. Этот гемоглобин при физиологических условиях имеет повышенное сродство к кислороду и не проявляет кооперативных взаимодействий между протомерами. В результате гемоглобин Барта не обеспечивает развивающийся плод необходимым количеством кислорода, что приводит к тяжёлой гипоксии. При α-талассемии отмечают высокий процент внутриутробной гибели плода. Выжившие новорождённые при переключении с γ- на β-ген синтезируют β-тетрамеры или НBН, который, подобно гемоглобину Барта, имеет слишком высокое сродство к кислороду, менее стабилен, чем НBА и быстро разрушается. Это ведёт к развитию у больных тканевой гипоксии и к смерти вскоре после рождения.
Наследственный сфероцитоз. Причиной этой патологии чаще всего является дефект белков цитоскелета эритроцитов - спектрина или ан-кирина, которые обеспечивают поддержание двояковогнутой формы клетки и эластичности мембраны. Эритроциты приобретают шарообразную форму, что приводит к уменьшению площади их поверхности и снижению скорости газообмена. Потеря эластичности клеточной мембраны приводит к повышению хрупкости и травматичности клеток и, как следствие, к ускорению их разрушения в сосудистом русле и селезёнке. Заболевание сопровождается анемией и желтухой. Удаление селезёнки (спленэктомия) при наследственном сфероцитозе улучшает состояние больных, так как предотвращает разрушение сфероцитов в селезёнке.
Мегалобластная (макроцитарная) анемия развивается при дефиците фолиевой кислоты или витамина В12.
Фолиевая кислота в виде кофермента (Н4-фолата) участвует в синтезе нуклеотидов. Недостаток фолиевой кислоты приводит к снижению скорости синтеза ДНК в быстроделящихся клетках, и в первую очередь в предшественниках эритроцитов. Клетки дольше пребывают в интерфазе, синтезируя гемоглобин, и становятся крупнее. Кроме того, из-за недостатка нуклеотидов они реже делятся, и количество эритроцитов снижается, а крупные мегалобласты быстрее разрушаются. Всё это в конечном итоге приводит к развитию анемии.
Аналогичная симптоматика развивается при недостатке в организме витамина В12. Этот витамин участвует в переносе метальной группы с N5-метил-Н4-фолата на гомоцистеин с образованием метионина и Н4-фолата (см. раздел 10). Недостаточность витамина В12 приводит к накоплению N5-метил-Н4-фолата в клетках. Дефицит Н4-фолата приводит к нарушению деления клеток и развитию анемии.
97. Биосинтез гема. Схема процесса, химизм первых двух реакций, место протекания. Регуляция активности ферментов АЛК-синтазы и АЛК-дегидратазы. Источники железа для синтеза гема, всасывание железа, транспорт в крови, депонирование.
Гемоглобин – это сложный белок, простетической группой которого является гем. Основная роль гемоглобина – перенос кислорода и углекислого газа.
Гем – комплекс железа (Fe+2) c протопорфирином.
Биосинтез
гема
Наиболее активно гем синтезируется в костном мозге и печени.
В костном мозге гем синтезируется для образования гемоглобина в ретикулоцитах, в печени – гем нужен для синтеза цитохрома P450.
Предшественниками синтеза гема являются глицин и сукцинил-КоА, поэтому путь синтеза гема называется глициносукцинатный цикл.
Первые две реакции приводят к образованию порфобилиногена. Далее идёт образование линейных тетрапирролов, которые завершается синтезом протопорфирина IX. Протопорфирин IX присоединяет Fe2+ с помощью фермента – феррохелатазы (гем-синтезы) и образуется гем.
Регуляция
синтеза гема 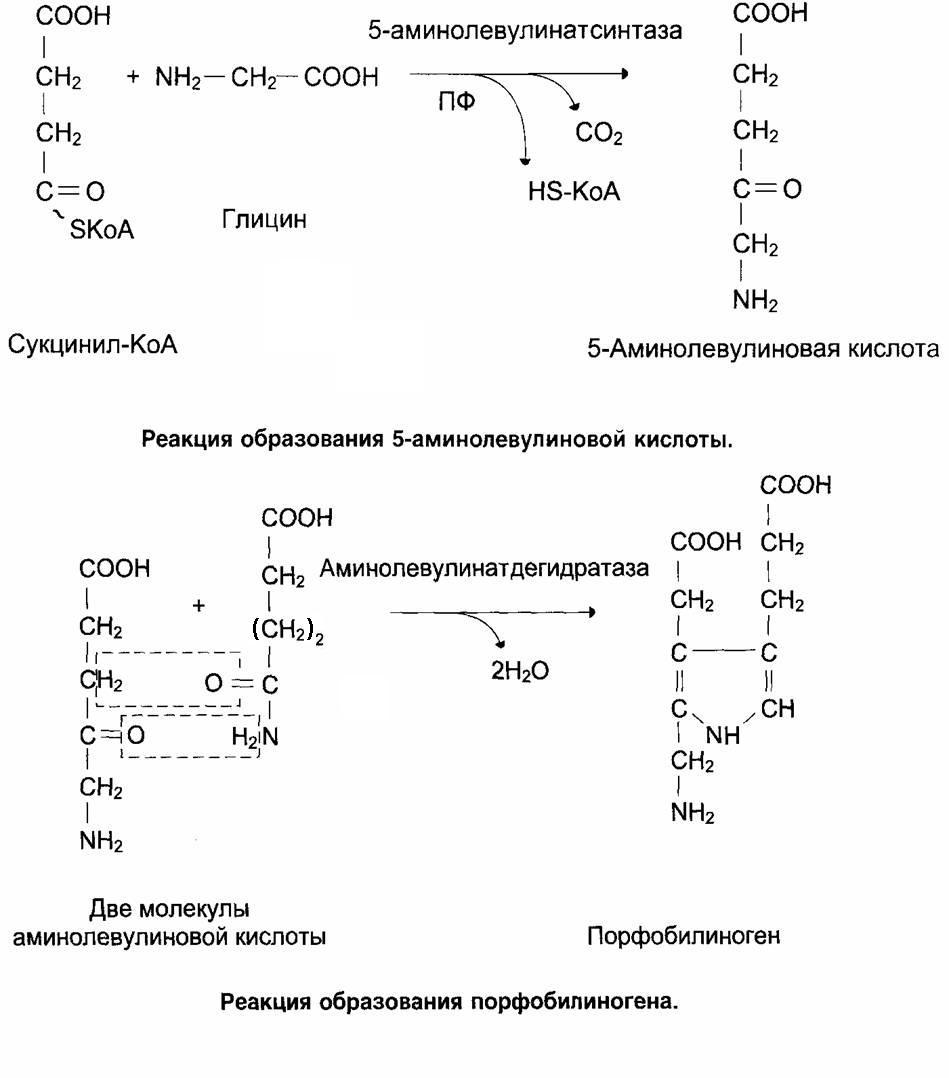
Регуляторными ферментами являются АЛК (аминолевулинатсинтетаза) и аминолевулинатдегидрогеназа.
АЛК - синтаза является главным регуляторным ферментом, коферментом которого служит ПФ.
Аллостерическими ингибиторами АЛК-синтетазы служит гем и гемоглобин.
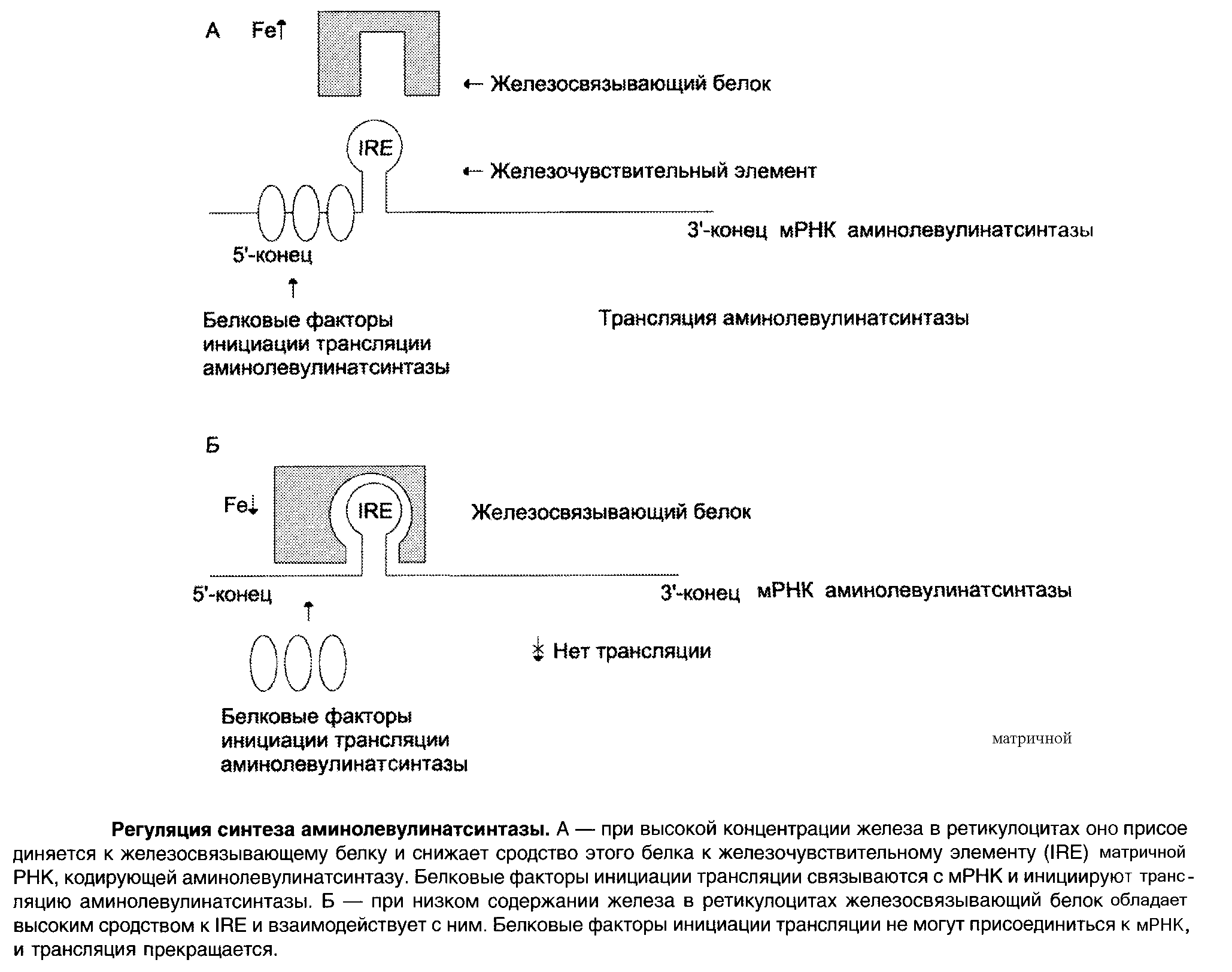
На уровне трансляции АЛК-синтазы регуляция осуществляется концентрацией железа.
В точке инициации мРНК АЛК-синтазы имеется шпилечная петля, которая называется железочувствительный элемент (IRE).
Регуляторный железосвязывающий белок при высокой концентрации железа связывается с железом и вызывает снижение сродства этого белка к IRE – элементу мРНК АЛК-синтетазы и продолжение трансляции.
При низких концентрациях железа увеличивается сродство железосвязывающего белка к IRE-элементу мРНК АЛК-синтетазы и трансляция аминолевупинатсинтетазы тормозится.
Недостаток ПФ и лекарства – аналоги ПФ снижают активность АЛК-синтетазы.
Стероиды, барбитураты, сульфаниламиды, эстрогены – индукторы синтеза АЛК.
Нарушения
синтеза гема – Порфирии 
Порфирии – болезни, связанные с нарушением работы ферментов синтеза гема. Первичные порфирии обусловлены генетическими дефектами ферментов синтеза гема, вторичные связаны с нарушениями регуляции синтеза гема.
В зависимости от основной локализации патологического процесса различают печёночные и эритропоэтические наследственные порфирии. При этом эритропоэтические порфирии сопровождаются накоплением порфиринов в нормобластах и эритроцитах, а печёночные – в гепатоцитах.
Порфириногены не окрашены, но на свету они легко переходят в порфирины, которые проявляют красную флуоресценцию в ультрафиолетовых лучах.
В коже на солнце кислород реагирует с порфиринами и переходит в синглетное состояние. В этой форме он вызывает ПОЛ клеточных мембран и разрушение клеток, поэтому порфирии часто сопровождаются фотосенсибилизацией и изъязвлением открытых участков кожи.
Аминолевулинат и порфириногены являются нейротоксинами, что приводит к нейропсихическим расстройствам.
Приём лекарств – индукторов АЛК – синтетазы – сульфаниламидов, барбитуратов, диклофенака, вольтарена, стероидов, истогенов – может вызвать обострение порфирии.
В период полового созревания при повышении образования β-стероидов идёт индукция синтеза АЛК-синтетазы и проявляются симптомы порфирий.
Порфирии наблюдаются и при отравлении солями свинца, т.к. свинец ингибирует АЛК-дегидратазу и феррохелатазу.
Обмен железа
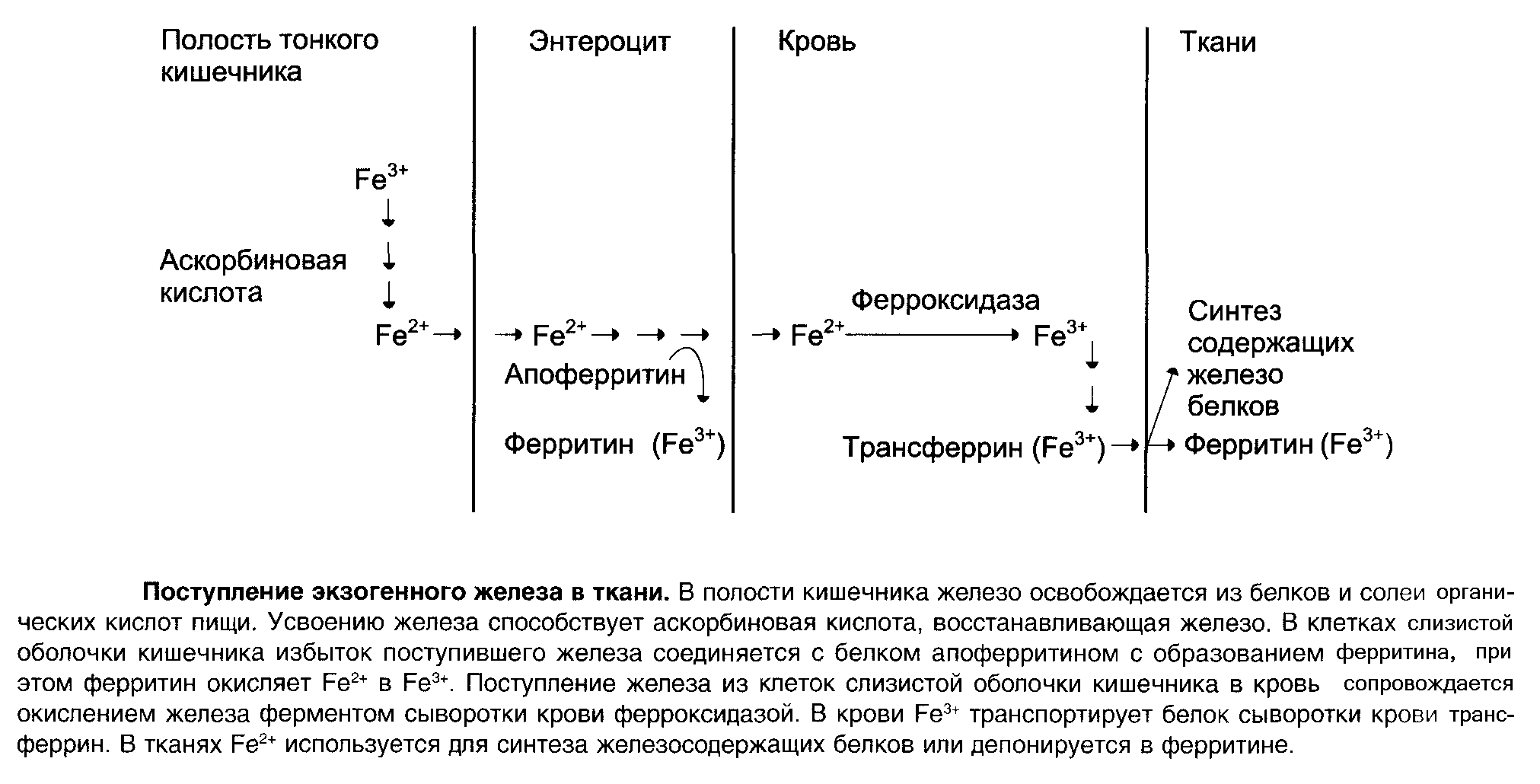
Источником железа для синтеза гема служат пищевые продукты и железо, освобождающееся при распаде эритроцитов.
В гем-содержащих белках железо находится в составе гема.
В негемовых железосодержащих белках железо непосредственно связывается с белком. К таким белкам относят трансферрин, ферритин, рибонуклеотидредуктазу, ксантиноксидазу и др.
В организме взрослого человека содержится 3-4 г. железа.
В пище железо находится в окислённом состоянии (Fe+3). При кислом значении pH желудка железо выделяется из солей органических кислот.
Аскорбиновая кислота (Витамин С), содержащаяся в пище, восстанавливает железо и улучшает его всасывание и в клетки слизистой оболочки кишечника поступает железо в виде Fe+2.
Апоферритин в энтероцитах связывает железо и превращается в ферритин – запасную форму железа.
Железо по крови транспортируется трансферрином.
Трансферрин – гликопротеин, который синтезируется в печени и связывает только окисленное железо (Fe+3).
Поступающее в кровь железо окисляется ферментом феррооксидазой (церулоплазмином). Этом фермент содержит медь.
Трансферрин может соединиться с одним или двумя ионами Fe+3 одновременно с анионом , образуя комплекс трансферрин – 2 (Fe+3 - ).
Трансферрин взаимодействует со специфическими рецепторами клеток. В результате в цитозоле клетки образуется комплекс Ca+2 – кальмодулин – ПКС, который фосфорилирует рецептор трансферрина и вызывает образование эндосомы.
В эндосоме создаётся кислая среда при действии АТФ – зависимого протонного насоса. При этом железо освобождается из трансферрина.
Ферритин – олигомерный белок, состоит из 24 протолиров и служит для запасания железа в клетке. В разных тканях существуют его изоформы.
Ферритин имеет полость, внутри которой может содержаться до 4500 ионов Fe+3.
Fe+2 окисляют в Fe+3 тяжёлые цепи ферритина. Комплекс железа в виде гидрофосфата хранится внутри сферы, образованной белковой частью молекулы.
Наибольшая часть ферритина содержится в печени, селезёнке и костном мозге.
98. Белки сыворотки крови, биологическая роль основных фракций белков, значение их определения для диагностики заболевания. Ферменты плазмы крови, энзимодиагностика. Количественное определение активности аминотрансфераз (АЛТ, АСТ).
В плазме крови содержится 7% всех белков организма при концентрации 60 - 80 г/л. Белки плазмы крови выполняют множество функций. Одна из них заключается в поддержании осмотического давления, так как белки связывают воду и удерживают её в кровеносном русле.
Белки плазмы образуют важнейшую буферную систему крови и поддерживают рН крови в пределах 7,37 - 7,43.
Альбумин, транстиретин, транскортин, трансферрин и некоторые другие белки (табл. 14-2) вьшолняют транспортную функцию.
Белки плазмы определяют вязкость крови и, следовательно, играют важную роль в гемодинамике кровеносной системы.
682
Белки плазмы крови являются резервом аминокислот для организма.
Иммуноглобулины, белки свёртывающей системы крови, α1-антитрипсин и белки системы комплемента осуществляют защитную функцию.
Методом электрофореза на ацетилцеллюлозе или геле агарозы белки плазмы крови можно разделить на альбумины (55-65%), α1-глобулины (2- 4%), α2 -глобулины (6-12%), β-глобулины (8-12%) и γ-глобулины (12-22%) (рис. 14-19).
Применение других сред для электрофоретического разделения белков позволяет обнаружить большее количество фракций. Например, при электрофорезе в полиакриламидном или крахмальном гелях в плазме крови выделяют 16-17 белковых фракций. Метод иммуноэлектрофореза, сочетающий электрофоретический и иммунологический способы анализа, позволяет разделить белки плазмы крови более чем на 30 фракций.
Большинство сывороточных белков синтезируется в печени, однако некоторые образуются и в других тканях. Например, γ-глобулины синтезируются В-лимфоцитами (см. раздел 4), пептидные гормоны в основном секретируют клетки эндокринных желёз, а пептидный гормон эритропоэтин - клетки почки.
Для многих белков плазмы, например альбумина, α1-антитрипсина, гаптоглобина, транс-феррина, церулоплазмина, α2-макроглобулина и иммуноглобулинов, характерен полиморфизм (см. раздел 4).
Почти все белки плазмы, за исключением альбумина, являются гликопротеинами. Олигосахариды присоединяются к белкам, образуя гликозидные связи с гидроксильной группой серина или треонина, или взаимодействуя с карбоксильной группой аспарагина. Концевой остаток олигосахаридов в большинстве случаев представляет собой N-ацетилнейраминовую кислоту, соединённую с галактозой. Фермент эндотелия сосудов нейраминидаза гидролизует связь между ними, и галактоза становится доступной для специфических рецепторов гепатоцитов. Путём эвддцитоза "состарившиеся" белки поступают в клетки печени, где разрушаются. Т1/2 белков плазмы крови составляет от нескольких часов до нескольких недель.
При ряде заболеваний происходит изменение соотношения распределения белковых фракций при электрофорезе по сравнению с нормой (рис. 14-20).
Такие изменения называют диспротеинемиями, однако их интерпретация часто имеет относительную диагностическую ценность. Например, характерное для нефротического синдрома снижение альбуминов, α1- и γ-глобулинов и увеличение α2- и β-глобулинов отмечают и при некоторых других заболеваниях, сопровождающихся потерей белков. При снижении гуморального иммунитета уменьшение фракции γ-глобулинов свидетельствует об уменьшении содержания основного компонента иммуноглобулинов - IgG, но не отражает динамику изменений IgA и IgM.
Содержание некоторых белков в плазме крови может резко увеличиваться при острых воспалительных процессах и некоторых других патологических состояниях (травмы, ожоги, инфаркт миокарда). Такие белки называют белками острой фазы, так как они принимают участие в развитии воспалительной реакции организма. Основной индуктор синтеза большинства белков острой фазы в гепатоцитах - полипептид интерлейкин-1, освобождающийся из мононуклеарных фагоцитов. К белкам острой фазы относят С-реактивный белок, называемый так, потому что он взаимодействует с С-полисахари-дом пневмококков, α1-антитрипсин, гаптоглобин, кислый гликопротеин, фибриноген. Известно, что С-реактивный белок может стимулировать

Рис. 14-19. Электрофореграмма (А) и денситограмма (Б) белков сыворотки крови.
683

Рис. 14-20. Протеинограммы белков сыворотки крови. а - в норме; б - при нефротическом синдроме; в - при гипогаммаглобулинемии; г - при циррозе печени; д - при недостатке α1-антитрипсина; е - при диффузной гипергаммаглобулинемии.
систему комплемента, и его концентрация в крови, например, при обострении ревматоидного артрита может возрастать в 30 раз по сравнению с нормой. Белок плазмы крови а,-антитрипсин может инактивировать некоторые протеазы, освобождающиеся в острой фазе воспаления.
Содержание некоторых белков в плазме крови и их функции представлены в таблице 14-2.
Альбумин. Концентрация альбумина в крови составляет 40-50 г/л. В сутки в печени синтезируется около 12 г альбумина, Т1/2 этого белка - примерно 20 дней. Альбумин состоит из 585 аминокислотных остатков, имеет 17 дисульфидных связей и обладает молекулярной массой 69 кД. Молекула альбумина содержит много дикарбоновых аминокислот, поэтому может удерживать в крови катионы Са2+, Cu2+, Zn2+. Около 40% альбумина содержится в крови и остальные 60% в межклеточной жидкости, однако его концентрация в плазме выше, чем в межклеточной жидкости, поскольку объём последней превышает объём плазмы в 4 раза.
Благодаря относительно небольшой молекулярной массе и высокой концентрации альбумин обеспечивает до 80% осмотического давления плазмы. При гипоальбуминемии осмотическое давление плазмы крови снижается. Это приводит к нарушению равновесия в распределении внеклеточной жидкости между сосудистым руслом и межклеточным пространством. Клинически это проявляется как отёк. Относительное снижение объёма плазмы крови сопровождается снижением почечного кровотока, что вызывает стимуляцию системы ренинангиотензинальдрстерон, обеспечивающей восстановление объёма крови (см. раздел 11). Однако при недостатке альбумина, который должен удерживать Na+, другие катионы и воду, вода уходит в межклеточное пространство, усиливая отёки.
Гипоальбуминемия может наблюдаться и в результате снижения синтеза альбуминов при заболеваниях печени (цирроз), при повышении проницаемости капилляров, при потерях белка из-за обширных ожогов или катаболических состояний (тяжёлый сепсис, злокачественные новообразования), при нефротическом синдроме, сопровождающемся альбуминурией, и голодании. Нарушения кровообращения, характеризующиеся замедлением кровотока, приводят к увеличению поступления альбумина в межклеточное пространство и появлению отёков. Быстрое увеличение проницаемости капилляров сопровождается резким уменьшением объёма крови, что приводит к падению АД и клинически проявляется как шок.
Альбумин - важнейший транспортный белок. Он транспортирует свободные жирные кислоты (см. раздел 8), неконъюгированный билирубин (см. раздел 13), Са2+, Сu2+, триптофан, тироксин и трийодтиронин (см. раздел 11). Многие лекарства (аспирин, дикумарол, сульфаниламиды) связываются в крови с альбумином. Этот факт необходимо учитывать при лечении заболеваний, сопровождающихся гипоальбуминемией, так как в этих случаях повышается концентрация свободного лекарства в крови. Кроме того, следует помнить, что некоторые лекарства могут конкурировать за центры связывания в молекуле альбумина с билирубином и между собой.
Транстиретин (преальбумин) называют тирок-синсвязывающим преальбумином. Это белок острой фазы. Транстиретин относят к фракции альбуминов, он имеет тетрамерную молекулу. Он способен присоединять в одном центре связывания ретинолсвязывающий белок, а в другом - до двух молекул тироксина и трийодтиронина.
684
Таблица 14-2. Содержание и функции некоторых белков плазмы крови
|
Группа |
Белки |
Концентрация в сыворотке крови, г/л |
Функция |
|
Альбумины |
Транстиретин |
0,25 |
Транспорт тироксина и трийодтиронина |
|
|
Альбумин |
40 |
Поддержание осмотического давления, транспорт жирных кислот, билирубина, жёлчных кислот, стероидных гормонов, лекарств, неорганических ионов, резерв аминокислот |
|
α1-Глобулины |
α1 -Антитрипсин |
2,5 |
Ингибитор протеиназ |
|
|
ЛПВП |
0,35 |
Транспорт холестерола |
|
|
Протромбин |
0,1 |
Фактор II свёртывания крови |
|
|
Транскортин |
0,03 |
Транспорт кортизола, кортикостерона, прогестерона |
|
|
Кислый α1-гликопротеин |
1 |
Транспорт прогестерона |
|
|
Тироксинсвязывающий глобулин |
0,02 |
Транспорт тироксина и трийодтиронина |
|
α2-Глобулины |
Церулоплазмин |
0,35 |
Транспорт ионов меди, оксидоредуктаза |
|
|
Антитромбин III |
0,3 |
Ингибитор плазменных протеаз |
|
|
Гаптоглобин |
1 |
Связывание гемоглобина |
|
|
α2-Макроглобулин |
2,6 |
Ингибитор плазменных протеиназ, транспорт цинка |
|
|
Ретинолсвязыва-ющий белок |
0,04 |
Транспорт ретинола |
|
|
Витамин D связывающий белок |
0,4 |
Транспорт кальциферола |
|
β-Глобулины |
ЛПНП |
3,5 |
Транспорт холестерола |
|
|
Трансферрин |
3 |
Транспорт ионов железа |
|
|
Фибриноген |
3 |
Фактор I свёртывания крови |
|
|
Транскобаламин |
25×10-9 |
Транспорт витамина B12 |
|
|
Глобулин связывающий белок |
20×10-6 |
Транспорт тестостерона и эстрадиола |
|
|
С-реактивный белок |
<0,01 |
Активация комплемента |
|
γ-Глобулины |
IgG |
12 |
Поздние антитела |
|
|
IgA |
3,5 |
Антитела, защищающие слизистые оболочки |
|
|
IgM |
1,3 |
Ранние антитела |
|
|
IgD |
0,03 |
Рецепторы В-лимфоцитов |
|
|
IgE |
<0,01 |
Реагин |
685
Соединение с этими лигандами происходит независимо друг от друга. В транспорте последних транстиретин играет существенно меНbшую роль по сравнению с тироксинсвязывающим глобулином.
α1 - Антитрипсин относят к α1-глобулинам. Он ингибирует ряд протеаз, в том числе фермент эластазу, освобождающийся из нейтрофилов и разрушающий эластин альвеол лёгких. При недостаточности α1-антитрипсина могут возникнуть эмфизема лёгких (см. раздел 15) и гепатит, приводящий к циррозу печени. Существует несколько полиморфных форм α1-антитрипсина, одна из которых является патологической. У людей, гомозиготных по двум дефектным аллелям гена антитрипсина, в печени синтезируется α1-антитрипсин, который образует агрегаты, разрушающие гепатоциты. Это приводит к нарушению секреции такого белка гепатоцитами и к снижению содержания α1-антитрипсина в крови.
Гаптоглобин составляет примерно четверть всех α2-глобулинов. Гаптоглобин при внутрисосудистом гемолизе эритроцитов образует комплекс с гемоглобином, который разрушается в клетках РЭС. Если свободный гемоглобин, имеющий молекулярную массу 65 кД, может фильтроваться через почечные клубочки или агрегировать в них, то комплекс гемоглобин-гаптоглобин имеет слишком большую молекулярную массу (155 кД), чтобы пройти через гломерулы. Следовательно, образование такого комплекса предотвращает потери организмом железа, содержащегося в гемоглобине. Определение содержания гаптоглобина имеет диагностическое значение, например, снижение концентрации гаптоглобина в крови наблюдают при гемолитической анемии. Это объясняют тем, что при Т1/2 гаптоглобина, составляющем 5 дней, и Т1/2 комплекса гемоглобин - гаптоглобин (около 90 мин) увеличение поступления свободного гемоглобина в кровь при гемолизе эритроцитов вызовет резкое снижение содержания свободного гаптоглобина в крови.
Гаптоглобин относят к белкам острой фазы, его содержание в крови повышается при острых воспалительных заболеваниях.
Информация о некоторых других белках плазмы крови, представленных в табл. 14-2, имеется в соответствующих разделах учебника.
Энзимодиагностика
Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях:
при повреждении клеток в крови или других биологических жидкостях (например, в моче) увеличивается концентрация внутриклеточных ферментов повреждённых клеток;
количество высвобождаемого фермента достаточно для его обнаружения;
активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени И отличается от нормальных значений;
ряд ферментов имеет преимущественную или абсолютную локализацию в определённых органах (органоспецифичность);
существуют различия во внутриклеточной локализации ряда ферментов.
