
- •2 Аминокислоты, входящие в состав белков, их строение и свойства. Биологическая
- •1. Общие структурные особенности аминокислот, входящих в состав белков
- •2. Классификация аминокислот по химическому строению радикалов
- •3. Классификация аминокислот по растворимости их радикалов в воде
- •2.Характеристика пептидной связи
- •4. Вторичная структура белков. Связи стабилизирующие вторичную структуру.
- •1. Классификации шаперонов (ш)
- •2. Роль шаперонов в фолдинге белков
- •8 . Физико-химические свойства белков. Молекулярная масса, размеры и форма, растворимость, гидротация и ионизация. Денатурация, признаки и факторы ее вызывающие.
- •10. Принципы классификации белков. Классификация по составу и биологическим функциям, примеры представителей отдельных классов.
- •11. Иммуноглобулины, классы иммуноглобулинов, особенности доменного строения и
- •13. Классификация и номенклатура ферментов, примеры
- •1. Оксидоредукпшзы
- •2.Трансферты
- •3.Гидролазы
- •4. Лиазы
- •5. Изомеразы
- •6. Лигазы (синтетазы)
- •15. Кинетика ферментативных реакций. Зависимость скорости ферментативной реакции от температуры, рН среды, концентрации ферментов и субстрата. Уравнение Михаэлиса-Ментен, Кm.
- •16. Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр, в2 на примере трансаминаз и дегидрогеназ.
- •17. Ингибирование активности ферментов: обратимое (конкурентное и неконкурентное)
- •1. Конкурентное ингибирование
- •2. Неконкурентное ингибирование
- •19. Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования.
- •20. Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции протеолитической активности ферментов.
- •21. Изоферменты: происхождение, биологическое значение, примеры. Определение ферментов и изоферментного спектра плазмы крови с целью диагностики заболеваний.
- •22. Энзимопатии наследственные (фенилкетонурия) и приобретенные (цинга). Применение ферментов для лечения болезней.
- •23. Общая схема синтеза и распада пиримидиновых нуклеотидов. Регуляция. Оротоцидурия.
- •24. Общая схема синтеза и распада пуриновых нуклеотидов. Регуляция. Подагра.
- •27. Гибридизация нуклеиновых кислот. Денатурация и ренативация днк. Гибридизация (днк-днк, днк-рнк). Методы лабораторной диагностики, основанные на гибридизации нуклеиновых кислот.
- •29. Репликация. Принципы репликации днк. Стадии репликации. Инициация. Белки и ферменты, принимающие участие в формировании репликативной вилки.
- •30. Элонгация и терминация репликации. Ферменты. Асимметричный синтез днк. Фрагменты Оказаки. Роль днк-лигазы в формировании непрерывной и отстающей цепи.
- •31. Повреждения и репарация днк. Виды повреждений. Способы репарации. Дефекты репарационных систем и наследственные болезни.
- •32. Транскрипция. Характеристика компонентов системы синтеза рнк. Структура днк-зависимой рнк-полимеразы: роль субъединиц. Инициация процесса. Элонгация, терминация, транскрипция.
- •33. Первичный транскрипт и его процессинг. Рибозимы как пример каталитической активности нуклеиновых кислот. Биороль.
- •34. Генетический код и его свойства. Основные компоненты белоксинтезирующей системы: аминокислоты, аминоацил-т-рнк синтетазы т-рнк, рибосомы, источник энергии, белковые факторы, ферменты.
- •35. Сборка полипептидной цепи на рибосоме. Образование инициаторного комплекса. Элонгация: образование пептидной связи (реакция транспептидации). Транслокация. Транслоказа. Терминация.
- •1. Инициация
- •2. Элонгация
- •3. Терминация
- •36. Особенности синтеза и процессинга секретируемых белков (на примере коллагена и инсулина).
- •37. Биохимия питания. Основные компоненты пищи человека, их биороль, суточная потребность в них. Незаменимые компоненты пищи.
- •38. Белковое питание. Биологическая ценность белков. Азотистый баланс. Полноценность белкового питания, нормы белка в питании, белковая недостаточность.
- •39. Переваривание белков: протеазы жкт, их активация и специфичность, оптимум рН и результат действия. Образование и роль соляной кислоты в желудке. Защита клеток от действия протеаз.
- •40. Всасывание продуктов переваривания. Транспорт ак в клетки кишечника. Особенности транспорта ак в гепатоцитах. Y-глутамильный цикл. Нарушение переваривания и всасывания ак.
- •42. Минеральные вещества пищи, макро- и микроэлементы, биологическая роль. Региональные патологии, связанные с недостатком микроэлементов.
- •43. Биологические мембраны, строение, функции и общие свойства: жидкостность, поперечная ассиметрия, избирательная проницаемость.
- •1. Структура и свойства липидов мембран
- •2. Трансмембранная асимметрия липидов
- •3. Жидкостностъ мембран
- •4. Функции мембранных липидов
- •45. Механизм переноса веществ через мембраны: простая диффузия, пассивный симпорт и антипорт, активный транспорт, регулируемые каналы. Мембранные рецепторы.
- •1. Первично-активный транспорт
- •2. Вторично-активный транспорт
- •46. Эндергонические и экзергонические реакции живой клетки. Макроэргические соединения, определение, пример.
- •4. Сопряжение экзергонических и эндергонических процессов в организме
- •2. Цепь переноса электронов от nadh и fadh2 на кислород
- •50. Образование активных форм кислорода(синглетный кислород, пероксид водорода, гидроксильный радикал). Место образоваия, схемы реакций. Физиологическая роль афк.
- •51. Механизм повреждающего действия активных форм кислорода на клетки (пол, окисление белков и нуклеиновых кислот). Примеры реакций.
- •1. Строение пируватдегидрогеназного комплекса
- •2. Окислительное декарбоксилирование пирувата
- •3. Связь окислительного декарбоксилирования пирувата с цпэ
- •53. Цикл лимонной кислоты: последовательность реакций и характеристика ферментов. Роль цикла в метаболизме.
- •57. Аэробный гликолиз. Последовательность реакций до образования пирувата (аэробный гликолиз). Использование глюкозы для синтеза жиров. Энергетический эффект аэробного распада глюкозы.
- •1. Этапы аэробного гликолиза
- •2. Реакции аэробного гликолиза
- •1. Реакции анаэробного гликолиза
- •60. Гликоген, биологическое значение. Биосинтез и мобилизация гликогена. Регуляция синтеза и распада гликогена. Обмен гликогена в анте- и неонатальном периоде.
- •61. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, непереносимость фруктозы и дисахаридов, эссенциальная фруктоземия. Гликогенозы и агликогенозы.
- •62. Липиды. Общая характеристика. Биологическая роль. Классификация липидов. Высшие жирные кислоты, особенности строения. Полиеновые жирные кислоты. Триацилглицеролы.
- •65. Депонирование и мобилизация жиров в жировой ткани, физиологическая роль этих процессов. Роль инсулина, адреналина и глюкагона в регуляции метобализма жира.
- •67. Биосинтез жирных кислот. Основные стадии процесса. Регуляция обмена жирных кислот.
- •69. Холестерин. Пути поступления, использования и выведения из организма. Уровень холестерина в сыворотке крови. Биосинтез холестерина, его этапы. Регуляция синтеза.
- •74. Непрямое дезаминирование аминокислот. Схема процесса, субстраты, ферменты, кофакторы.
- •1. Синтез и биологическая роль серотонина
- •1. Окислительное дезаминирование
- •2. Непрямое дезаминирование (трансдезаминирование)
- •3. Неокислительное дезамитровате
- •1. Метаболизм феиилаланина
- •2. Особенности обмена тирозина в разных тканях
- •3. Заболевания, связанные с нарушением обмена фенилаланина и тирозина
- •1. Классификация гормонов по химическому строению
- •2. Классификация гормонов по биологическим функциям
- •3. Передача сигналов через рецепторы, сопряжённые с ионными каналами
- •1. Гормон роста, пролактин
- •2. Тиреотропин, лютеинизирующий гормони фолликулостимулирующий гормон
- •3. Группа гормонов, образующихсяиз проопиомеланокортина
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •2. Роль системы ренин-ангиотензин- альдостерон в регуляции водно-солевого обмена
- •3. Восстановление объёма крови при обезвоживании организма
- •4. Гиперальдостеронтм
- •1. Синтез и секреция птг
- •2. Роль паратгормона в регуляции обмена кальция и фосфатов
- •3. Гиперпаратиреоз
- •4. Гипопаратиреоз
- •1. Строение и синтез кальцитриола
- •2. Механизм действия кальцитриола
- •3. Рахит
- •2. Биологические функции инсулина
- •3. Механизм действия инсулина
- •1. Изменения метаболизма в печени в абсорбтивном периоде
- •2. Изменения метаболизма в адипоцитах
- •3. Изменение метаболизма в мышцах в абсорбтивном периоде
- •1. Изменения метаболизма в печени
- •2. Изменения метаболизма в жировой ткани
- •1. Инсулинзависимый сахарный диабет
- •2. Инсулинонезависимый сахарный диабет
- •1. Симптомы сахарного диабета
- •2. Острые осложнения сахарного диабета. Механизмы развития диабетической комы
- •3. Поздние осложнения сахарного диабета
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •2. Функционирование цитохрома р450
- •3. Свойства системы микросомального окисления
- •1. Причины, приводящие к увеличению количества ферментов в крови
- •2. Изоферменты
- •3. Энзимодиагностика при инфаркте миокарда
- •1. Простые белки
- •1. Безмиелиновое волокно
- •2. Миелиновое волокно
13. Классификация и номенклатура ферментов, примеры
Каждый фермент имеет 2 названия. Первое - короткое, так называемое рабочее, удобное для повседневного использования. Второе (более полное) - систематическое, применяемое для однозначной идентификации фермента.
А. Рабочее название
В названии большинства ферментов содержится суффикс "аза", присоединённый к названию субстрата реакции, например уреаза, сахараза, липаза, нуклеаза или к названию химического превращения определённого субстрата, например лактатдегидрогеназа, аденилатциклаза, фосфо-глюкомутаза, пируваткарбоксилаза. Согласно российской классификации ферментов (КФ), названия ферментов пишутся слитно. Однако в употреблении сохранился ряд тривиальных, исторически закреплённых названий ферментов, которые не дают представления ни о субстрате, ни о типе химического превращения, например трипсин, пепсин, ренин, тромбин.
Б. Классы ферментов
1. Оксидоредукпшзы
Катализируют различные окислительно-восстановительные реакции с участием 2 субстратов (перенос е- или атомов водорода с одного субстрата на другой).
Систематическое наименование ферментов составляют по формуле "донор: акцептороксидоредуктаза", рабочее - субстрат-подкласс оксидоредуктаз.
Дегидрогеназы. В этот подкласс входят ферменты, катализирующие реакции дегидрирования (отщепления водорода). В качестве акцепторов электронов используются коферменты NAD+, NADP+, FAD, FMN (см. ниже). Все ферменты этой группы обладают высокой субстратной специфичностью. Пример реакции:
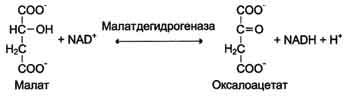
Оксидазы. Акцептором электрона служит молекулярный кислород. Пример реакции, катализируемой цитохромоксидазой:
![]()
Оксигеназы (гидроксилазы) - атом кислорода из молекулы кислорода присоединяется к субстрату. Пример реакции:
2.Трансферты
Катализируют перенос функциональных групп от одного соединения к другому. Подразделяют в зависимости от переносимой группы.
Название этих ферментов составляют по формуле "донор: ацетрофэкспортируемая группатрансфераза". К классу трансфераз относят аминотрансферазы, ацилтрансферазы, метилтранс-феразы, гликозилтрансферазы, киназы (фосфо-трансферазы). Примеры реакций
3.Гидролазы
Катализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва). Подразделяют в зависимости от расщепляемой связи.
Наименование ферментов составляют по формуле "субстрат-гидролаза" или прямым присоединением к названию субстрата суффикса "аза", например протеаза, липаза, фосфолипаза, рибо-нуклеаза. Пример реакции (см. схему Б).
Для отдельных классов гидролаз применимы специальные термины, характеризующие гидролиз определённой химической связи: эстеразы, фосфатазы и др.
4. Лиазы
К лиазам относят ферменты, отщепляющие от субстратов негидролитическим путём определённую группу (при этом могут отщепляться СО2, Н2О, NH2,SН2и др.) или присоединяющие чаще всего молекулу воды по двойной связи.
Наименование ферментов составляют по формуле "субстрат-отщепляемая или присоединяемая группировка". Примеры реакций.
5. Изомеразы
Катализируют различные внутримолекулярные превращения. Подразделяют в зависимости от типа реакции изомеризации.
Как общее название ферментов этого класса применяют термин "изомеразы"
Изомеразы могут катализировать внутримолекулярные окислительно-восстановительные реакции, осуществляя взаимопревращения альдоз и кетоз, кетонных и енольных групп, перемещения двойных связей внутри молекулы .
Когда изомеризация состоит во внутримолекулярном переносе группы, фермент называют "мутазой»
