
- •2 Аминокислоты, входящие в состав белков, их строение и свойства. Биологическая
- •1. Общие структурные особенности аминокислот, входящих в состав белков
- •2. Классификация аминокислот по химическому строению радикалов
- •3. Классификация аминокислот по растворимости их радикалов в воде
- •2.Характеристика пептидной связи
- •4. Вторичная структура белков. Связи стабилизирующие вторичную структуру.
- •1. Классификации шаперонов (ш)
- •2. Роль шаперонов в фолдинге белков
- •8 . Физико-химические свойства белков. Молекулярная масса, размеры и форма, растворимость, гидротация и ионизация. Денатурация, признаки и факторы ее вызывающие.
- •10. Принципы классификации белков. Классификация по составу и биологическим функциям, примеры представителей отдельных классов.
- •11. Иммуноглобулины, классы иммуноглобулинов, особенности доменного строения и
- •13. Классификация и номенклатура ферментов, примеры
- •1. Оксидоредукпшзы
- •2.Трансферты
- •3.Гидролазы
- •4. Лиазы
- •5. Изомеразы
- •6. Лигазы (синтетазы)
- •15. Кинетика ферментативных реакций. Зависимость скорости ферментативной реакции от температуры, рН среды, концентрации ферментов и субстрата. Уравнение Михаэлиса-Ментен, Кm.
- •16. Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр, в2 на примере трансаминаз и дегидрогеназ.
- •17. Ингибирование активности ферментов: обратимое (конкурентное и неконкурентное)
- •1. Конкурентное ингибирование
- •2. Неконкурентное ингибирование
- •19. Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования.
- •20. Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции протеолитической активности ферментов.
- •21. Изоферменты: происхождение, биологическое значение, примеры. Определение ферментов и изоферментного спектра плазмы крови с целью диагностики заболеваний.
- •22. Энзимопатии наследственные (фенилкетонурия) и приобретенные (цинга). Применение ферментов для лечения болезней.
- •23. Общая схема синтеза и распада пиримидиновых нуклеотидов. Регуляция. Оротоцидурия.
- •24. Общая схема синтеза и распада пуриновых нуклеотидов. Регуляция. Подагра.
- •27. Гибридизация нуклеиновых кислот. Денатурация и ренативация днк. Гибридизация (днк-днк, днк-рнк). Методы лабораторной диагностики, основанные на гибридизации нуклеиновых кислот.
- •29. Репликация. Принципы репликации днк. Стадии репликации. Инициация. Белки и ферменты, принимающие участие в формировании репликативной вилки.
- •30. Элонгация и терминация репликации. Ферменты. Асимметричный синтез днк. Фрагменты Оказаки. Роль днк-лигазы в формировании непрерывной и отстающей цепи.
- •31. Повреждения и репарация днк. Виды повреждений. Способы репарации. Дефекты репарационных систем и наследственные болезни.
- •32. Транскрипция. Характеристика компонентов системы синтеза рнк. Структура днк-зависимой рнк-полимеразы: роль субъединиц. Инициация процесса. Элонгация, терминация, транскрипция.
- •33. Первичный транскрипт и его процессинг. Рибозимы как пример каталитической активности нуклеиновых кислот. Биороль.
- •34. Генетический код и его свойства. Основные компоненты белоксинтезирующей системы: аминокислоты, аминоацил-т-рнк синтетазы т-рнк, рибосомы, источник энергии, белковые факторы, ферменты.
- •35. Сборка полипептидной цепи на рибосоме. Образование инициаторного комплекса. Элонгация: образование пептидной связи (реакция транспептидации). Транслокация. Транслоказа. Терминация.
- •1. Инициация
- •2. Элонгация
- •3. Терминация
- •36. Особенности синтеза и процессинга секретируемых белков (на примере коллагена и инсулина).
- •37. Биохимия питания. Основные компоненты пищи человека, их биороль, суточная потребность в них. Незаменимые компоненты пищи.
- •38. Белковое питание. Биологическая ценность белков. Азотистый баланс. Полноценность белкового питания, нормы белка в питании, белковая недостаточность.
- •39. Переваривание белков: протеазы жкт, их активация и специфичность, оптимум рН и результат действия. Образование и роль соляной кислоты в желудке. Защита клеток от действия протеаз.
- •40. Всасывание продуктов переваривания. Транспорт ак в клетки кишечника. Особенности транспорта ак в гепатоцитах. Y-глутамильный цикл. Нарушение переваривания и всасывания ак.
- •42. Минеральные вещества пищи, макро- и микроэлементы, биологическая роль. Региональные патологии, связанные с недостатком микроэлементов.
- •43. Биологические мембраны, строение, функции и общие свойства: жидкостность, поперечная ассиметрия, избирательная проницаемость.
- •1. Структура и свойства липидов мембран
- •2. Трансмембранная асимметрия липидов
- •3. Жидкостностъ мембран
- •4. Функции мембранных липидов
- •45. Механизм переноса веществ через мембраны: простая диффузия, пассивный симпорт и антипорт, активный транспорт, регулируемые каналы. Мембранные рецепторы.
- •1. Первично-активный транспорт
- •2. Вторично-активный транспорт
- •46. Эндергонические и экзергонические реакции живой клетки. Макроэргические соединения, определение, пример.
- •4. Сопряжение экзергонических и эндергонических процессов в организме
- •2. Цепь переноса электронов от nadh и fadh2 на кислород
- •50. Образование активных форм кислорода(синглетный кислород, пероксид водорода, гидроксильный радикал). Место образоваия, схемы реакций. Физиологическая роль афк.
- •51. Механизм повреждающего действия активных форм кислорода на клетки (пол, окисление белков и нуклеиновых кислот). Примеры реакций.
- •1. Строение пируватдегидрогеназного комплекса
- •2. Окислительное декарбоксилирование пирувата
- •3. Связь окислительного декарбоксилирования пирувата с цпэ
- •53. Цикл лимонной кислоты: последовательность реакций и характеристика ферментов. Роль цикла в метаболизме.
- •57. Аэробный гликолиз. Последовательность реакций до образования пирувата (аэробный гликолиз). Использование глюкозы для синтеза жиров. Энергетический эффект аэробного распада глюкозы.
- •1. Этапы аэробного гликолиза
- •2. Реакции аэробного гликолиза
- •1. Реакции анаэробного гликолиза
- •60. Гликоген, биологическое значение. Биосинтез и мобилизация гликогена. Регуляция синтеза и распада гликогена. Обмен гликогена в анте- и неонатальном периоде.
- •61. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, непереносимость фруктозы и дисахаридов, эссенциальная фруктоземия. Гликогенозы и агликогенозы.
- •62. Липиды. Общая характеристика. Биологическая роль. Классификация липидов. Высшие жирные кислоты, особенности строения. Полиеновые жирные кислоты. Триацилглицеролы.
- •65. Депонирование и мобилизация жиров в жировой ткани, физиологическая роль этих процессов. Роль инсулина, адреналина и глюкагона в регуляции метобализма жира.
- •67. Биосинтез жирных кислот. Основные стадии процесса. Регуляция обмена жирных кислот.
- •69. Холестерин. Пути поступления, использования и выведения из организма. Уровень холестерина в сыворотке крови. Биосинтез холестерина, его этапы. Регуляция синтеза.
- •74. Непрямое дезаминирование аминокислот. Схема процесса, субстраты, ферменты, кофакторы.
- •1. Синтез и биологическая роль серотонина
- •1. Окислительное дезаминирование
- •2. Непрямое дезаминирование (трансдезаминирование)
- •3. Неокислительное дезамитровате
- •1. Метаболизм феиилаланина
- •2. Особенности обмена тирозина в разных тканях
- •3. Заболевания, связанные с нарушением обмена фенилаланина и тирозина
- •1. Классификация гормонов по химическому строению
- •2. Классификация гормонов по биологическим функциям
- •3. Передача сигналов через рецепторы, сопряжённые с ионными каналами
- •1. Гормон роста, пролактин
- •2. Тиреотропин, лютеинизирующий гормони фолликулостимулирующий гормон
- •3. Группа гормонов, образующихсяиз проопиомеланокортина
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •2. Роль системы ренин-ангиотензин- альдостерон в регуляции водно-солевого обмена
- •3. Восстановление объёма крови при обезвоживании организма
- •4. Гиперальдостеронтм
- •1. Синтез и секреция птг
- •2. Роль паратгормона в регуляции обмена кальция и фосфатов
- •3. Гиперпаратиреоз
- •4. Гипопаратиреоз
- •1. Строение и синтез кальцитриола
- •2. Механизм действия кальцитриола
- •3. Рахит
- •2. Биологические функции инсулина
- •3. Механизм действия инсулина
- •1. Изменения метаболизма в печени в абсорбтивном периоде
- •2. Изменения метаболизма в адипоцитах
- •3. Изменение метаболизма в мышцах в абсорбтивном периоде
- •1. Изменения метаболизма в печени
- •2. Изменения метаболизма в жировой ткани
- •1. Инсулинзависимый сахарный диабет
- •2. Инсулинонезависимый сахарный диабет
- •1. Симптомы сахарного диабета
- •2. Острые осложнения сахарного диабета. Механизмы развития диабетической комы
- •3. Поздние осложнения сахарного диабета
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •2. Функционирование цитохрома р450
- •3. Свойства системы микросомального окисления
- •1. Причины, приводящие к увеличению количества ферментов в крови
- •2. Изоферменты
- •3. Энзимодиагностика при инфаркте миокарда
- •1. Простые белки
- •1. Безмиелиновое волокно
- •2. Миелиновое волокно
33. Первичный транскрипт и его процессинг. Рибозимы как пример каталитической активности нуклеиновых кислот. Биороль.
Ковалентная модификация (процессинг) матричной РНК
Первичные транскрипты мРНК, прежде чем будут использованы в ходе синтеза белка, подвергаются ряду ковалентных модификаций. Эти модификации необходимы для функционирования мРНК в качестве матрицы.
Модификация 5'-конца
Модификации пре-мРНК начинаются на стадии элонгации. Когда длина первичного транскрипта достигает примерно 30 нуклеотидных остатков, происходит кэпирование его 5'-конца. Осуществляет кэпирование гуанилилтрансфераза. Фермент гидролизует макроэргическую связь в молекуле ГТФ и присоединяет нуклеотиддифосфатный остаток 5'-фосфатной группой к 5'-концу синтезированного фрагмента РНК с образованием 5', 5'-фосфодиэфирной связи. Последующее метилирование остатка гуанина в составе ГТФ с образованием N7-метилгуанозина завершает формирование кэпа (рис. 4-31).
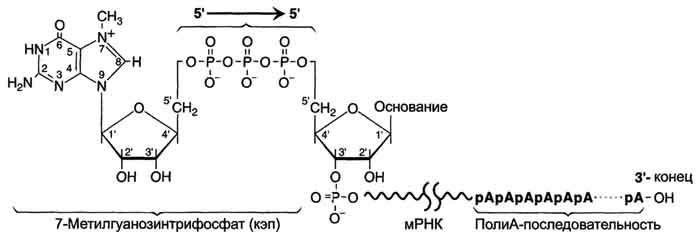
Рис. 4-31. Ковалентная модификация концевых нуклеотидных остатков первичного транскрипта мРНК.
Модифицированный 5'-конец обеспечивает инициацию трансляции, удлиняет время жизни мРНК, защищая её от действия 5'-экзонуклеаз в цитоплазме. Кэпирование необходимо для инициации синтеза белка, так как инициирующие триплеты AUG, GUG распознаются рибосомой только если присутствует кэп. Наличие кэпа также необходимо для работы сложной ферментной системы, обеспечивающей удаление нитронов.
Модификация 3'-конца
3'-Конец большинства транскриптов, синтезированных РНК-полимеразой II, также подвергается модификации, при которой специальным ферментом полиА-полимеразой формируется полиА-последовательность (полиА-"хвост"), состоящая из 100-200 остатков аде-ниловой кислоты.
Сигналом к началу полиаденилирования является последовательность -AAUAAA- на растущей цепи РНК. Фермент полиА-полимераза, проявляя экзонуклеазную активность, разрывает 3'-фосфоэфирную связь после появления в цепи РНК специфической последовательности -AAUAAA-. К 3'-концу в точке разрыва полиА-полимераза наращивает по-лиА-"хвост", Наличие полиА-последовательности на 3'-конце облегчает выход мРНК из ядра и замедляет её гидролиз в цитоплазме.
Ферменты, осуществляющие кэширование и полиаденилирование, избирательно связываются с РНК-полимеразой II, и в отсутствие полимеразы неактивны.
Сплайсинг первичных транскриптов мРНК
С появлением методов, позволяющих изучать первичную структуру молекул мРНК в цитоплазме и последовательность нуклеотидов кодирующей её геномной ДНК, было установлено, что они не комплементарны, а длина гена в несколько раз больше "зрелой" мРНК. Последовательности нуклеотидов, присутствующие в ДНК, но не входящие в состав зрелой мРНК, были названы некодирующими, или интроны, а последовательности, присутствующие в мРНК, - кодирующими, или экзоны. Таким образом, первичный транскрипт - строго комплементарная матрице нуклеиновая кислота (пре-мРНК), содержащая как экзоны, так и интроны. Длина интронов варьирует от 80 до 1000 нуклеотидов. Последовательности интронов "вырезаются" из первичного транскрипта, концы экзонов соединяются друг с другом. Такую модификацию РНК называют "сплайсинг" (от англ, to splice - сращивать). Сплайсинг происходит в ядре, в цитоплазму поступает уже "зрелая" мРНК.
Гены эукариотов содержат больше интронов, чем экзонов, поэтому очень длинные молекулы пре-мРНК (около 5000 нуклеотидов) после сплайсинга превращаются в более короткие молекулы цитоплазматической мРНК (от 500 до 3000 нуклеотидов).
Процесс "вырезания" интронов протекает при участии малых ядерных рибонуклеопротеинов (мяРНП). В состав мяРНП входит малая ядерная РНК (мяРНК), нуклеотидная цепь которой связана с белковым остовом, состоящим из нескольких протомеров. В сплайсинге принимают участие различные мяРНП (рис. 4-32).
Нуклеотидные последовательности нитронов функционально неактивны. Но на 5'- и З'-концах они имеют высокоспецифические последовательности - AGGU- и GAGG- соответственно (сайты сплайсинга), которые обеспечивают их удаление из молекулы пре-мРНК. Изменение структуры этих последовательностей влияет на процесс сплайсинга.
На первой стадии процесса мяРНП связываются со специфическими последовательностями первичного транскрипта (сайты сплайсинга), далее к ним присоединяются другие мяРНП. При формировании структуры сплайсосомы 3'-конец одного экзона сближается с 5'-концом следующего экзона. Сплайсосома катализирует реакцию расщепления 3',5'-фосфодиэфирной связи на границе экзона с интроном. Последовательность интрона удаляется, а два экзона соединяются. Образование 3',5'-фосфодиэфирной связи между двумя экзонами катализируют мяРНК (малые ядерные РНК), входящие в структуру сплайсосомы. В результате сплайсинга из первичных транскриптов мРНК образуются молекулы "зрелой" мРНК.
Альтернативный сплайсинг первичных транскриптов мРНЕ
Для некоторых генов описаны альтернативные пути сплайсинга и полиаденилирования одного и того же транскрипта. Экзон одного варианта сплайсинга может оказаться интроном в альтернативном пути, поэтому молекулы мРНК, образованные в результате альтернативного сплайсинга, различаются набором экзонов. Это приводит к образованию разных мРНК и, соответственно, разных белков с одного первичного транскрипта. Так, в парафолликулярных клетках щитовидной железы (рис. 4-33) в ходе транскрипции гена гормона кальцитонина (см. раздел 11) образуется первичный транскрипт мРНК, который состоит из шести экзонов. Матричная РНК кальцитонина образуется путём сплайсинга первых четырёх экзонов (1-4). Последний (четвёртый) экзон содержит сигнал полиаденилирования (последовательность -AAUAAA-), узнаваемый полиА-полимеразой в парафолликулярных клетках щитовидной железы. Этот же первичный транскрипт в клетках головного мозга в ходе другого (альтернативного) пути сплайсинга превращается в мРНК кальцитонинподобного белка, отвечающего за вкусовое восприятие. Матричная РНК этого белка состоит из первых трёх экзонов, общих с кальцитониновои мРНК, но включает дополнительно пятый и шестой экзоны, не свойственные мРНК кальцитонина. Шестой экзон тоже имеет сигнал полиаденилирования -AAUAAA-, узнаваемый ферментом полиА-полимеразой в клетках нервной ткани. Выбор одного из путей (альтернативный сплайсинг) и одного из возможных сайтов полиаденилирования играет важную роль в тканеспецифической экспрессии генов.
Сплайсинг РНК. В процессе сплайсинга принимают участие различные мяРНП, которые формируют сплайсосому. мяРНП, взаимодействуя с РНК и друг с другом, фиксируют и ориентируют реакционные группы первичного транскрипта. Каталитическая функция сплайсосом обусловлена РНК-составляющими; такие РНК называют рибозимами.
Альтернативный сплайсинг гена кальцитонина. В клетках щитовидной железы сплайсинг первичного транскрипта приводит к образованию кальцитониновои мРНК, включающей 4 экзона и полиА-последовательность, которая образуется после расщепления транскрипта в первом участке сигнала полиаденилирования. В клетках мозга образуется мРНК, содержащая: экзоны 1, 2, 3, 5, 6 и полиА-последовательность, образованную после второго сигнала полиаденилирования.
Разные варианты сплайсинга могут приводить к образованию разных изоформ одного и того же белка. Например, ген тропонина состоит из 18 экзонов и кодирует многочисленные изоформы этого мышечного белка. Разные изоформы тропонина образуются в разных тканях на определённых стадиях их развития.
