
- •1 Билет
- •2 Билет
- •3 Билет
- •4 Билет
- •5 Билет
- •3. Полноценное питание должно содержать:
- •6 Билет
- •7 Билет
- •8 Билет
- •9 Билет
- •10 Билет
- •2.Синтез жиров в печени и жировой ткани.
- •11 Билет
- •12 Билет
- •13 Билет
- •14 Билет
- •3. Терминация
- •15 Билет
- •16 Билет
- •17 Билет
- •18 Билет
- •19 Билет
- •3. Регуляция обмена ионов ca и фосфатов. Строение, биосинтез и механизм действия паратгормона, кальцитонина и кальцитриола. Рахит, гипо- и гиперпаратиреоидизм.
- •20 Билет
- •1. Классификация и номенклатура ферментов, примеры.
- •3. Регуляция водно-солевого обмена. Строение, механизм действия и функции альдостерона и вазопрессина. Роль системы ренин-ангиотензин-альдостерон. Предсердный натриуретический фактор.
- •21 Билет
- •1. Ингибирование активности ферментов: обратимое (конкурентное и неконкурентное) и необратимое. Лекарственные препараты как ингибиторы ферментов.
- •2. Неконкурентное ингибирование
- •3. Гормоны гипоталамуса и передней доли гипофиза, хим. Природа и био. Роль.
- •22 Билет
- •2. Дезаминирование аминокислот: прямое, непрямое. Виды прямого дезаминир-я. Окисл. Дезаминирование. Оксидазы l-аминокислот. Глутаматдегидрогеназа. Схема реакции, кофактор, регуляция процесса.
- •3. Передача сигналов через внутриклеточные рецепторы.. Строение рецептора ацетилхолина.
- •23 Билет
- •1. Ферменты, определение. Особенности ферментативного катализа. Специфичность действия ферментов, виды.
- •2. Транскрипция. Характеристика компонентов системы синтеза рнк. Структура днк-зависимой рнк-полимеразы. Инициация процесса. Элонгация, терминация транскрипции.
- •24 Билет
- •1. Принципы классификации белков. Классификация по составу и биологическим функциям, примеры представителей отдельных классов.
- •2. Повреждения и репарация днк. Виды повреждений. Способы репарации. Дефекты репарационных систем и наследственные болезни.
- •3. Циклические амф и гмф как вторичные посредники. Активация протеинкиназ и фосфорилирование белков, ответственных за проявление гормонального эффекта.
- •25 Билет
- •2. Непрямое дезаминирование ак. Схема процесса, субстраты, ферменты, кофакторы.
- •26 Билет
- •1. Физико-химические свойства белков. Молек. Масса, размеры и форма, растворимость, ионизация и гидратация. Денатурация - признаки и причины.
- •2. Аэробный гликолиз. Последовательность реакций до образования пирувата (аэробный гликолиз). Значение. Использование глюкозы для синтеза жиров. Энергетический эффект аэробного распада глюкозы.
- •3. Классификация гормонов по хим. Строению и биологическим функциям.
- •27 Билет
- •1.Четвертичная структура белков. Особенности строения и функционирования олигомерных белков на примере гемоглобина. Кооперативные изменения конформации протомеров.
- •2. Цтк: реакции и характ-ка ферментов. Роль цикла в метаболизме.
- •28 Билет
- •1. Биологические мембраны, строение, функции и общие свойства: жидкостность, поперечная асимметрия, избирательная проницаемость.
- •1. Структура и свойства липидов мембран
- •2. Первичный транскрипт и его процессинг. Рибозимы как пример каталитической активности нуклеиновых кислот. Биороль.
- •3. Гемоглобины человека, структура. Транспорт кислорода и диоксида углерода. Гемоглобин плода и его физиолог. Значение. Гемоглобинопатии.
- •29 Билет
- •1. Липиды. Общая характеристика. Биологическая роль. Классификация липидов. Вжк, особенности строения. Полиеновые жк. Триацилглицеролы.
- •2. Элонгация и терминация репликации. Ферменты. Асимметричный синтез днк. Фрагменты оказаки. Роль днк-лигазы.
- •3. Белки сыв. Крови. Энзимодиагностика. АктивносТь аминотрансфераз .
- •30 Билет
- •1. Переваривание липидов пищи. Всасывание продуктов. Нарушения переваривания и всасывания. Ресинтез триацилглицеролов. Образование хиломикронов и транспорт жиров. Липопротеинлипаза, её роль.
- •2. Репликация. Принципы репликации днк. Стадии репликации.
- •3. Коллаген: особенности ак-состава, первичной и пространственной структуры. Особенности биосинтеза и созревания коллагена.
- •31 Билет
- •1. Активный центр белков и его специфическое взаимодействие с лигандом. Конформационная лабильность белков. Комплементарность.
- •2. Распад жирных кислот в клетке. Β-Окисление жк, энергетический эффект.
- •3. Структурная организация межклеточного матрикса. Адгезивные белки. Строение и функции гликозаминогликанов. Структура протеогликанов.
- •32 Билет
- •1. Третичная структура белков. Супервторичная структура. Доменная структура. Роль шаперонов в формировании 3 структуры белков invivo.
- •2. Анаэробный гликолиз. Распространение и физиологическое значение. Энергетический эффект.
- •3. Молекулярная структура миофибрилл. Структура и функция белков миофибрилл миозина, актина, тропомиозина, тропонина.
- •33 Билет
- •1. Вторичная структура белков. Связи, стабилизирующие 2 структуру.
- •2. Холестерин. Пути поступления, использования и выведения из организма.Биосинтез холестерина, его этапы. Регуляция синтеза.
- •3. Биохимические механизмы мышечного сокращения и расслабления. Роль ионов кальция в сокращении. Особенности энергетического обмена в мышцах; роль креатинфосфата.
- •34 Билет
- •1. Переваривание белков: протеазы жкт, их активация и специфичность, оптимум рн и результат действия. Образование и роль соляной кислоты в желудке. Защита клеток от действия протеаз.
- •2. Биосинтез глюкозы (глюконеогенез). Цикл кори.
- •3. Химический состав нервной ткани. Миелиновые мембраны. Энергетический обмен в нервной ткани. Значение аэробного распада глюкозы. Медиаторы нс. Физиологически активные пептиды мозга.
- •35 Билет
- •1. Первичная структура белков. Пептидная связь. Гемоглобин s
- •2.Синтез гема, всас-е железа, транспорт в крови,
- •3. Значение воды для жизнедеятельности организма. Водный баланс, регуляция водного обмена.
1 Билет
1.Биологическая химия — это наука, изучающая химический состав живых организмов, превращения веществ и энергии, лежащей в основе их жизнедеятельности. Совокупность этих превращений составляет биологический обмен веществ, который является основой той формы движения материи, которую мы называем жизнью.
Биохимию разделяют на:
Статическую, изучающую химический состав живой материи;
Динамическую, изучающую процессы обмена веществ в организме;
Функциональную, изучающую процессы, лежащие в основе определенных проявлений жизнедеятельности.
Биохимические показатели биологических сред организма человека широко используются при:
постановке диагноза заболевания, особенно дифференциального диагноза;
выборе метода лечения;
контроле за правильностью назначенного лечения;
результаты биохимических анализов служат одним из критериев излеченности патологического процесса;
скрининге (выявлении болезни на доклинической стадии);
мониторинге (контроле за течением заболевания);
прогнозе (информации о возможном исходе заболевания).
2.К кетоновым телам относят β-гидроксибутират, ацетоацетат и ацетон. Первые две молекулы могут окисляться в тканях, обеспечивая синтез АТФ. Ацетон образуется только при высоких концентрациях кетоновых тел в крови и, выделяясь с мочой, выдыхаемым воздухом и потом, позволяет организму избавляться от избытка кетоновых тел. Регуляторный фермент синтеза кетоновых тел (ГМГ-КоА-синтаза) ингибируется свободным КоА. - реакция идёт неферментативно при высокой концентрации кетоновых тел в крови.
Окисление
кетоновых тел в периферических тканях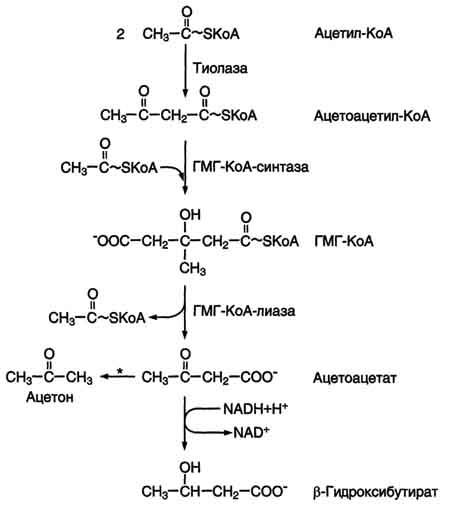
При длительном голодании кетоновые тела становятся основным источником энергии для скелетных мышц, сердца и почек.
3. Иммуноглобулины, или антитела, - специфические белки, вырабатываемые В-лимфоцитами в ответ на попадание в организм чужеродных структур, называемых антигенами. В организме человека вырабатывается около 107 клонов В-лимфоцитов, каждый из которых специализирован на выработке одного из 107 видов иммуноглобулинов.
Все иммуноглобулины характеризуются общим планом строения, который мы рассмотрим на примере строения IgG.
2 Билет
1. Генетический код – это способ кодирования информации о строении белков в виде нуклеотидной последовательности. Он обладает характерными особенностями:
Триплетность – три нуклеотида формируют кодон, кодирующий аминокислоту.
Специфичность – каждому кодону соответствует только одна аминокислота.
Вырожденность – одной аминокислоте может соответствовать несколько кодонов.Универсальность – биологический код одинаков для всех видов организмов на Земле.Колинеарность – последовательность кодонов соответствует последовательности аминокислот в кодируемом белке.
Неперекрываемость – триплеты не накладываются друг на друга, располагаясь рядом.Отсутствие знаков препинания – между триплетами нет дополнительных нуклеотидов или каких-либо иных сигналов. Однонаправленность – при синтезе белка считывание кодонов идет последовательно, без пропусков или возвратов назад
Аминокислоты
Все 20 аминокислот, входящих в структуру белков организма человека, должны присутствовать в достаточном количестве. Это требование прежде всего относится к незаменимым аминокислотам, так как недостаточное снабжение клетки хотя бы одной незаменимой аминокислотой приводит к снижению, а иногда и полной остановке синтеза белка на кодоне, требующем включения этой аминокислоты в белок.
2. Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию - отщеплению ос-карбоксильной группы. Продуктами реакции являются СО2 и амины, которые оказывают выраженное биологическое действие на организм (биогенные амины):
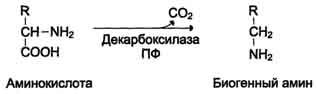
Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами. Простетическая группа декарбоксилаз в клетках животных - пиридоксальфосфат.
Серотонин - нейромедиатор проводящих путей. Образуется в надпочечниках и ЦНС из аминокислоты 5-гидрокситриптофана в результате действия декарбоксилазы ароматических аминокислот.
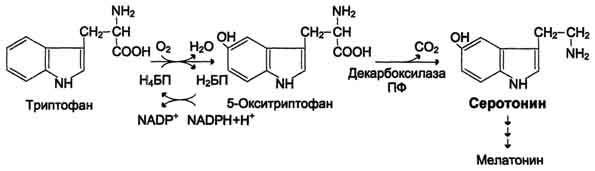
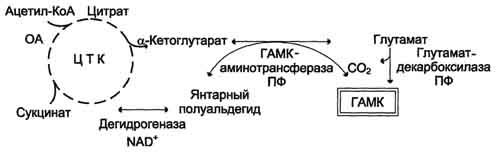
Цикл превращений ГАМК в мозге включает три сопряжённые реакции, получившие название ГАМК-шунта.
Гистамин образуется путем декарбоксилирования гистидина в тучных клетках соединительной ткани. Функции: стимулирует секрецию желудочного сока, слюны (т.е. играет роль пищеварительного гормона);
повышает проницаемость капилляров, вызывает отёки, снижает АД; сокращает гладкую мускулатуру лёгких, вызывает удушье.
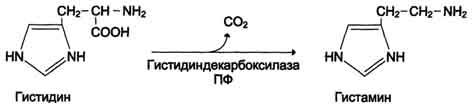
Дезаминирование аминокислот - реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака.
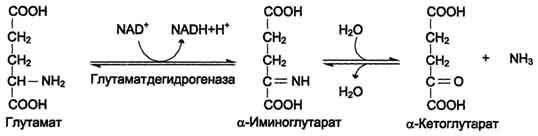
1. Окислительное дезаминирование
Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты.
Глутаматдегидрогеназа может индуцироваться стероидными гормонами (кортизолом).
2. Непрямое дезаминирование
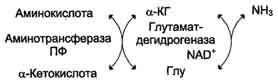
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD+).
3. Ферменты, катализирующие одну и ту же химическую реакцию, но отличающиеся по первичной структуре белка, называют изоферментами. Они катализируют один и тот же тип реакции с принципиально одинаковым механизмом, но отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента.
По своей структуре изоферменты в основном являются олигомерными белками. Причём та или иная ткань преимущественно синтезирует определённые виды протомеров. В результате определённой комбинации этих протомеров формируются ферменты с различной структурой - изомерные формы.
