
- •2 Аминокислоты, входящие в состав белков, их строение и свойства. Биологическая
- •1. Общие структурные особенности аминокислот, входящих в состав белков
- •2. Классификация аминокислот по химическому строению радикалов
- •3. Классификация аминокислот по растворимости их радикалов в воде
- •2.Характеристика пептидной связи
- •4. Вторичная структура белков. Связи стабилизирующие вторичную структуру.
- •1. Классификации шаперонов (ш)
- •2. Роль шаперонов в фолдинге белков
- •8 . Физико-химические свойства белков. Молекулярная масса, размеры и форма, растворимость, гидротация и ионизация. Денатурация, признаки и факторы ее вызывающие.
- •10. Принципы классификации белков. Классификация по составу и биологическим функциям, примеры представителей отдельных классов.
- •11. Иммуноглобулины, классы иммуноглобулинов, особенности доменного строения и
- •13. Классификация и номенклатура ферментов, примеры
- •1. Оксидоредукпшзы
- •2.Трансферты
- •3.Гидролазы
- •4. Лиазы
- •5. Изомеразы
- •6. Лигазы (синтетазы)
- •15. Кинетика ферментативных реакций. Зависимость скорости ферментативной реакции от температуры, рН среды, концентрации ферментов и субстрата. Уравнение Михаэлиса-Ментен, Кm.
- •16. Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр, в2 на примере трансаминаз и дегидрогеназ.
- •17. Ингибирование активности ферментов: обратимое (конкурентное и неконкурентное)
- •1. Конкурентное ингибирование
- •2. Неконкурентное ингибирование
- •19. Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования.
- •20. Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции протеолитической активности ферментов.
- •21. Изоферменты: происхождение, биологическое значение, примеры. Определение ферментов и изоферментного спектра плазмы крови с целью диагностики заболеваний.
- •22. Энзимопатии наследственные (фенилкетонурия) и приобретенные (цинга). Применение ферментов для лечения болезней.
- •23. Общая схема синтеза и распада пиримидиновых нуклеотидов. Регуляция. Оротоцидурия.
- •24. Общая схема синтеза и распада пуриновых нуклеотидов. Регуляция. Подагра.
- •27. Гибридизация нуклеиновых кислот. Денатурация и ренативация днк. Гибридизация (днк-днк, днк-рнк). Методы лабораторной диагностики, основанные на гибридизации нуклеиновых кислот.
- •29. Репликация. Принципы репликации днк. Стадии репликации. Инициация. Белки и ферменты, принимающие участие в формировании репликативной вилки.
- •30. Элонгация и терминация репликации. Ферменты. Асимметричный синтез днк. Фрагменты Оказаки. Роль днк-лигазы в формировании непрерывной и отстающей цепи.
- •31. Повреждения и репарация днк. Виды повреждений. Способы репарации. Дефекты репарационных систем и наследственные болезни.
- •32. Транскрипция. Характеристика компонентов системы синтеза рнк. Структура днк-зависимой рнк-полимеразы: роль субъединиц. Инициация процесса. Элонгация, терминация, транскрипция.
- •33. Первичный транскрипт и его процессинг. Рибозимы как пример каталитической активности нуклеиновых кислот. Биороль.
- •34. Генетический код и его свойства. Основные компоненты белоксинтезирующей системы: аминокислоты, аминоацил-т-рнк синтетазы т-рнк, рибосомы, источник энергии, белковые факторы, ферменты.
- •35. Сборка полипептидной цепи на рибосоме. Образование инициаторного комплекса. Элонгация: образование пептидной связи (реакция транспептидации). Транслокация. Транслоказа. Терминация.
- •1. Инициация
- •2. Элонгация
- •3. Терминация
- •36. Особенности синтеза и процессинга секретируемых белков (на примере коллагена и инсулина).
- •37. Биохимия питания. Основные компоненты пищи человека, их биороль, суточная потребность в них. Незаменимые компоненты пищи.
- •38. Белковое питание. Биологическая ценность белков. Азотистый баланс. Полноценность белкового питания, нормы белка в питании, белковая недостаточность.
- •39. Переваривание белков: протеазы жкт, их активация и специфичность, оптимум рН и результат действия. Образование и роль соляной кислоты в желудке. Защита клеток от действия протеаз.
- •40. Всасывание продуктов переваривания. Транспорт ак в клетки кишечника. Особенности транспорта ак в гепатоцитах. Y-глутамильный цикл. Нарушение переваривания и всасывания ак.
- •42. Минеральные вещества пищи, макро- и микроэлементы, биологическая роль. Региональные патологии, связанные с недостатком микроэлементов.
- •43. Биологические мембраны, строение, функции и общие свойства: жидкостность, поперечная ассиметрия, избирательная проницаемость.
- •1. Структура и свойства липидов мембран
- •2. Трансмембранная асимметрия липидов
- •3. Жидкостностъ мембран
- •4. Функции мембранных липидов
- •45. Механизм переноса веществ через мембраны: простая диффузия, пассивный симпорт и антипорт, активный транспорт, регулируемые каналы. Мембранные рецепторы.
- •1. Первично-активный транспорт
- •2. Вторично-активный транспорт
- •46. Эндергонические и экзергонические реакции живой клетки. Макроэргические соединения, определение, пример.
- •4. Сопряжение экзергонических и эндергонических процессов в организме
- •2. Цепь переноса электронов от nadh и fadh2 на кислород
- •50. Образование активных форм кислорода(синглетный кислород, пероксид водорода, гидроксильный радикал). Место образоваия, схемы реакций. Физиологическая роль афк.
- •51. Механизм повреждающего действия активных форм кислорода на клетки (пол, окисление белков и нуклеиновых кислот). Примеры реакций.
- •1. Строение пируватдегидрогеназного комплекса
- •2. Окислительное декарбоксилирование пирувата
- •3. Связь окислительного декарбоксилирования пирувата с цпэ
- •53. Цикл лимонной кислоты: последовательность реакций и характеристика ферментов. Роль цикла в метаболизме.
- •57. Аэробный гликолиз. Последовательность реакций до образования пирувата (аэробный гликолиз). Использование глюкозы для синтеза жиров. Энергетический эффект аэробного распада глюкозы.
- •1. Этапы аэробного гликолиза
- •2. Реакции аэробного гликолиза
- •1. Реакции анаэробного гликолиза
- •60. Гликоген, биологическое значение. Биосинтез и мобилизация гликогена. Регуляция синтеза и распада гликогена. Обмен гликогена в анте- и неонатальном периоде.
- •61. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, непереносимость фруктозы и дисахаридов, эссенциальная фруктоземия. Гликогенозы и агликогенозы.
- •62. Липиды. Общая характеристика. Биологическая роль. Классификация липидов. Высшие жирные кислоты, особенности строения. Полиеновые жирные кислоты. Триацилглицеролы.
- •65. Депонирование и мобилизация жиров в жировой ткани, физиологическая роль этих процессов. Роль инсулина, адреналина и глюкагона в регуляции метобализма жира.
- •67. Биосинтез жирных кислот. Основные стадии процесса. Регуляция обмена жирных кислот.
- •69. Холестерин. Пути поступления, использования и выведения из организма. Уровень холестерина в сыворотке крови. Биосинтез холестерина, его этапы. Регуляция синтеза.
- •74. Непрямое дезаминирование аминокислот. Схема процесса, субстраты, ферменты, кофакторы.
- •1. Синтез и биологическая роль серотонина
- •1. Окислительное дезаминирование
- •2. Непрямое дезаминирование (трансдезаминирование)
- •3. Неокислительное дезамитровате
- •1. Метаболизм феиилаланина
- •2. Особенности обмена тирозина в разных тканях
- •3. Заболевания, связанные с нарушением обмена фенилаланина и тирозина
- •1. Классификация гормонов по химическому строению
- •2. Классификация гормонов по биологическим функциям
- •3. Передача сигналов через рецепторы, сопряжённые с ионными каналами
- •1. Гормон роста, пролактин
- •2. Тиреотропин, лютеинизирующий гормони фолликулостимулирующий гормон
- •3. Группа гормонов, образующихсяиз проопиомеланокортина
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •2. Роль системы ренин-ангиотензин- альдостерон в регуляции водно-солевого обмена
- •3. Восстановление объёма крови при обезвоживании организма
- •4. Гиперальдостеронтм
- •1. Синтез и секреция птг
- •2. Роль паратгормона в регуляции обмена кальция и фосфатов
- •3. Гиперпаратиреоз
- •4. Гипопаратиреоз
- •1. Строение и синтез кальцитриола
- •2. Механизм действия кальцитриола
- •3. Рахит
- •2. Биологические функции инсулина
- •3. Механизм действия инсулина
- •1. Изменения метаболизма в печени в абсорбтивном периоде
- •2. Изменения метаболизма в адипоцитах
- •3. Изменение метаболизма в мышцах в абсорбтивном периоде
- •1. Изменения метаболизма в печени
- •2. Изменения метаболизма в жировой ткани
- •1. Инсулинзависимый сахарный диабет
- •2. Инсулинонезависимый сахарный диабет
- •1. Симптомы сахарного диабета
- •2. Острые осложнения сахарного диабета. Механизмы развития диабетической комы
- •3. Поздние осложнения сахарного диабета
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •2. Функционирование цитохрома р450
- •3. Свойства системы микросомального окисления
- •1. Причины, приводящие к увеличению количества ферментов в крови
- •2. Изоферменты
- •3. Энзимодиагностика при инфаркте миокарда
- •1. Простые белки
- •1. Безмиелиновое волокно
- •2. Миелиновое волокно
67. Биосинтез жирных кислот. Основные стадии процесса. Регуляция обмена жирных кислот.
Синтез жиров в жировой ткани и печени
Синтез жиров происходит в абсорбтивный период в печени и жировой ткани. Непосредственными субстратами в синтезе жиров являются ацил-КоА и глицерол-3-фосфат. Метаболический путь синтеза жиров в печени и жировой ткани одинаков, за исключением разных путей образования глицерол-3-фосфата.
Образование глицерол-3-фосфата
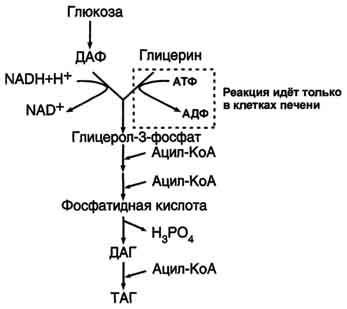
Синтез жиров в печени и жировой ткани идёт через образование промежуточного продукта - фосфатидной кислоты (рис. 8-21).
Предшественник фосфатидной кислоты - глицерол-3-фосфат, образующийся в печени двумя путями:
восстановлением дигидроксиацетонфосфата - промежуточного метаболита гликолиза;
фосфорилированием глицеролкиназой свободного глицерола, поступающего в печень из крови (продукт действия ЛП-липазы на жиры ХМ и ЛПОНП).
В жировой ткани глицеролкиназа отсутствует, и восстановление дигидроксиацетонфосфата - единственный путь образования глицерол-3-фосфата. Следовательно, синтез жиров в жировой ткани может происходить только в абсорбтивный период, когда глюкоза поступает в адипоциты с помощью белка-переносчика глюкозы ГЛЮТ-4, активного только в присутствии инсулина, и распадается по пути гликолиза.
Синтез жиров в жировой ткани
В жировой ткани для синтеза жиров используются в основном жирные кислоты, освободившиеся при гидролизе жиров ХМ и ЛПОНП (рис. 8-22). Жирные кислоты поступают в адипоциты, превращаются в производные КоА и взаимодействуют с глицерол-3-фосфатом, образуя сначала лизофосфатидную кислоту, а затем фосфатидную. Фосфатидная кислота после дефосфорилирования превращается в диацилглицерол, который ацилируется с образованием триацилглицерола.
Кроме жирных кислот, поступающих в адипоциты из крови, в этих клетках идёт и синтез жирных кислот из продуктов распада глюкозы. В адипоцитах для обеспечения реакций синтеза жира распад глюкозы идёт по двум путям: гликолиз, обеспечивающий образование глицерол-3-фосфата и ацетил-КоА, и пентозофосфатный путь, окислительные реакции которого обеспечивают образование NADPH, служащего донором водорода в реакциях синтеза жирных кислот.
Молекулы жиров в адипоцитах объединяются в крупные жировые капли, не содержащие воды, и поэтому являются наиболее компактной формой хранения топливных молекул. Подсчитано, что, если бы энергия, запасаемая в жирах, хранилась в форме сильно гидратированных молекул гликогена, то масса тела человека увеличилась бы на 14-15 кг.
Синтез ТАГ в печени. Образование ЛПОНП в печени и транспорт жиров в другие ткани
Печень - основной орган, где идёт синтез жирных кислот из продуктов гликолиза. В гладком ЭР гепатоцитов жирные кислоты активируются и сразу же используются для синтеза жиров, взаимодействуя с глицерол-3-фосфатом. Как и в жировой ткани, синтез жиров идёт через образование фосфатидной кислоты. Синтезированные в печени жиры упаковываются в ЛПОНП и сек-ретируются в кровь.
В состав ЛПОНП, кроме жиров, входят холестерол, фосфолипиды и белок - апоВ-100. Это очень "длинный" белок, содержащий 11 536 аминокислот. Одна молекула апоВ-100 покрывает поверхность всего липопротеина.
ЛПОНП из печени секретируются в кровь, где на них, как и на ХМ, действует ЛП-липаза. Жирные кислоты поступают в ткани, в частности в адипоциты, и используются для синтеза жиров. В процессе удаления жиров из ЛПОНП под действием ЛП-липазы ЛПОНП сначала превращаются в ЛГШП, а затем в ЛПНП. В ЛПНП основными липидными компонентами служат холестерол и его эфиры, поэтому ЛПНП являются липопротеинами, доставляющими холестерол в периферические ткани. Глицерол, освободившийся из липопротеинов, кровью транспортируется в печень, где опять может использоваться для синтеза жиров.
Скорость синтеза жирных кислот и жиров в печени существенно зависит от состава пищи. Если в пище содержится более 10% жиров, то скорость синтеза жиров в печени резко снижается.
Лимитирующим ферментом является ацетил-КоАкарбоксилаза. Аллостерические активаторы — АТФ и цитрат, ингибиторы — жирные кислоты с длинной цепью. Инсулин, эстрогены активиру¬ют, катехоламины и стресс ингибируют синтез жирных кислот. Значение:при распаде УВ обр ацетил-Коа, который используется в синтезе ЖК, т.о. избыток УВ запасается в виде жира.
68. Кетоновые тела, биосинтез и использование в качестве источников энергии. Причины развития кетонемии и кетонурии при голодании и сахарном диабете. Склонность к кетозу у детей.
Рис.
8-32. Активация синтеза кетоновых тел при
голодании. Точечные
линии - скорость метаболических путей
снижена; сплошные линии - скорость
метаболических путей повышена. При
голодании в результате действия глюкагона
активируются липолиз в жировой ткани
и (3-окисление в печени. Количество
оксалоацетата в митохондриях уменьшается,
так как он, восстановившись до малата,
выходит в цитозоль, где опять превращается
в Оксалоацетат и используется в
глюконеогенезе. В результате скорость
реакций ЦТК снижается и, соответственно,
замедляется окисление ацетил-КоА.
Концентрация ацетил-КоА в митохондриях
увеличивается, и активируется синтез
кетоновых тел. Синтез кетоновых тел
увеличивается также при сахарном
диабете.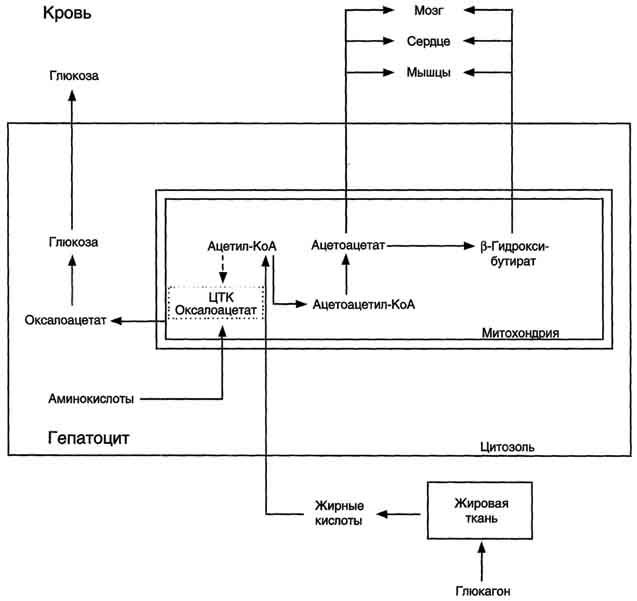
К кетоновым телам относят β-гидроксибутират, ацетоацетат и ацетон. Первые две молекулы могут окисляться в тканях, обеспечивая синтез АТФ. Ацетон образуется только при высоких концентрациях кетоновых тел в крови и, выделяясь с мочой, выдыхаемым воздухом и потом, позволяет организму избавляться от избытка кетоновых тел. Синтез кетоновых тел в печени. При низком соотношении инсулин/глюкагон в крови в жировой ткани активируется распад жиров. Жирные кислоты поступают в печень в большем количестве, чем в норме, поэтому увеличивается скорость β-окисления. Скорость реакций ЦТК в этих условиях снижена, так как оксалоацетат используется для глюконеогенеза. В результате скорость образования ацетил-КоА превышает способность ЦТК окислять его. Ацетил-КоА накапливается в митохондриях печени и используется для синтеза кетоновых тел. Синтез кетоновых тел происходит только в митохондриях печени.
Синтез кетоновых тел начинается с взаимодействия двух молекул ацетил-КоА, которые под действием фермента тиолазы образуют ацетоацетил-КоА. С ацетоацетил-КоА взаимодействует третья молекула ацетил-КоА, образуя 3-гидрокси-3-метилглутарил-КоА (ГМГ-КоА). Эту реакцию катализирует фермент ГМГ-КоА-синтаза. Далее ГМГ-КоА-лиаза катализирует расщепление ГМГ-КоА на свободный ацетоацетат и ацетил-КоА.
Ацетоацетат может выделяться в кровь или превращаться в печени в другое кетоновое тело - β-гидроксибутират путём восстановления.
В
клетках печени при активном β-окислении
создаётся высокая концентрация NADH. Это
способствует превращению большей части
ацетоацетата в β-гидроксибутират,
поэтому основное кетоновое тело в крови
- именно β-гидроксибутират. При голодании
для многих тканей жирные кислоты и
кетоновые тела становятся основными
топливными молекулами. Глюкоза
используется в первую очередь нервной
тканью и эритроцитами.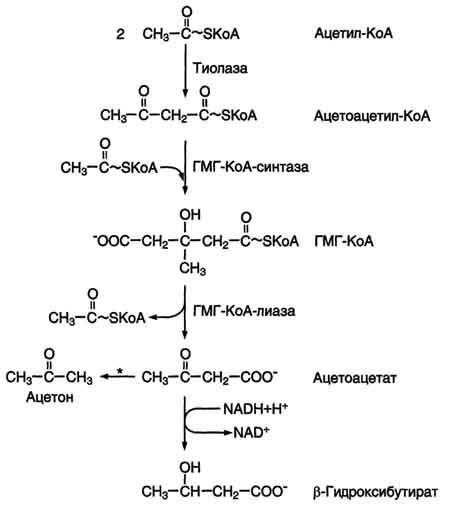
При высокой концентрации ацетоацетата часть его неферментативно декарбоксилируется, превращаясь в ацетон. Ацетон не утилизируется тканями, но выделяется с выдыхаемым воздухом и мочой. Таким путём организм удаляет избыточное количество кетоновых тел, которые не успевают окисляться, но, являясь водорастворимыми кислотами, вызывают ацидоз.
Рис. 8-33. Синтез кетоновых тел в митохондриях гепатоцитов. Регуляторный фермент синтеза кетоновых тел (ГМГ-КоА-синтаза) ингибируется свободным КоА. - реакция идёт неферментативно при высокой концентрации кетоновых тел в крови.
Окисление кетоновых тел в периферических тканях
При длительном голодании кетоновые тела становятся основным источником энергии для скелетных мышц, сердца и почек. Таким образом глюкоза сохраняется для окисления в мозге и эритроцитах. Уже через 2-3 дня после начала голодания концентрация кетоновых тел в крови достаточна для того, чтобы они проходили в клетки мозга и окислялись, снижая его потребности в глюкозе.
β-Гидроксибутират, попадая в клетки, дегидрируется NAD-зависимой дегидрогеназой и превращается в ацетоацетат. Ацетоацетат активируется, взаимодействуя с сукцинил-КоА - донором КоА:
Ацетоацетат + Сукцинил-КоА → Ацетоацетил- КоА + Сукцинат.
У детей до 7 лет отмечается повышенная склонность к кетозам. Они могут развиваться под влиянием различных причин: кратковременное голодание, переутомление, перевозбуждение, инфекционные заболевания. Вследствие неустойчивости углеводного обмена и малых запасов гликогена удовлетворение энергозатрат происходит за счет интенсивного окисления СЖК. Из-за несовершенства выделительной системы почек, образующиеся при этом кетоновые тела накапливаются в крови, вызывая приступы неукротимой рвоты «ацетонемическая рвота»
