
- •142. До яких систем застосовується закон термодинаміки. Що таке ентропія.
- •144. Що таке оборотні і необоротні процеси. Приклади
- •149. Правило фаз Гіббса. Визначення понять фаза, компонент, ступінь свободи.
- •153. Теорія електролітичної дисоціації. Що таке ступінь електролітичної дисоціації, що таке ізотонічний коефіцієнт. Як вони пов’язані між собою.
- •156. Форма залежності питомої електричної провідності від концентрації.
- •158. Залежність швидкості хімічної реакції від концентрації речовин. Що таке константа швидкості. Закон діючих мас
- •163. Залежність хімічної реакції від температури. «Енергія активації»
- •165. Каталіз і каталізатори. Особливості каталізаторів і каталітичних реакцій.
- •166.Поверхневий натяг рідини і твердих тіл. Як виникає і якими факторами визначається.
- •1.Які існують методи якісного аналізу? Що таке специфічна реакція?
- •5. Дайте загальну характеристику катіонів 2 аналітичної групи.
- •7. Які основні вимоги до аналітичних реакцій?
- •8. Охарактеризуйте розчинність хлоридів Ag, Hg,Pbу воді і розчині аміаку. Напишіть рівняння реакції.
- •11.Основні положення теорії електролітичної дисоціації.Що таке ступінь і константа дисоціації?
- •38. Які найбільш характерні реакції для йонів Hg, Cd?
- •40. Наведіть послідовність визначення аніонів Cl , Br , I . Яке значення мають органічні розчинники у визначенні галогенів?
- •54. Які попередні випробування треба зробити перед аналізом солі.
- •64.Умови, які висувають для осадів у ваговому методі.
- •67.Що означає прожарювати тиглі до постійної маси.
- •70. Які речовини використовують для стандартизації робочих розчинів.
- •90. Які речовмнм називають оптично активними? Дати визначення поняттям: хоральна молекула, асиметричний атом карбону, енантіомер, рацемічна суміш.
- •94.Які сполуки називають дисахаридами? Глікозидний зв'язок. Навести схему гідролізу сахарози і що таке інвертний цукор?
- •133. У чому різниця між поляризацією і рефракцією?
- •137.Які види міжмолекулярної взаємодії? Яка їх природа і як на них впливає температура?
- •138. Дайте визначення понять система, процес, параметри, функція стану, теплота утворення, теплота розкладу, теплота згорання, тепловий ефект хімічної реакції.
- •132. Чим характеризуються електричні властивості полярних молекул? Навести формулу для обчислення дипольного моменту молекул?
- •139. Закон Гесса.
- •167. Які особливості процесу адсорбції поверхнево-активних речовин на поверхні рідин? Яке співвідношення існує між концентрацією розчиненої речовини, поверхневим натягом і абсорбцією?
- •169. Наведіть рівняння ізотерми адсорбції Фрейндліха. Як визначити значення констант у рі-нні Фрейндліха? Які переваги і недоліки ізотерми адсорбції Фрейндліха?
- •170. У чому особливості процесів адсорбції на твердих на твердих адсорбентах. Наведіть основні положення теорії адсорбції Ленгмюра.
- •171. Охарактеризуйте гідрофільну і гідрофобні поверхні. Змочування? Як можна гідрофобізувати гідрофільну поверхню?
- •172. У чому особливості адсорбції їз озчину твердим адсорбентом? Правило вирівнювання полярностей Рибіндера.
- •173. Охарактеризуйте особливості іонної адсорбції.
- •174. Типи дисперсних систем у відповідності до їх агрегатного стану і властивостей.
- •175. Що розуміють під ступенем дисперсності? Що таке дисперсність, гомогенність, гетерогенність?
- •176. Дати визначення колоїдного розчину? Перерахувати ознаки колоїдного стану.
- •177.Будова міцели.Правило Пєскова- Фаянса
- •181.Описати властивості порошків. Як запобігти їх злипанню?
- •182. Як одержують суспензії?властивості. Що таке пасти?
- •183.Властивості емульсій.Як визначити тип емульсії?
- •184. Коалесценція.
- •185.Класифікація емульсій за концентрацією.
- •188.Властивості пін.Використання
- •189.Аерозолі.
- •44. Як визначити фосфат в присутності SiO3
- •145. Принцип Ле-Шательє і визначити рівновагу реакції
169. Наведіть рівняння ізотерми адсорбції Фрейндліха. Як визначити значення констант у рі-нні Фрейндліха? Які переваги і недоліки ізотерми адсорбції Фрейндліха?
Рівняння Фрейндліха. За Г. Фрейндліхом, поверхня більшості адсорбентів неоднорідна, між адсорбованими частинками існує взаємодія, і адсорбція часто не обмежується утворенням мономолекулярного шару. І в цьому випадку рівняння ізотерми ускладнюється. Фрейндліх припустив, що маса адсорбованого газу чи розчиненої речовини, що припадає на одиницю маси адсорбенту, повинна бути пропорційна рівноважному тиску (для газу) чи рівноважній концентрації (для розчину) в певному дробовому степені. Це припущення виражається емпіричним рівнянням:
Ізотерма адсорбції Фрейндліха відрізняється від ізотерми Ленгмюра відсутністю зони насичення.
Рівняння Фрейндліха збігається з дослідними даними лише для малих і середніх концентрацій, для великих концентрацій воно не справджується.
170. У чому особливості процесів адсорбції на твердих на твердих адсорбентах. Наведіть основні положення теорії адсорбції Ленгмюра.
Наведений на рис. 14 типовий вид ізотерми адсорбції був по-яснений з позицій полімолекулярної адсорбції. Слід, однак, за-значити, що S-подібний вигляд ізотерми адсорбції можна отримати у процесі капілярної конденсації, характерної для адсорбції на сильно розвинених поверхнях. Розглянемо це явище докладніше. Явище капілярної конденсації зумовлене наявністю на пове-рхні адсорбента великої кількості дрібних nop. Пари адсорбату (газу) конденсуються в таких порах при тиску, істотно меншому за тиск насиченої пари над плоскою поверхнею, що зумовлено утворенням в капілярах увігнутих менісків рідини. Це є результа-том злиття рідких шарів, що утворилися на стінках капіляра в ре-зультаті адсорбції парів. Дійсно, увігнутий меніск формується тільки в тому випадку, коли рідина, що утворилася, добре змочує стінки капіляра. При формуванні випуклого меніска капілярна конденсація не спостерігається.
Для кількісної оцінки залежності тиску парів адсорбату над поверхнею ввігнутого меніска від параметрів капіляра і фізико-хімічних характеристик рідини Кельвін, використовуючи гіпсо-метричний закон Лапласа, вивів досить просту формулу:
Ps=Ps- ехр( мол) R1 -r
Де p's та ps - тиск парів над меніском і над плоскою поверхнею відповідно;
а- поверхневий натяг рідини;
Vмол - молярний об'єм рідини в капілярі;
г - радіус капіляра;T - температура;R - універсальна газова стала.
Рівняння (3.42) називають рівнянням Кельвіна. Воно дає можливість вирішувати практично весь спектр задач, пов'язаних з явищем капілярної конденсації. Так, при відомих ps (табличні дані) і г легко розрахувати p's (тобто тиск, вище якого спостері-гається явище капілярної конденсації в капілярах). 3 іншого боку, якщо відомі p's і ps, то можна розрахувати мінімальний радіус капілярів, у яких відбуватиметься конденсація, тобто здійснюва-ти правильний підбір адсорбента для конкретних виробничих ці-лей.
Для капілярної конденсації характерне явище гістерезису коли ізотерми адсорбції і десорбції не збігаються. Це явище докладно досліджували Ван-Беммелен і Зігмонді при кон-денсації води на силікагелі. На осі ординат відкладають кількість «w» поглиненої гелем вологи, на осі абсцис - значення рівнова-жного тиску її пари.Ділянка ОА відповідає наявності в силікагелі кристалізаційної води, яка може бути вилучена з адсорбента лише шляхом прожарю-вання. Ділянка АВ визначає оборотний процес адсорбції. Подаль-ший хід кривої відповідає необоротним процесам: тому самому зна-ченню вологи в адсорбенті відповідають різні значення тиску парів. Так, значення р^ відповідають випадку поглинання вологи, значен-ня р2 - процесу збезводнювання силікагелю. Відповідно, ділянки BED і DCB описують процеси адсорбції і десорбції.
Зазначимо також, що тиск парів у випадку адсорбції і десор-бції відрізняється, причому рі > р2. Це, згідно з моделлю Зігмон-ді, пояснюється розходженням характеру змочування в обох ви-падках, різними величинами кривизни менісків: меншій кривизні меніска відповідають більш високі значення тиску парів над його поверхнею.
Слід зазначити, що явище капілярної конденсації не слід плу-тати з процесом фізичної адсорбції. Принциповою відмінністю моделі капілярної конденсації від моделі фізичної адсорбції є те, що капілярна конденсація не враховує специфіки дії поверхневих сил. Вона відбувається внаслідок взаємодії тільки між молекула-ми адсорбату, але не між молекулами адсорбату й адсорбенту. Побічним доказом розходження механізмів капілярної конденса-ції і полімолекулярної адсорбції служить те, що полімолекулярна адсорбція може відбуватися на плоских безпористих поверхнях, у той час як капілярна в цих умовах неможлива.
Ha явищах адсорбції і, головним чином, на явищі капілярної конденсації заснований відомий виробничий процес - рекупера-ція, який полягає в уловлюванні й поверненні в технологічний процес летких компонентів, що беруть у ньому участь.
Викладені в попередніх параграфах цього розділу поло-ження ілюструють теорію мономолекулярної адсорбції Ленгмю-ра. Ізотерми адсорбції, відповідно до цієї теорії, характеризують-ся параметром Гх. . Передбача-ється, що адсорбція відбувається на активних центрах, які завжди присутні на поверхні адсорбента. На межі розділення фаз форму
ється мономолекулярний шар, причому сусідні молекули в ньому не взаємодіють.
Рівняння ізотерми адсорбції Ленгмюра добре узгоджується з експериментом, якщо адсорбція:
- зумовлена силами, близькими за своєю природою до хіміч-них сил;
- не ускладнюється побічними явищами типу дисоціації мо-лекул адсорбованого газу на поверхні адсорбентау.
Ці уявлення про характер адсорбційних процесів, висунуті Лен-гмюром, дають можливість пояснити так звану багатоступінчасту адсорбцію (рис. 13). Ізотерма адсорбції має своєрідний ступінчастий характер, який можна пояснити так. Якщо допустити, що на повер-хні адсорбента існують групи активних центрів, які розрізняються за своєю активністю, то перший ступінь ізотерми відповідає проце-су заповнення найбільш активних центрів, другий - процесу запов-нення центрів з більш низькою активністю, третій - процесу запов-нення центрів з ще більш низькою активністю і т.д.
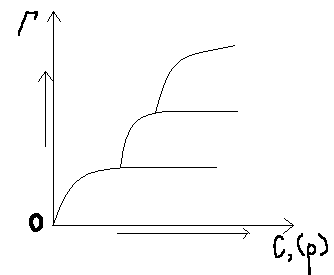
Рис. 13. Ступінчаста ізотерма адсорбції згідно з теорією Ленгмюра
Однак деякі випадки фізичної адсорбції не можна пояснити з позицій теорії мономолекулярної адсорбції Ленгмюра. Вони пот-ребують зовсім іншого підходу для опису процесу адсорбції.
Ha явищах адсорбції і, головним чином, на явищі капілярної конденсації заснований відомий виробничий процес - рекупера-ція, який полягає в уловлюванні й поверненні в технологічний процес летких компонентів, що беруть у ньому участь.
