
- •Розділ I
- •Порівняння проникності клітинних мембран для різних речовин. Стійкий і тимчасовий плазмоліз
- •1.1.2 Вплив іонів калію і кальцію на форму плазмолізу
- •1.1.3Спостереження ковпачкового плазмолізу в розчинах нітрату калію і роданіду калію
- •Проникність живої і мертвої цитоплазми
- •1.2 Виявлення життєздатності клітин
- •1.2.1 Визначення життєздатності насіння методом фарбування (за д. Н. Нелюбовим)
- •1.2.2 Прижиттєве фарбування клітин нейтральним червоним
- •Використання солей тетразолію для виявлення живих і мертвих клітин
- •1.3 Рух цитоплазми
- •1.3.1 Спостереження за рухом цитоплазми у різних об'єктів
- •1.3.2 Визначення швидкості руху цитоплазми
- •Контрольні питання.
- •Розділ II хімічний склад рослин Мета заняття.
- •Питання до обговорення.
- •2.1.1 Властивості рослинних білків
- •2.1.1.1 Виділення рослинних білків
- •1. Отримання проламінів і глютелінів з насіння пшениці
- •2. Отримання альбумінів з бульб картоплі
- •3. Отримання глобулінів з насіння гороху
- •2.1.1.2 Визначення амінокислотного складу рослинних білків за допомогою якісних реакцій
- •1.Биуретова реакція
- •2. Реакція на ароматичні амінокислоти (реакція нітрування)
- •3. Реакція на цистеїн (реакція Фоля)
- •Визначення ізоелектричної точки рослинних тканин
- •Вуглеводи
- •2.2.1 Отримання розчинів моно-, ді-, полісахаридів і вивчення їх
- •2.2.1.2 Визначення сахарів за допомогою якісних реакцій
- •1.1 Виявлення глюкози і мальтози
- •1.2 Виявлення сахарози
- •1.3 Виявлення крохмалю
- •2. Реакція з α-нафтолом
- •2.2.2 Кислотний гідроліз крохмалю
- •2.2.3 Ферментативний гідроліз крохмалю
- •2.3 Жири
- •2.3.1 Головні властивості жирів рослин
- •Визначення ліполітичної активності насіння
- •2. Визначення ліполітичної активності
- •Контрольні питання
- •Розділ III
- •3.1.1. Явище осмосу. Переміщення води за градієнтом водного потенціалу в штучній «клітинці» Траубе
- •3.1.2 Визначення осмотичного тиску клітинного соку плазмолітичним методом (за де-Фрізом)
- •3.1.3 Визначення сисної сили клітин за зміною концентрації розчинів
- •Рефрактометричний метод (за н. А. Максимовим і н. З. Петіновим)
- •Метод цівок (за в. С. Шардаковим)
- •3.1.3.3. Визначення водного потенціалу рослинних тканин методом Уршпрунга (за зміною довжини брусків тканини)
- •3.2. Водообмін рослин
- •3.2.1. Визначення різних форм води в рослині
- •3.2.2. Вплив зовнішніх умов на процес гутації
- •3.2.3. Визначення інтенсивності транспірації за зменшенням маси зрізаного листя
- •3.2.4. Порівняння транспірації верхньої і нижньої сторін листа хлоркобальтовим методом
- •3.2.5. Вплив зовнішніх умов на стан продихів (за Молішем)
- •3.2.6. Визначення стану продихів методом відбитків
- •Підняття води в рослині по судинах
- •Контрольні питання
- •Розділ IV
- •Хімічні властивості пігментів
- •Омилення хлорофілу лугом
- •Отримання феофітину і відновлення металоорганічного зв'язку
- •Розділення суміші фотосинтетичних пігментів
- •Метод Крауса
- •Метод Цвета
- •Метод хроматографії на папері
- •Оптичні властивості пігментів зеленого листа
- •Спектри поглинання пігментів
- •Флуоресценція хлорофілу
- •4.1.5 Кількісне визначення пігментів
- •4.1.5.1 Визначення вмісту хлорофілу
- •1.Отримання витяжки хлорофілу
- •2.Визначення концентрації хлорофілу на феКі
- •3.Визначення концентрації хлорофілу на сФі
- •4.1.5.2 Визначення вмісту каротинів
- •4.2 Фізіологія фотосинтезу
- •4.2.1 Фотосенсибілізуюча активність хлорофілу
- •4.2.2. Визначення інтенсивності фотосинтезу і дихання за зміною вмісту вуглецю
- •Контрольні питання.
- •Список рекомендованої літератури Основна література
- •Додаткова література
Визначення ізоелектричної точки рослинних тканин
Білки складають структурну основу цитоплазми. Найважливіші каталізатори живої клітини – ферменти – також є по своїй природі білковими речовинами. Білки здатні змінювати свої властивості під впливом різних чинників (рН, температура та ін.), що позначається на структурному і фізіологічному стані цитоплазми в цілому. Одна з причин цієї мінливості полягає в тому, що білкова молекула містить в собі як позитивні, так і негативні іони, а також іони, що несуть одночасно позитивні і негативні заряди. Відомо, що білки складаються з амінокислот, сполучених між собою пептидними зв'язками
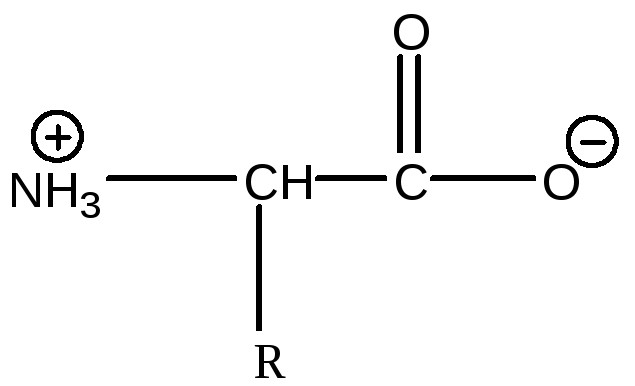
Кожна амінокислота має, принаймні, одну кислу і одну основну дисоціюючу групи, а саме карбоксильну і аміногрупу, тому амінокислоти є амфолітами і утворюють цвітеріони:
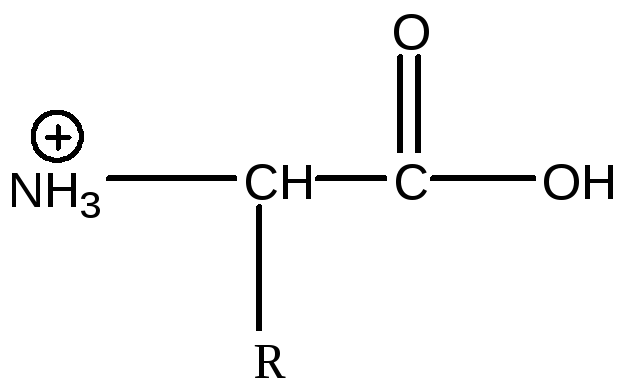
Разом з тим характер дисоціації непостійний і залежить від рН середовища. В кислих розчинах дисоціація йде по слаболужному типу, у зв'язку з чим амінокислоти виконують роль слабих основ, при дисоціації дають катіони:
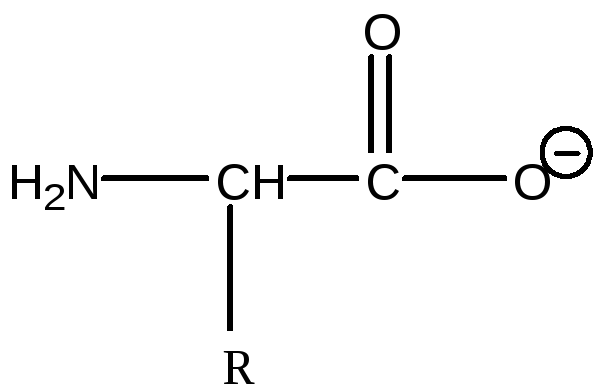
У присутності лугів амінокислоти при дисоціації утворюють аніони і поводяться як слабі кислоти:
В певній зоні рН дисоціація кислих і основних груп зрівнюється. Зона рН, в якій молекула білка стає електронейтральною, називається ізоелектричною точкою (ІЕТ). ІЕТ залежить від кількості вільних карбоксильних і аміногруп.
Завдяки наявності пептидного зв'язку в білках відсутні всі здатні до дисоціації вільні α-карбоксильні і α-аміногрупи, за винятком однієї кінцевої α-карбоксильної і α -аміногрупи. Проте в численних бічних ланцюгах білкової молекули є кислі і основні групи, що і обумовлює амфолітні властивості білків. Значення ІЕТ білка залежить не стільки від констант дисоціації, скільки від числа бічних ланцюгів з кислими і основними групами. Тому значення ІЕТ білків коливається в широких межах (глобулін зерна ячменю – 4,9, уреази кінських бобів – 7,2, пепсин – 1,0). Визначення ІЕТ протоплазми, безумовно, може дати відомості лише про деяку середню величину.
В ІЕТ молекула білка має мінімум електричних зарядів, а оскільки, ймовірно, зарядом визначається ступінь електростатичного притяжіння молекул води (гідратація, набухання), ІЕТ співпадає з мінімумом набухання і мінімумом розчинності білка.
Коли амфоліт дисоціює як основа, він зв'язує аніони. Це спостерігається при рН нижче його ІЕТ. В середовищі з рН вище ІЕТ амфоліт дисоціює як кислота і зв'язує катіони.
Визначення ІЕТ: при зануренні зрізів рослинних тканин в розчини з рН нижче за її ІЕТ, тканина утримує кислий барвник – еозин, у якого забарвлений аніон. В розчинах з рН вище за ІЕТ тканина утримує основний барвник – метиленовий синій, у якого забарвлений катіон. При визначенні ІЕТ окремого амфоліту спостерігається різкий перехід забарвлення від рожевого до синього. Для різних тканин перехід забарвлення від червоного до синього, знаходитиметься при різних значеннях рН.
Матеріали і обладнання: 1) 10-тиденні проростки квасолі, рицини; 2) препаровальне обладнання; 3) предметні і покривні скельця; 4) мікроскоп; 5) 70% етиловий спирт; 6) 0,1М розчин лимонної кислоти; 7) 0,2М розчин Na2HPO4; 8) 0,1% розчин еозину; 9) 0,01% розчин метиленового синього; 10) фарфорові чашки; 11) бюкси.
Хід роботи
Приготувати в бюксах буферні розчини з наступними значеннями рН: 2,2; 3,0; 3,6; 5,0; 5,4; 6,0; 7,0; 8,0, використовуючи табл. 2.2
Таблиця 2.2
|
№ |
рН |
0,2М розчин Na2HPO4 (в мл) |
0,1М розчин лимонної кислоти (в мл) |
|
1 |
2,2 |
0,20 |
9,80 |
|
2 |
3,0 |
2,05 |
7,95 |
|
3 |
3,6 |
3,22 |
6,78 |
|
4 |
5,0 |
5,15 |
4,85 |
|
5 |
5,4 |
5,57 |
4,43 |
|
6 |
6,0 |
6,31 |
3,69 |
|
7 |
7,0 |
8,23 |
1,77 |
|
8 |
8,0 |
9,72 |
0,28 |
Узяти чотири фарфорові чашки. В першу налити 3 – 5 мл 70% розчину етилового спирту, в другу – 3 мл 0,1% розчину еозину, в третю – 3 мл 0,01% розчину метиленового синього, в четверту – 5 мл дистильованої води.
Зробити 20 -25 тонких зрізів з досліджуваних об'єктів. Розглянути під мікроскопом і вибрати 16 найвдаліших. Занурити їх на 5 хвилин в першу фарфорову чашку, потім на 10 хвилин по черзі в інші. Потім занурити по 2 зрізи в буферні розчини з різними значеннями рН на 1,5 – 2 години.
Таблиця 2.3
|
Об‘єкт |
Тканина
|
Забарвлення тканини при різних рН |
Величина ІЕТ | |||||||
|
2,2 |
3,0 |
3,6 |
5,0 |
5,4 |
6,0 |
7,0 |
8,0 |
| ||
|
|
Ксилема |
|
|
|
|
|
|
|
|
|
|
Кора |
|
|
|
|
|
|
|
|
| |
Після закінчення вказаного терміну вийняти зрізи з буферних розчинів і помістити їх на предметне скло в певній послідовності. Накрити покривними скельцями і розглянути під мікроскопом. Окремі ділянки зрізу забарвляться по-різному. При рН нижче ІЕТ тканина забарвиться в рожевий колір, при рН вище ІЕТ – в синій. Якщо величина рН буферного розчину відповідає ІЕТ, тканина набуває бузкового або фіолетового забарвлення, оскільки адсорбуються в рівному ступені метиленовий синій і еозин. Якщо перехідне забарвлення не спостерігається, то ІЕТ обчислюють як середню з двох сусідніх показників. У тому випадку, коли цитоплазма кліток має суміш різних амфолітів, перехід забарвлення з одного в інше відбуватиметься в широкому діапазоні.
Завдання: заповнити таблицю 2.3 і визначити величину ІЕТ в досліджуваному об'єкті.
