
- •1. Матеріалознавство. Дайте визначення. Пояснити взаємозв’язок між будовою, кристалічною структурою матеріалу і його властивостями. Наведіть приклади.
- •2. Матеріалознавство. Структура та будова матеріалів. Макроструктура, мікроструктура. Тонка структура, пориста структура. Дати визначення.
- •3. Методи дослідження макроструктури. Наведіть приклади органолептичної оцінки якості та властивостей товарів.
- •4. Формування тонкої структури матеріалів. Методи дослідження. Пори. Розміри і форма пор. Наведіть приклади взаємозв’язку між пористістю матеріалу і його властивостями.
- •Загальна інформація
- •Різновиди Густина відносна
- •Густина дійсна
- •9. Принципи побудови композиційних матеріалів будівельного призначення. Основні елементи композиційних композиційного матеріалу. Дайте їх визначення.
- •11. Приклади композиційної побудови матеріалів будівельного призначенняна основі бітумних і дьогтьових в'яжучих.
- •12. Загальна класифікація композиційних матеріалів будівельного призначення.
- •13. Сучасні уявлення про формування структури та її роль в отриманні будівельних композиційних матеріалів із заданими властивостями. Структура, мікроструктура, мезо- та макроструктура.
- •14. Композиційні матеріали спеціального призначення в будівництві отриманні шляхом варіювання складом та структурою. Конструкційні, гідорізоляційні, покрівельні та герметизуючі.
- •15. Композиційні матеріали спеціального призначення в будівництві отриманні шляхом варіювання складом та структурою. Теплоізоляційні, акустичні (звукоізоляційні, звукопоглинільні)
- •17. Фізико-хімічні методи оцінки складу структури та властивостей будівельних матеріалів.
- •20. Фізичні властивості будівельних матеріалів: вогнестійкість, негорючі матеріали, важкогорючі, горючі. Границя вогнестійкості. Вогнетривкість. Жаростійкість.
- •22. Механічні властивості будівельних матеріалів: твердість, міцність, пружність, пластичність, крихкість.
- •23. Хімічні властивості: розчинність, кислотостійкість, лугостійкість, токсичність, корозійна стійкість, біокорозія.
- •24. Технологічні властивості матеріалів: формувальність, подрібнюваність, розпилюваність, пробійність, полірувальність, технологічність.
- •25. Лакофарбові матеріали та покриття. Дайте характеристику компонентів лакофарбових матеріалів: плівкоутворювачі, розчинники, розріджувачі, пластифікатори, наповнювачі, пігменти.
- •26. Лакофарбові матеріали: лаки, емалі, фарби: масляні, водоемульсійні (латексні), грунтівки:ізолюючі, пасивідуючі, фосфатуючі, протекторні, шпаклівки.
- •27. Природний і синтетичний каучук. Хімічний склад. Формула. Сировина для виготовлення. Гума. Склад гуми. Класифікація гуми.
- •30. Сировина для виробництва будівельних матеріалів та виробів.
- •31. Горюча мінеральна сировина (паливо). Дати визначення. Охарактеризуйте склад палива. Приведіть поділ палива за агрегатним станом і походженням.
- •32. Вода. Застосування. Твердість води. Основні процеси водо підготовки: фізичні, хімічні, фізико-хімічні.
- •33. Промислові та побутові стічні води. Якими речовинами забрудненні стічні води. Охарактеризуйте способи очистки стічних вод.
- •34. Голоіні ознаки фізико-механічних та хімічних технологічних процесів хімічна технологія. Високотемпературні процеси в технології будівельних матеріалів.
- •36. Порошкова металургія. Які завдання виконує порошкова металургія? Основні етапи одержання виробів. Наведіть приклади.
- •37. Дайте характеристику властивостей порошкоподібних матеріалів: хімічні, фізичні, технологічні властивості. Назвіть завершальну стадію технології порошкової металургії.
- •Остаточна обробка виробів
- •Високий тиск
- •Роль каталізаторів виконують тверді, рідинні та газові речовини.
- •Залежно від агрегатного стану каталізатора та реагуючих речовин (сировини) каталізні процеси поділяють на:
- •Електрохімічні процеси Основні закономірності електрохімічних процесів Біохімічні процеси
- •Плазмові процеси
- •Фотохімічні процеси
- •Лазерні процеси
- •Ультразвукові процеси
- •39. Метали і сплави. Властивості металів. Чавун. Сталь. Кольорові метали і сплави на їх основі. Колір і твердість ювелірних виробів.
- •1.1 Сплави міді
- •2. Алюміній і його сплави
- •2.1 Деформуємі алюмінієві сплави
- •2.2 Ливарні алюмінієві сплави
- •3. Цинк і його сплави
- •4. Магній та його сплави
- •4.1 Сплави на основі магнію
- •40. Дисперсні системи. Суспензії. Структуроутворення в дисперсних системах. Реодогічні властивості. Наведіть приклади суспензій.
- •Властивості суспензії
- •41. Кам’яне вугілля. Хімічний склад, продукти переробки, їх застосування.
- •42. Нафта. Склад, технологія і продукти переробки. Загальна характеристика і сфери застосування.
- •43. Каталітичні хіміко-технологічні процеси. Дати визначення. Застосування каталітичних процесів у промисловості: виробництво сірчаної кислоти, аміаку у процесі нафтопереробки.
- •44. Термічні процеси у виробництві непродовольчих товарів. Високотемпературні процеси у виробництві будівельних матеріалів: стадії виробництва порт ланд цементу, стадії виробництва керамічних виробів.
- •45. Хіміко - технологічні процеси. Хімічна технологія. Класифікація. Наведіть приклади.
- •46. Поняття про корозію та агресивні середовища. Види корозії та корозійних руйнувань :за умовами взаємодії. Місцева корозія.
- •Види корозійного руйнування. Корозійне руйнування металів і сплавів починається з поверхні, тобто на межі металевий виріб – середовище, і поступово поширюється в глибину металу.
- •48.Покриття як засіб захисту від корозії:металеві,дифузійні,неметалеві.
- •49.Фракційна перегонка нафти: термічний крекінг мазуту,піроліз нафтових фракцій.
- •50. Вода у виробництві непродовольчих товарів. Класифікація води. Промислова водо підготовка. Способи пом’якшення води.
- •51. Використання вторинної сировини у промисловості . Наведіть приклади. Технологія і охорона навколишнього середовища.
- •3. Опыт применения отходов химико-технологических производств и переработки древесины
- •1. Естественно-научные проблемы защиты окружающей среды
- •1.1 Проблемы оздоровления среды обитания
- •1.2 Влияние вредных веществ на живой организм
- •2. Перспективные технологии и окружающая среда
- •52. Горюча мінеральна сировина(паливо). Класифікація . Кам*яне вугілля , газ,нафта . Хімічний склад палива. Порівняльна характеристика питомої теплоти згоряння.
- •53. Підготовка сировини до перероблення в різних технологічних процесах: подріблення, сортування, збагачення, агломерація, грудкування.
- •54.Сировинна база виробництва . Класифікація сировини. Дати визначення.
42. Нафта. Склад, технологія і продукти переробки. Загальна характеристика і сфери застосування.
На́фта— горючакорисна копалина, складнасумішвуглеводніврізних класів з невеликою кількістю органічних кисневих, сірчистих і азотних сполук, що являє собою густу оліїстурідину. Забарвлення в неї червоно-коричневе, буває жовто-зелене і чорне, іноді зустрічається безбарвна нафта.[2]Нафта має характерний запах, легша за воду, у воді нерозчинна.
Елементний склад, %:вуглець80-88,водень11-14,5,сірка0,01-5,кисень0,05-0,7,азот0,01-0,6.
Густина— 760–990 кг/м³
Теплота згоряння— 43,7-46,2 МДж/кг.
Найважливіше джерело рідкого палива,мастил,сировинадля синтетичних матеріалів тощо.
Продукти, одержувані з нафти, їх застосування
З нафти виділяють різноманітні продукти, що мають велике практичне значення. Спочатку від неї відокремлюють розчинені вуглеводні(переважно метан). Після відгонки летких вуглеводнів нафту нагрівають. Першими переходять у газоподібний стан і відганяються вуглеводні з невеликим числом атомів вуглецю в молекулі, що мають відносно низьку температуру кипіння. З підвищенням температури суміші переганяються вуглеводні з більш високою температурою кипіння. Таким чином можна зібрати окремі суміші (фракції) нафти. Найчастіше при такій перегонці одержують три основні фракції, які потім піддаються подальшому поділу. Основні фракції нафти наступні:
1. Фракція, що збирається від 400 до 2000 С, - газолінова фракція бензинів
містить вуглеводні від С5Н12 до С11Н24. При подальшій перегонці виділеної фракції одержують: газолін (від 400 до 700 С), бензин (від 700 до 1200 С) - авіаційний, автомобільний і т.д.
2. Лігроїнова фракція, що збирається в межах від 1500 до 2500 С, містить вуглеводні від С8Н18 до С14Н30. Нафта застосовується як пальне для тракторів.
3. Гасова фракція включає вуглеводні від С12Н26 до С18Н38 з температурою кипіння від 1800 до 3000С. гас після очищеннявикористовується як пальне для тракторів, реактивних літаків і ракет.
4. Газойль (вище 2750 С) - дизельне паливо.
5. Мазут - залишок від перегонки. Містить вуглеводні з великим числом атомів вуглецю(до багатьох десятків) у молекулі. Мазут також розділяють на фракції: a) соляровим олії - дизельне паливо, b) Мастила (авіатракторние, авіаційні, індустріальні та ін), c) Вазелін (основа для косметичних засобів і ліків).
З деяких сортів нафти одержують парафін (для виробництва сірників, свіч і ін.) Після відгону залишається гудрон. Його широко застосовують в дорожньому будівництві.
43. Каталітичні хіміко-технологічні процеси. Дати визначення. Застосування каталітичних процесів у промисловості: виробництво сірчаної кислоти, аміаку у процесі нафтопереробки.
Каталізом називається зміна швидкості хімічних реакцій внаслідок дії особливих речовин — каталізаторів.Каталізатор як компонент реакційного середовища знижує енергію активації, але не входить до складу продуктів реакції, лишаючись практично незмінним. На рис. 5.1 показано схему перебігу реакції для речовинАіВ. Для того, щоб утворилася речовинаАВ, треба подолати енергетичний бар’єр, тобто енергію активації Еакт, яка під дією каталізатора істотно знижується (Е*акт), а отже, збільшується швидкість перебігу процесу. Таким чином, дія каталізу як способу інтенсифікації технологічного процесу суттєво відрізняється від дії тиску чи температури. Введення каталізатора в рівноважну систему не зміщує рівноваги, адже каталізатор однаковою мірою прискорює швидкість як прямої, так і зворотної реакцій і лише скорочує час, необхідний для встановлення рівноваги, поліпшуючи тим техніко-економічні показники процесу. При цьому каталізатор не прискорює дифузійних процесів, впливаючи лише на швидкість процесів у кінетичній області. На рис. 5.2. зображено залежність швидкості процесу (крива 1 — швидкість прямої реакції, а крива 2 — швидкість зворотної реакції) від часу його проведення. Як видно з графіка, час досягнення рівноваги (тобто умови, коли швидкості прямої та зворотної реакції стають однаковими) у разі застосування каталізатора значно менший (?к), ніж тоді, коли каталізатор не застосовували (?).
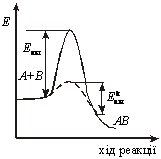 Рис.
5.1. Графік зниження енергії
активації
каталітичної реакції
Каталітичні
процеси поділяються на гомогенні—
тобто коли реагуючі речовини і каталізатор
перебувають в одній фазі,гетерогенні—
коли каталізатор і реагуючі речовини
перебувають у різних фазах,мікрогетерогенні,
тобто коли каталізатор перебуває в
колоїдному стані, а процес відбувається
в рідкій фазі, таферментативні,
коли процеси відбуваються в біологічних
системах під дією ферментів.
Рис.
5.1. Графік зниження енергії
активації
каталітичної реакції
Каталітичні
процеси поділяються на гомогенні—
тобто коли реагуючі речовини і каталізатор
перебувають в одній фазі,гетерогенні—
коли каталізатор і реагуючі речовини
перебувають у різних фазах,мікрогетерогенні,
тобто коли каталізатор перебуває в
колоїдному стані, а процес відбувається
в рідкій фазі, таферментативні,
коли процеси відбуваються в біологічних
системах під дією ферментів.
Каталіз поділяють на позитивний, коли швидкість реакції прискорюється, і негативний, коли швидкість уповільнюється. Причому речовини, що зменшують швидкість процесу, ще називають інгібіторами. У хімічній промисловості найбільш поширеними є гетерогенні каталітичні процеси, причому твердий каталізатор перебуває в середовищі з газоподібною або рідкою фазою. Процес гетерогенного каталізу на твердих каталізаторах складається з кількох елементарних стадій: дифузія реагентів до поверхні каталізатора; адсорбція (хемосорбція) реагентів на поверхні каталізатора з утворенням нестійких комплексів складу реагент — каталізатор; перегрупування атомів з утворенням нових комплексів складу продукт — каталізатор; десорбція (відрив) готового продукту з поверхні каталізатора; дифузія готового продукту від поверхні каталізатора в зовнішнє середовище. Проведення каталітичних реакцій в однорідному середовищі технічно легко здійснити, і тому для гомогенного каталізу не потрібні апарати спеціальної конструкції. Наприклад, для проведення гомогенних каталітичних реакцій у газовій фазі застосовують апарати, що мають вигляд камер, колон, трубчастих теплообмінників, і т. п. Гомогенний каталіз у рідкій фазі проводять звичайно в реакторах з перемішуванням. Основним недоліком гомогенного каталізу є виникнення труднощів під час вилучення каталізатора з готового продукту, через що забруднюється продукт і втрачається частина каталізатора.
Виробничі процеси отримання сірчаної кислоти
Серед мінеральних кислот почесне місце за обсягом виробництва та застосуванням у народному господарстві належить, безумовно, сірчаній кислоті, яку ще називають «хлібом хімії». Переважна більшість сірчаної кислоти (від 30 до 50 %) витрачається на виробництво мінеральних добрив та інших кислот (наприклад, фосфорної); її широко застосовують у виробництві кольорових та рідкісних металів; у металообробній промисловості ця кислота застосовується — для протрави металевих виробів перед їх лудінням, нікелюванням тощо. Значну кількість сірчаної кислоти використовують для очищення нафтопродуктів, у виробництві барвників, лаків, ліків, спиртів, ефірів, синтетичних мийних засобів, отрутохімікатів, вибухових речовин, пластмас, у текстильній промисловості — для протрави тканин та виробництва штучного волокна, у промисловості органічного синтезу, а також для сушіння газів та при концентруванні різних кислот (наприклад, азотної). У харчовій промисловості сірчану кислоту застосовують для виробництва крохмалю, глюкози, патоки та інших продуктів. Сировиною для отримання сірчаної кислоти є залізний колчедан, самородна сірка, сірководень, що міститься в коксовому, генераторному та газах нафтопереробки, та гази кольорової металургії, що містять від 4 до 10 % діоксиду сірки. Україна має великі родовища самородної сірки у Львівській області (Роздольське, Яворівське) та на Івано-Франківщині Немирівське. Залізний колчедан завозився з Уралу, хоч була в наявності вітчизняна сировина. Знаходять застосування і гази коксохімічної промисловості. Сировина, що використовується для отримання сірчаної кислоти, спочатку збагачується. Зокрема, для залізного колчедану застосовують кілька стадій збагачення методом флотації, отримуючи сульфіди кольорових металів, пусту породу та власне сульфід заліза, який використовують у контактному методі отримання сірчаної кислоти. Самородну сірку збагачують методом флотації, а також плавленням під землею за методом Фраша, коли подають у свердловину перегріту пару і вичавлюють розплавлену сірку на поверхню стисненим повітрям. Гази кольорової металургії та сірководень можуть використовуватися без спеціального очищення. Загальна схема виробництва кислоти може бути представлена таким ланцюжком: видобування сировини — збагачення сировини — очищення діоксиду сірки — контактування — абсорбція триоксиду сірки — сірчана кислота. Конкретна схема виробництва залежить від виду сировини, типу каталітичного окиснення SO2 та особливостей стадії абсорбції SO3. Найбільш складним за технологічним оформленням є виробництво сірчаної кислоти із залізного колчедану. На рис. 5.6 наведена принципова структурна схема цього виробництва, з якої можна виокремити чотири стадії виробництва: обпалення сировини, очищення сірчистого газу, контактування діоксиду сірки та абсорбція оксиду сірки (VІ).
 Рис.
5.6. Структурна схема виробництва сірчаної
кислоти з піриту:
І отримання діоксиду
сірки: 1 — обпалення піриту, 2 — охолодження
газу в котлі-утилізаторі; ІІ очищення
діоксиду сірки: 3 — загальне очищення,
4 — спеціальне очищення; ІІІ контактне
отримання триоксиду сірки: 5 — підігрів
газу в теплообміннику, 6 — контактування;
ІV абсорбція: 7 — абсорбція триоксиду
сірки та утворення сірчаної кислоти
Рис.
5.6. Структурна схема виробництва сірчаної
кислоти з піриту:
І отримання діоксиду
сірки: 1 — обпалення піриту, 2 — охолодження
газу в котлі-утилізаторі; ІІ очищення
діоксиду сірки: 3 — загальне очищення,
4 — спеціальне очищення; ІІІ контактне
отримання триоксиду сірки: 5 — підігрів
газу в теплообміннику, 6 — контактування;
ІV абсорбція: 7 — абсорбція триоксиду
сірки та утворення сірчаної кислоти
Обпалення піритукиснем повітря є незворотним некаталітичним гетерогенним процесом, його проводять за атмосферного тиску в печах різної конструкції і можна описати таким загальним рівнянням: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 – ?H,
де ?H= 3400 кJ.
Оксид заліза разом із пустою породою та залишками породи, що містить невигорілий залишок дисульфіду заліза, складає вміст твердого залишку (огарку). Склад газу залежить від природи сировини та режиму роботи печі. В ньому міститься до 15 % оксиду сірки(ІV), близько 2 % кисню та 79—80 % азоту.
Друга стадія — це очищення газувід шкідливих домішок після обпалення. Газ містить близько 300 g/m3 пилу, що засмічує апаратуру та знижує активність каталізатора. Тому спочатку проводять механічне очищення в циклонах або інерційних пиловловлювачах (залишається близько 10—20 g/m3 пилу), а потім — спеціальне очищення від шкідливих для каталізатора домішок (селену, телуру, миш’яку тощо) в баштах, які зрошуються розведеною сірчаною кислотою. Оскільки газ містить вологу, то його пропускають через башти, що зрошуються концентрованою сірчаною кислотою, при цьому вміст вологи після такої операції не перевищує 0,01 %. Третя стадія —окиснення оксиду сірки(ІV)до оксиду сірки(VІ) вважається основною стадією виробництва сірчаної кислоти. Це процес гетерогенного каталізу, який проводять в апаратах з нерухомим шаром каталізатора або в апаратах киплячого шару з використанням контактної маси на основі оксиду ванадію(V) (рис. 5.3,б).
Четверта стадія у виробництві сірчаної кислоти — це абсорбція триоксидусіркиі перетворення її в сірчану кислоту або олеум, що являє собою зворотну екзотермічну реакцію, яка може бути описана таким рівнянням:
nSO3 + H2O = H2SO4 + (n – 1) SO3 – ?H.
Залежно від співвідношення триоксиду сірки та води можна отримати продукти різної концентрації: якщо n= 1 — це моногідрат (100 %-на сірчана кислота), якщоn> 1 — олеум, якщоn< 1 — розведена сірчана кислота. Обчислення матеріального балансу з використанням ТЕП наведемо на прикладі такої задачі:Розрахуйте витрати сировини та допоміжних матеріалів, які треба використати для отримання 1 тонни сірчаної кислоти (моногідрату) за умов, що стадія абсорбції триоксиду сірки водою відбувається без втрат компонентів, процес перетворення діоксиду сірки на триоксид в контактному апараті здійснюють з виходом 98 % а, вміст пустої породи при обпаленні піриту становить 5 %.
Розрахунки слід починати з останньої стадії процесу за наведеною в розділі 2 схемою. За реакцією SO3 + Н2O = H2SО4
Молярні маси 80 18 98
Потрібно
триоксиду сірки (SO3) 80/98 = ![]() /1t;
/1t;![]() =
0,816 t.
=
0,816 t.
Необхідна
кількість води розраховується
аналогічно ![]() =
0,164 t. Для абсорбції використовують
сірчану кислоту концентрацією 98,3 %, тому
розрахуємо, скільки такої кислоти
необхідно, щоб отримати 0,164 t води.
=
0,164 t. Для абсорбції використовують
сірчану кислоту концентрацією 98,3 %, тому
розрахуємо, скільки такої кислоти
необхідно, щоб отримати 0,164 t води.
У 100 t 98,3 % кислоти міститься 1,7 t води, підрахуємо, в якій кількості міститься 0,164 t води: 100 t · 0,164 t / 1,7 t = 9,647 t.
Для розрахунку необхідної кількості діоксиду сірки скористаємося реакцією, що відбувається в контактному апараті:
2SO2 + O2 = 2SO3
2·64 32 2?80
Каталітичні процеси при нафтопереробцівідрізняються від термічних тим, що пара нафтової сировини пропускається над каталізатором, що прискорює і направляє хід реакцій у бік утворення необхідних продуктів при більш м'яких умовах.
При каталітичному крекінгу, у якому всі процеси перетворення вуглеводнів нафти протікають в умовах гетерогенного каталізу, отримують продукти, різко відмінні за складом від продуктів термічного крекінгу і піролізу.
Каталізатори, які застосовуються в нафтопереробці, підрозділяють на метали (Ni, Pt, Pd), напівпровідники (Zn, Cr2O3, WS2, МоО2), ізолятор-алюмосилікатні каталізатори (Al2O3). В якості каталізаторів для крекінгу застосовують або алюмосилікати (природні глини), оброблені і збагачені присадками оксидів різних металів (Ni, Co, Cu, Mn і ін.), або спеціальні синтетичні маси на алюмосилікатній основі, так звані цеоліти і цеолітові системи. Сьогодні використовується близько 150 видів цеолітів, що дозволило залучити до переробки нові види сировини.
Головною задачею каталітичного крекінгу, як і термічного, є розщеплення високомолекулярних вуглеводнів. При температурах 200-300 °C переважають реакції деполімеризації, а при 300 °C і вище починається власне каталітичний крекінг. При каталітичному крекінгу легше всього крекінгуються олефіни, потім алкіловані арени і нафтени, а алкани найбільш стійкі, у той час як при термічному крекінгу цей ряд складають алкани, нафтени й арени.
