
- •Работа № 1 Качественное определение ионов токсичных металлов в воде
- •Бесцветные ионы Цинк
- •Опыт 1. Определение цинка
- •Опыт 2. Определение кадмия
- •Опыт 3. Определение свинца
- •Опыт 4. Определение ртути иодидом калия
- •Опыт 5. Определение висмута (III) тиомочевиной
- •Окрашенные ионы Железо
- •Опыт 6. Определение железа (III)
- •Опыт 7. Определение хрома
- •Опыт 8. Определение меди
- •Опыт 9. Анализ воды на содержание ионов тяжелых металлов (контрольная задача)
- •Определение ионов тяжелых металлов
- •Работа № 2 Качественное определение ионов токсичных неметаллов в воде
- •Опыт 1. Определение сульфид-иона
- •Опыт 2. Обнаружение иона аммония
- •Опыт 3. Определение нитрит-иона no2‾
- •Опыт 4. Обнаружение нитрат-иона no3‾
- •Опыт 5. Определение аниона фтора
- •Опыт 6. Определение фосфора
- •Опыт 7. Определение мышьяка
- •Опыт 8. Анализ воды на содержание анионов неметаллов (контрольная задача)
- •Определение ионов неметаллов
- •Работа № 3 Жесткость воды
- •А. Определение карбонатной жесткости воды Оборудование и реактивы
- •Результаты титрования воды раствором hCl
- •Б. Определение общей жесткости воды Оборудование и реактивы
- •Результаты титрования воды раствором эдта
- •Работа № 4 Определение окисляемости воды методом перманганатометрии
- •Оборудование и реактивы
- •А. Определение окисляемости воды обратным титрованием
- •Б. Определение окисляемости воды прямым титрованием
- •Работа № 5 Фотометрическое определение примесей тяжелых металлов в пресной воде
- •А. Определение железа в виде роданидного комплекса
- •Результаты фотометрирования растворов
- •Оборудование и реактивы
- •Описание определения
- •Б. Определение меди в виде аммиачного комплекса а) Метод калибровочного графика Оборудование и реактивы
- •Описание определения
- •Б) Метод стандартных добавок
- •Описание определения
- •В. Определение висмута в виде тиокарбамидного комплекса
- •Оборудование и реактивы
- •Описание определения
- •Г. Определение титана и ванадия при их совместном присутствии
- •Оборудование и реактивы
- •Описание определения
- •Работа № 6 Спектрофотометрическое определение примесей нефти и нефтепродуктов в природной воде
- •Внешний вид пленки нефти на поверхности воды в зависимости от ее толщины и количества нефти
- •Оборудование и реактивы
- •Описание определения
- •Электрохимические методы анализа объектов окружающей среды
- •Работа № 7 Определение рН воды и почвы
- •Оборудование и реактивы
- •А. Определение рН воды с применением индикаторов
- •Изменение окраски индикаторов
- •Б. Определение рН воды на иономере методом прямой потенциометрии
- •Описание определения
- •В. Определение рН почвы
- •Нормы внесения молотого известняка (кг/10 м2) при различных значениях pH почвы
- •Оборудование и реактивы
- •Работа № 8 Ионоселективное определение примесей различных ионов в природной и питьевой воде а. Определение хлорид-ионов
- •Основные характеристики ионоселективных электродов
- •Оборудование и реактивы
- •Описание определения
- •Результаты ионометрического определения ионов в воде
- •Б. Определение фторид-ионов
- •Оборудование и реактивы
- •Описание определения
- •В. Определение примесей железа
- •Оборудование и реактивы
- •Описание определения
- •Результаты титрования
- •Г. Определение нитрат-ионов
- •Оборудование и реактивы
- •Описание определения
- •Работа № 9 Определение содержания токсичных ионов тяжелых металлов в питьевой воде методом инверсионной вольтамперометрии
- •Оборудование и реактивы
- •Описание определения
- •Работа № 10 Определение меди и цинка при их совместном присутствии на катионите ку-2
- •Раздельное вымывание примесей с катионита ку-2
- •Оборудование и реактивы
- •Описание определения
- •Работа № 11 Определение кадмия в растворах методом хроматографии на бумаге
- •Оборудование и реактивы
- •Описание определения
- •Результаты хроматографического определения ионов кадмия Работа № 12 Определение уровня радиационного загрязнения окружающей среды
- •Оборудование
- •Описание определения
- •Литература
- •Содержание
Б. Определение общей жесткости воды Оборудование и реактивы
Бюретки на 25 мл.
Пипетки на 10, 100 мл.
Колбы конические для титрования на 250 мл, 3 шт.
Раствор ЭДТА, 0,05 н раствор.
Сульфат цинка ZnSO4∙7H2O.
Индикатор - эриохромовый черный Т (хромоген).
Ацетатный буферный раствор с pH ≈ 5.
Аммиачный буферный раствор с pH ≈ 10.
1. Определение точной концентрации рабочего раствора ЭДТА по исходному веществу ZnSO4·7H2O.
Приготовление
стандартного раствора сульфата цинка.
Титр раствора
сульфата цинка
![]() и его нормальную концентрацию
и его нормальную концентрацию![]() рассчитывают по формулам
рассчитывают по формулам
![]() ,
г/мл;
,
г/мл;
![]() ;
;
![]()
где
![]() -
эквивалент цинка.
-
эквивалент цинка.
Титрование раствора ЭДТА по цинку. Бюретку заполните рабочим раствором ЭДТА (~ 0,05 н). Пипеткой отберите 10,00 мл приготовленного раствора соли цинка, перенесите в коническую колбу для титрования, добавьте 1 крупинку индикатора хромогена и титруйте из бюретки раствором ЭДТА от винно-красного до чисто-синего цвета.
Титрование проведите не менее трех раз и используйте средний результат для расчета:
![]() ;
;
![]() ,
,
где V1 и N1 - объем (мл) и нормальная концентрация (экв/л) раствора ZnSO4, а V2 и N2 - раствора ЭДТА.
2. Определение общей жесткости воды (контрольная задача).
Получите у преподавателя мерную колбу, содержащую образец раствора, общую жесткость которого необходимо определить.
Мерную колбу заполните дистиллированной водой до метки, тщательно перемешайте.
Из мерной колбы отберите пипеткой 10,00 мл анализируемого раствора в коническую колбу, добавьте ~ 5 мл аммиачного буферного раствора и 1 крупинку индикатора хромогена, отметьте окраску.
Колбу с исследуемой водой поставьте на лист белой бумаги под бюретку, заполненную 0,05 н раствором ЭДТА. Проведите титрование при непрерывном перемешивании содержимого колбы. Закончите титрование при переходе окраски раствора от винно-красной к синей с зеленоватым оттенком. Следует отметить, что этот переход происходит от одной капли ЭДТА, поэтому очень важно добавлять ЭДТА строго по каплям.
Результаты определения запишите в форму табл.4.
Форма таблицы 4
Результаты титрования воды раствором эдта
|
Номер опыта |
Объем, мл |
Нормальная концентрация ЭДТА N2, экв/л |
Общая жесткость воды Жо, ммоль/л |
Средняя
карбонатная жесткость воды
| |
|
воды V1 |
ЭДТА V2 | ||||
|
1 2 3 |
|
|
|
|
|
Используя результаты работ А и Б, рассчитайте по соответствующим формулам величину некарбонатной (постоянной) жесткости и внесите ее в форму табл.3.
Определению общей жесткости воды мешают медь, цинк, марганец, а также высокое содержание карбонатов. Их влияние устраняется в ходе анализа.
Нечеткое изменение окраски в эквивалентной точке указывает на присутствие меди и цинка. Для устранения влияния мешающих веществ к отмеренной для титрования пробе воды прибавьте 1 - 2 мл 0,2 моль/л раствора сульфида натрия, после чего проведите анализ, как указано выше.
Если после прибавления к отмеренному объему воды буферного раствора и индикатора титруемый раствор постепенно обесцвечивается, приобретая серый цвет, то значит в воде присутствует марганец. В этом случае к пробе воды, отобранной для титрования, до внесения реактивов прибавьте 5 капель 1%-ного раствора солянокислого гидроксиламина и определите жесткость, как указано выше.
Если титрование приобретает крайне затяжной характер с неустойчивой и нечеткой окраской в эквивалентной точке, это свидетельствует о высокой щелочности воды. Ее влияние устраните прибавлением к пробе воды до внесения реактивов 0,1 н раствора соляной кислоты в количестве, необходимом для достижения нейтральной либо слабокислой реакции (проверяется индикатором) с последующим кипячением. После этого пробу охладите, прибавьте буферный раствор, индикатор и далее определите жесткость воды, как указано выше.
Рассчитайте общую жесткость воды и сообщите ее преподавателю.
Оцените абсолютную и относительную ошибки эксперимента по формулам
абс
= ![]() –
–
![]() ,
,
отн
=
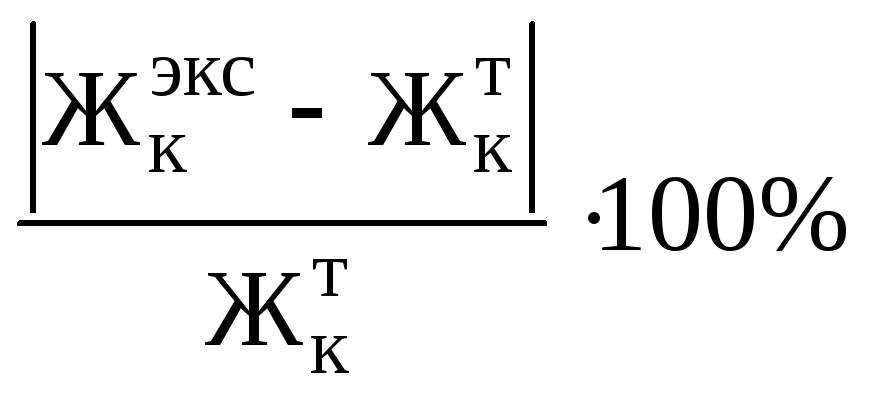 ,
,
где
![]() - экспериментальное значение карбонатной
жесткости;
- экспериментальное значение карбонатной
жесткости;
![]() - истинное значение карбонатной жесткости
(величину сообщает преподаватель).
- истинное значение карбонатной жесткости
(величину сообщает преподаватель).
