
- •Ответы на вопросы,
- •Распространенность атомов в ос
- •3. Круговорот кислорода в окружающей среде
- •4. Круговорот азота в окружающей среде
- •5. Круговорот углерода в окружающей среде
- •6. Солнечная радиация и ее преобразование. Энергетический баланс Земли. Распределение составляющих энергетического баланса.
- •7. Основные компоненты современной атмосферы. Температурный профиль атмосферы.
- •8. Неорганические, органические компоненты атмосферы. Аэроионы.
- •Аэроионы
- •9. Химические превращения соединений в атмосфере. Реакционноспособные частицы атмосферы. Озон. Молекулярный и атомарный кислород
- •10. Химические превращения соединений в атмосфере. Гидроксильный и гидропероксидный радикалы.
- •11. Химические превращения соединений в атмосфере. Оксиды азота. Диоксиды серы.
- •12. Фотохимическое окисление метана (схема превращений). Реакции гомологов метана. Атмосферная химия углеводородов. Алкены.
- •13. Химические превращения соединений в атмосфере. Бензол и его гомологи.
- •14. Фотохимия производных углеводородов. Альдегиды и кетоны.
- •15. Фотохимия производных углеводородов. Карбоновые кислоты и спирты. Амины и серосодержащие соединения.
- •16. Фотохимия загрязненной атмосферы городов. Фотохимическое образование смога.
- •17. Атмосферная химия галогенсодержащих соединений. Влияние окислов азота и галогенсодержащих органических соединений на слой озона.
- •18. Химия загрязненной атмосферы городов. Разрушение металлов, облицовки зданий, стекол. Проблема гибели лесов.
- •19. Основные виды природных вод. Классификация вод.
- •20. Группы, типы, классы, семейства, роды вод. Общая минерализация вод.
- •21. Ведущие и редкие ионы природных вод. Классификация природных вод по составу ионов.
- •22. Энергетическая характеристика ионов. Кислотно-основное равновесие в природных водоемах.
- •23. Окислительно-восстановительные условия природных вод.
- •24. Диаграмма стабильности воды ( ре-рН ).
- •26. Общая щелочность вод. Процессы закисления поверхностных водоемов.
- •27. Основные свойства воды. Газы природных вод
- •Газы природных вод
- •30. Загрязнения грунтовых, речных и морских вод органическими остатками.
- •31. Загрязнения грунтовых, речных и морских вод неорганическими остатками.
- •2 Кислотные выбросы.
- •32. Загрязнения грунтовых, речных и морских вод тяжелыми металлами.
- •33. Коррозия металлов в водной среде. Факторы, влияющие на интенсивность процесса коррозии.
- •34. Разрушение бетона и железобетона под действием воды.
- •35. Образование почвенного слоя. Классификация почвенных частиц по крупности и механическому составу.
- •Классификация почвенных частиц по их крупности
- •35. Элементный и фазовый состав почв.
- •37. Влагоемкость, водопроницаемость почв. Различные формы воды в почве.
- •38. Почвенные растворы.
- •39. Катионно-обменная способность почв. Поглотительная способность почвы. Селективность катионного обмена.
- •40. Формы соединений алюминия в почвах. Виды почвенной кислотности.
- •41. Соединения кремния и алюмосиликаты в почвах.
- •42. Минеральные и органические соединения углерода в почве. Значение гумуса. Диоксид углерода, угольная кислота и карбонаты
- •Органические вещества и их значение
- •43. Подразделение гумусовых веществ почвы.
- •44. Гумус. Специфические гумусовые соединения.
- •Фульвокислоты
- •45. Неспецифические гумусовые соединения. Негидролизуемый остаток.
- •46. Гумусовые кислоты почв.
- •47. Антропогенное загрязнение почв. Кислотное загрязнение.
- •48. Антропогенное загрязнение почв. Влияние тяжелых металлов на состояние почв и развитие растений.
- •49. Антропогенное загрязнение почв. Пестициды в почве.
- •50. Антропогенное загрязнение почв. Влияние водно-солевого режима на состояние почвы.
Ответы на вопросы,
выносимых на экзамен по дисциплине «Физико-химические процессы в окружающей среде» для студентов III курса специальности «Экологический менеджмент и аудит в промышленности»
Распространенность атомов в окружающей среде. Кларки элементов.
Кларк элемента – числовая оценка среднего содержания элемента в земной коре, гидросфере, атмосфере, Земле в целом, различных типах горных пород, космических объектах и др. Кларк элемента может быть выражен в единицах массы (%, г/т), либо в атомных %. Введен Ферсманом, назван в честь Франка Унглизорта, американского геохимика.
Количественную распространенность химических элементов в земной коре впервые установил Кларк. В земную кору он включил также гидросферу и атмосферу. Однако масса гидросферы составляет несколько %, а атмосфера – сотые доли % от массы твердой земной коры, поэтому числа Кларка отражают в основном состав твердой земной коры. Так, в 1889 году были рассчитаны кларки для 10 элементов, в 1924 – для 50 элементов.
Современные радиометрические, нейтронно-активационные атомно-адсорбционные и другие методы анализа позволяют с большой точностью и чувствительностью определить содержание химических элементов в горных породах и минералах. Представления о кларках изменились. Н-р: Ge в 1898 году Фокс считал кларк равный п *10 -10 %. Ge был плохо изучен не имел практического значения. В 1924 году для него кларк был рассчитан как п*10-9 % ( Кларк и Г. Вашингтон). Позже Ge был обнаружен в углях, и его кларк возрос до 0,п%. Ge применяют в радиотехнике, поиск германиевого сырья, детальное изучение геохимии Ge показали, что Ge не так уж редок в земной коре, его кларк в литосфере составляет 1,4*10-4%, почти такой же как у Sn, As, его намного больше в земной коре чем Au, Pt, Ag.
Распространенность атомов в ос
Вернадский ввел положение о рассеянном состоянии химических элементов, и оно подтвердилось. Все элементы есть везде, речь может идти только о недостаточности чувствительности анализа, не позволяющего определить содержание того или другого элемента в изучаемой среде. Это положение о всеобщем рассеянии химических элементов именуется законом Кларка-Вернадского.
Исходя из кларков элементов в твердой земной коре (про Виноградову) почти ½ твердая земная кора состоит из О, т.е Земная кора - это «кислородная сфера», кислородное вещество.
|
Элемент |
Содержание, % |
|
8O |
47,0 |
|
14Si |
29,5 |
|
13Al |
8,05 |
|
26Fe |
4,65 |
|
20Ca |
2,96 |
|
11Na |
2,50 |
|
19K |
2,50 |
|
12Mg |
1,87 |
|
22Ti |
0,45 |
Содержание O, Si, Al в сумме составляет 84,55%, сумма всех перечисленных элементов – 99,48%, на долю остальных 80 элементов приходится < 1%.
Кларки большинства элементов не превышают 0,01-0,0001% - это редкие элементы. Если эти элементы обладают слабой способностью к концентрированию, они называются резкими рассеянными (Br, In, Ra, I, Hf).
Н-р: Для U и Br значения кларков составляют ≈ 2,5*10-4, 2,1*10-4 соответственно, но U просто редкий элемент, т.к. известны его месторождения, а Br – редкий рассеянный, т.к. он не концентрируется в земной коре. Микроэлементы – элементы, содержащиеся в данной системе в малых количествах (≈ 0,01% и менее). Так, Al – микроэлемент в организмах и макроэлемент в силикатных породах.
Итак, содержание элементов в земной коре колеблется в широких пределах.\
Классификация элементов по Вернадскому.
В земной коре родственные по периодической системе элементы ведут себя неодинаково – мигрируют в земную кору по-разному. Вернадский учитывал самые важные моменты истории элементов в земной коре. Главное значение предовалось таким явлениям и процессам как радиоактивность, обратимость и необратимость миграции. Способность давать минералы. Вернадский выделил 6 групп элементов:
благородные газы (He, Ne, Ar, Kr, Xe) – 5 элементов;
благородные металлы (Ru, Rh, Pd, Os, Ir, Pt, Au) – 7 элементов;
циклические элементы (участвующие в сложных круговоротах) – 44 элемента;
рассеянные элементы – 11 элементов;
сильно радиоактивные элементы ( Po, Ra, Rn, Ac, Th, Pa, U) – 7 элементов;
элементы редких земель – 15 элементов.
Элементы 3 группы по массе преобладают в земной коре из них в основном состоят горные породы, воды, организмы.
Представления из повседневного опыта не совпадают с реальными данными. Так, Zn, Cu широко распространены в быту и технике, а Zr (цирконий) и Ti для нас редкие элементы. Хотя Zr в земной коре в 4 раза больше чем Cu, а Ti – в 95 раз. «Редкость» этих элементов объясняется трудностью их извлечения из руд.
Химические элементы вступают во взаимодействия друг с другом не пропорционально их массам, а в соответствии с количеством атомов. Поэтому кларки могут быть рассчитаны не только в массовых %, но и в % от числа атомов, т.е. с учетом атомных масс (Чирвинский, Ферсман). При этом кларки тяжелых элементов уменьшаются, а легких – увеличиваются.
|
Легкие элементы, % ат., (%масс,) |
Тяжелые элементы, % ат., (%масс.) |
|
O – 57,0 (47,0) |
V - 2*10-5 (2,5*10-4) |
|
Li – 1,9*10-2 (3,2*10-3) |
Au – 5*10-8 (4,3*10-7) |
|
Be – 1,2*10-3 (3,8*10-4) |
Ra – 9*10-12 (2*10-10) |
Расчет на число атомов дает более контрастную картину распространенности химических элементов – еще большее преобладание кислорода и редкость тяжелых элементов.
Когда был установлен средний состав земной коры, возник вопрос о причине неравномерности распространения элементов. Это стаи связывать с особенностями строения атомов.
Рассмотрим связь значения кларков с химическими свойствами элементов.
Так щелочные металлы Li, Na, K, Rb, Cs, Fr химическом отношении близки друг к другу – один валентный электрон, но значения кларков отличаются – Na и K - ≈ 2,5; Rb - 1,5*10-2; Li - 3,2*10-3;Cs – 3,7*10-4;Fr – искусственный элемент. Резко различаются значения кларков для F и Cl, Br и I, Si (29,5) и Ge (1,4*10-4), Ba (6,5*10-2) и Ra (2*10-10).
С другой стороны, различные в химическом отношении элементы имеют близкие кларки – Mn (0,1) и P (0,093), Rb (1,5*10-2) и Cl (1,7*10-2).
Ферсман построил график зависимости значений атомных кларков для четных и нечетных элементов Периодической системы от порядкового номера элемента. Выяснилось, что с усложнением строения атомного ядра (утяжеления) кларки элементов уменьшаются. Однако эти зависимости (кривые) получились ломаными.
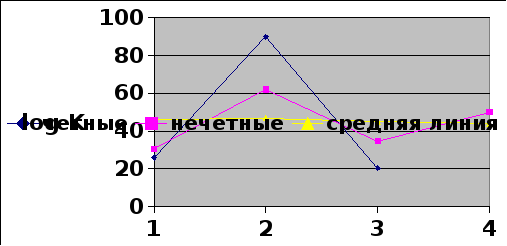
Ферсман прочертил гипотетическую среднюю линию, которая плавно понижалась по мере возрастания порядкового номера элемента. Элементы расположенные выше средней линии, образующие пики, ученый назвал избыточными (O, Si, Fe и др.), а расположенные ниже линии – дефицитными (инертные газы и др.). Из полученной зависимости следует, что в земной коре преобладают легкие атомы, занимающие начальные клетки Периодической системы, ядра которых содержат небольшое количество протонов и нейтронов. Действительно, после Fe (№26) нет ни одного распространенного элемента.
Далее Оддо (итальянский ученый) и Гаркинсом (американский ученый) в 1925-28 гг. была установлена другая особенности распространенности элементов. В Земной коре преобладают элементы с четным порядковым номером и атомными массами. Среди соседних элементов у четных элементов кларки почти всегда выше, чем у нечетных. Для 9 наиболее распространенных элементов (8O, 14Si,13Al,26Fe,20Ca,11Na,19K,12Mg,22Ti) массовые кларки четных составляют в сумме 86,43% , а нечетных – 13,05%.Особенно велики кларки элементов, атомная масса которых делится на 4, это – O, Mg, Si, Ca.
По данным исследований Ферсмана, ядра типа 4q (q –целое число) составляют 86,3% земной коры. Менее распространены ядра типа 4q +3 (12,7%) и совсем мало ядра типа 4q+1 и 4q+2 (1%).
Среди четных элементов, начиная с He, наибольшими кларками обладают каждый шестой: O (№8), Si(№14), Ca (№20), Fe (№26). Для нечетных элементов – аналогичное правило (начиная с Н) – N (№7), Al (№13), K (№19), Mg (№25).
Итак, в земной коре преобладают ядра с небольшим и четным числом протонов и нейтронов.
С течением времени кларки изменились. Так в результате радиоактивного распада стало меньше U и Th, но больше Pb. В изменении значений кларков элементов сыграли роль и такие процессы как диссипация газов, выпадение метеоритов.
Основные тенденции химических изменений в земной коре. Большой круговорот вещества в земной коре.
КРУГОВОРОТ ВЕЩЕСТВ. Вещество земной коры находится в непрерывном движении, вызванном разнообразными причинами, связанными с физ.-хим. свойствами вещества, планетными, геологическими, географическими и биол. условиями земли. Это движение неизменно и непрерывно происходит в течение геологического времени—не менее полутора и по-видимому не более трех млрд. лет. В последние годы выросла новая наука геологического цикла — геохимия, имеющая задачей изучение хим. элементов, строящих нашу планету. Основным предметом ее изучения являются движения хим. элементов вещества земли, какими бы причинами эти движения ни были вызваны. Эти движения элементов называются миграциями хим. элементов. Среди миграций есть такие, во время которых хим. элемент через больший или меньший промежуток времени неизбежно возвращается в начальное исходное состояние; история таких хим. элементов в земной коре может быть сведена т. о. к обратимому процессу и представлена в форме кругового процесса, круговорота. Этого рода миграции характерны не для всех элементов, но для значительного их числа, в том числе для огромного большинства хим. элементов, строящих растительные или животные организмы и окружающую нас среду—океаны и воды, горные породы и воздух. Для таких элементов в круговороте веществ находится вся или подавляющая масса их атомов, у других лишь ничтожная их часть охвачена круговоротами. Несомненно, что большая часть вещества земной коры до глубины в 20—25 км охвачена круговоротами. Для следующих хим. элементов круговые процессы являются характерными и господствующими среди их миграций (цифра указывает на порядковое число). Н, Ве4, В5, С«, N7, 08, Р9, Nan,Mg12,Aha, Sii4,Pi5, Sie, Cli7, K19, Ca2o, Ti22, V23, Cr24, Mn25, Fe2e, Co27, Ni28, Cu29, Zn30, Ge32, As33,Se34, Sr38,Mo42, Ag47,Cd48, Sn50, Sb51, Te62, Ba56) W74, Au79,Hg80,T]81,Pb82,Bi83. Эти элементы могут быть на этом основании отделены от других элементов как элементы циклические или органогенные. Т.о. круговороты характеризуют 42 элемента из 92 входящих в Менделеевскую систему элементов, причем в это число входят самые обычные господствующие земные элементы.
Остановимся на К. первого рода, заключающих биогенные миграции. Эти К. захватывают биосферу (т. е. атмосферу, гидросферу, кору выветривания). Под гидросферой они захватывают подходящую к океаническому дну базальтовую оболочку. Под сушей они в последовательности углубления обнимают толщу осадочных пород (стратосферу), метаморфическую и гранитную оболочки и входят в базальтовую оболочку. Из земных глубин, лежащих за базальтовой оболочкой, вещество земли не попадает в наблюдаемые К. Оно не попадает в них также сверху из-за пределов верхних частей стратосферы. Т. о. круговороты хим. элементов являются поверхностными явлениями, идущими в атмосфере до высот в 15—20 км (не выше), а в литосфере—не глубже 15—20 км. Всякий К., для того чтобы он мог постоянно возобновляться, требует притока внешней энергии. Известны два главных и несомнен. источника такой энергии: 1) космическая энергия—излучения солнца (от нее почти всецело зависит биогенная миграция) и 2) атомная энергия, связанная с радиоактивным распадом элементов '78 ряда урана, тория, калия, рубидия. С меньшей степенью точности можно выделить энергию механическую, связанную с движением (благодаря тяготению) земных масс, и вероятно космическую энергию, проникающую сверху (лучи Гесса).
Круговороты, захватывающие несколько земных оболочек, идут медленно, с остановками и могут быть замечены только в геологическом времени. Часто они охватывают несколько геолог, периодов. Они вызываются геолог, смещениями суши и океана. Части К. могут идти быстро (напр. биогенная миграция).
