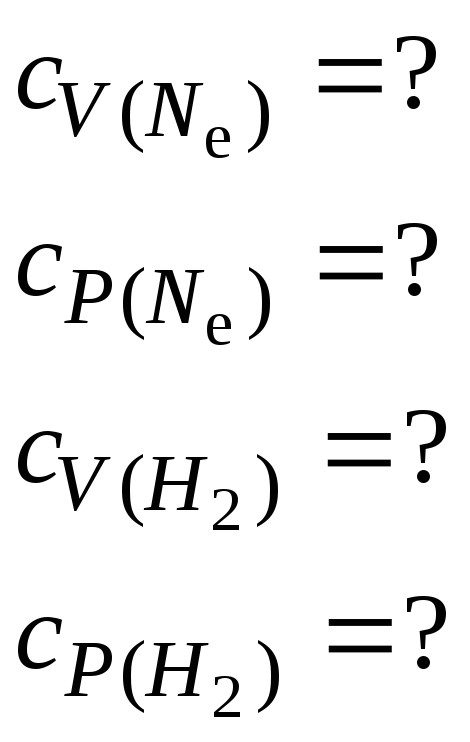- •Рабочая программа по курсУ физики
- •2. Элементы специальной (частной) теории относительности
- •3. Механические колебания и волны в упругих средах
- •4. Основы молекулярной физики и термодинамики
- •5. Электростатика
- •6. Постоянный электрический ток
- •7. Электромагнетизм
- •8. Электромагнитные колебания и волны
- •9. Волновая оптика
- •10. Квантовая природа излучения
- •11. Элементы атомной физики и квантовой механики
- •12. Элементы квантовой статистики и физики твердого тела
- •13. Элементы физики атомного ядра и элементарных частиц
- •Методические указания к рабочей программе
- •Методические указания к выполнению контрольных работ
- •1. Физические основы классической механики.
- •Задача 1.3
- •Решение
- •Задача 1.4
- •Решение
- •Задача 1.5
- •Решение
- •Задача 1.6
- •Решение
- •Задача 1.7
- •Решение
- •Задача 1.8
- •Решение
- •Задача 1.9
- •Решение
- •Задача 1.10
- •Решение
- •Задача 1.11
- •Решение
- •Задача 1.12
- •Решение
- •Задача 1.13
- •Решение
- •Задача 1.14
- •Решение
- •Задача 1.15
- •Решение
- •Задача 1.16
- •Решение
- •Задача 1.17
- •Решение
- •Задача 1.18
- •Решение
- •Задача 1.19
- •Решение
- •Контрольная работа №1
- •2. Электростатика.
- •Задача 2.2
- •Решение
- •Задача 2.3
- •Решение
- •Задача 2.4
- •Решение
- •Задача 2.5
- •Решение
- •Задача 2.6
- •Решение
- •Задача 2.7
- •Решение
- •Задача 2.8
- •Решение
- •Задача 2.9
- •Решение
- •Задача 2.10
- •Решение
- •Задача 2.11
- •Решение
- •Контрольная работа №2
- •3. Электромагнетизм Примеры решения задач Задача 3.1
- •Решение
- •Задача 3.2
- •Решение
- •Задача 3.3
- •Решение
- •Задача 3.4
- •Решение
- •Задача 3.5
- •Решение
- •Задача 3.6
- •Решение
- •Задача 3.7
- •Решение
- •Задача 3.8
- •Решение
- •Задача 3.9
- •Решение
- •Задача 3.10
- •Решение
- •Задача 3.11
- •Решение
- •Контрольная работа №3
- •4. Оптика. Элементы атомной физики
- •Волновые свойства частиц
- •Боровская теория водородоподобного атома
- •Атомное ядро. Радиоактивность
- •Теплоемкость кристалла
- •Элементы квантовой статистики
- •Дозы радиационного облучения
- •Полупроводники
- •Контрольная работа №4
- •Литература Основная
- •Дополнительная
- •Содержание
- •220013, Минск, проспект ф.Скорины, 65.
Задача 1.11
Определить число молекул, содержащихся в объеме 1 мм3 воды, и массу молекулы воды. Считая условно, что молекулы воды имеют вид шариков, соприкасающихся друг с другом, найти диаметр молекул.
|
Дано:
|
|
|
d = ?; N = ?; m0 = ? |
Решение
Число
N
молекул, содержащихся в некоторой
системе массой m,
равно произведению постоянной Авогадро
NA
на количество вещества
![]() :
:
![]()
Так как
![]()
где
![]() – молярная масса, то
– молярная масса, то
![]() .
.
Выразив в этой формуле массу как произведение плотности на объем V, получим
![]() (1.27)
(1.27)
Произведем
вычисления, учитывая, что для воды
![]() =
=![]() кг/моль:
кг/моль:
![]() кг/м3;
кг/м3;
![]()
![]()
Массу m0 одной молекулы можно найти по формуле
![]() (1.28)
(1.28)
Подставив
в (1.28) значения
![]() иNA,
найдем массу молекулы воды:
иNA,
найдем массу молекулы воды:
![]()
Если молекулы воды плотно прилегают друг к другу, то можно считать, что на каждую молекулу приходится объем (кубическая ячейка)
V0 = d 3,
где d – диаметр молекулы.
Отсюда
![]() (1.29)
(1.29)
Объем V0 найдем, разделив молярный объем Vm на число молекул в моле, т. е. на NA:
![]() (1.30)
(1.30)
Подставим выражение (1.30) в (1.29):
![]()
где
![]()
Тогда
![]() (1.31)
(1.31)
Проверим, дает ли правая часть выражения (1.31) единицу длины:
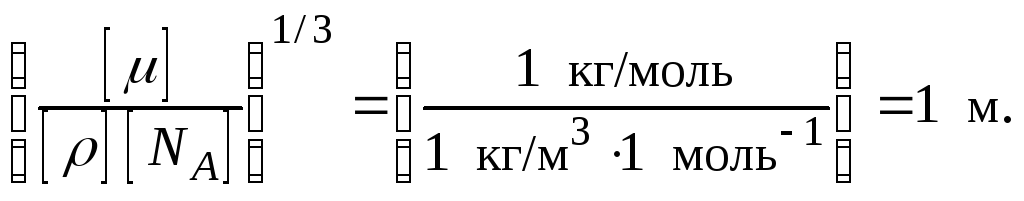
Произведем вычисления:
![]()
Задача 1.12
В баллоне объемом 10 л находится гелий под давлением 1 МПа и при температуре 300 К. После того как из баллона было взято 10 г гелия, температура в нем понизилось до 290 К. Определить давление гелия, оставшегося в баллоне.
|
Дано:
V = 10 л = 1 10-2 м3; P1 = 1 МПа = 1 106 Па; T1 = 300 K; T2 = 290 K; m = 10 г = 0,01 кг. |
| |
|
P2 = ? |
|
|
Решение
Для решения задачи воспользуемся уравнением Менделеева – Клапейрона, применив его к конечному состоянию газа:
![]() (1.32)
(1.32)
где m2 – масса гелия в баллоне в конечном состоянии;
![]() –молярная
масса гелия;
–молярная
масса гелия;
R – универсальная газовая постоянная.
Из уравнения (1.32) выразим искомое давление:
![]() (1.33)
(1.33)
Массу m2 гелия выразим через массу m1, соответствующую начальному состоянию, и массу m гелия, взятого из баллона:
![]() (1.34)
(1.34)
Массу m1 гелия найдем также из уравнения Менделеева – Клапейрона, применив его к начальному состоянию:
![]() (1.35)
(1.35)
Подставив выражение массы m1 в (1.34), а затем выражение m2 в (1.33), найдем
![]() ,
,
или после преобразования и сокращения
![]() (1.36)
(1.36)
Произведем вычисления, учитывая, что
![]() ;
;
![]() ;
;
![]()
Задача 1.13
Вычислить удельные теплоемкости при постоянном объеме cV и постоянном давлении cP неона и водорода, принимая эти газы за идеальные.
|
Дано:
Газы: неон (Ne); водород (H2). |
|
|
|
Решение
Удельные теплоемкости идеальных газов выражаются формулами
![]()
![]() (1.37)
(1.37)
где i – число степеней свободы молекулы газа;
![]() –молярная
масса.
–молярная
масса.
Для
неона (одноатомный газ) i
= 3;
![]() = 20
10-3
кг/моль. При вычислениях по формулам
(1.37) получим
= 20
10-3
кг/моль. При вычислениях по формулам
(1.37) получим
![]()
![]()
Для
водорода (двухатомный газ) i
= 5;
![]() = 2
10-3
кг/моль. При вычислениях по тем же
формулам получим
= 2
10-3
кг/моль. При вычислениях по тем же
формулам получим
![]()
![]()