
Биохимия растений
.pdf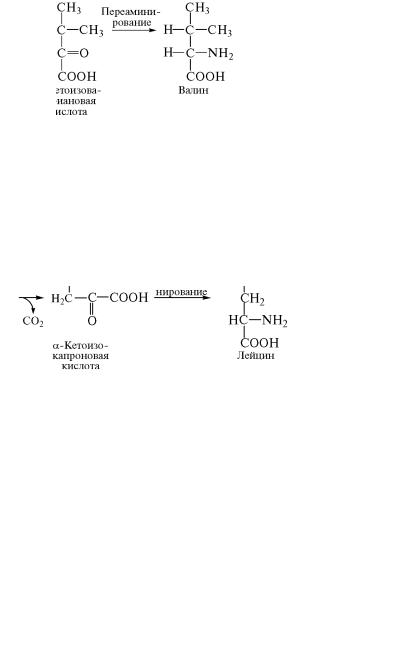
Кетоаналог аминокислоты лейцина образуется путем удлин˝е- ния углеводородной цепи α-кетоизовалериановой кислоты, которое
осуществляется по такому же механизму, как и синтез α-кетоглу- таровой кислоты из щавелевоуксусной кислоты и ацетил-КоА˝ в цикле Кребса. Вначале к α-кетоизовалериановой кислоте присоеди-
няется ацетильный радикал от ацетил-КоА. Затем путем отще˝пления и последующего присоединения воды происходит переме˝щение гидроксильной группы из α- â β-положение, а под действием дегидрогеназы оксикислота превращается в α-кетокислоту. После ее декарбоксилирования и переаминирования полученного ˝про-
дукта образуется аминокислота лейцин.
431
Для синтеза цистеина используется минеральный сульфат, п˝о- ступающий в растение из почвы. Поэтому данный процесс име˝ет также важное значение как путь ассимиляции растениями су˝льфатов, т. е. включение их в состав органических веществ. В ход˝е та-
кой ассимиляции происходит поэтапное восстановление су˝льфата в сульфит и далее в сульфид, но не в свободном, а в связанном˝ со-
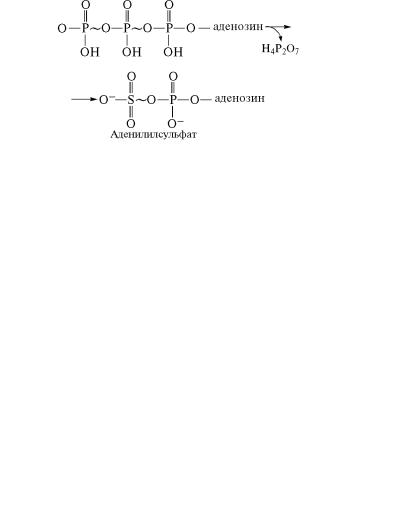
стоянии. На первом этапе с сульфатом реагирует АТФ под дей˝- ствием фермента АТФ-сульфурилазы. В результате этой реакции
образуется аденилилсульфат:
На следующем этапе под действием фермента аденилилсульфаткиназы аденилилсульфат фосфорилируется от АТФ по третьему углеродному атому рибозы и превращается в 3′-фосфоадено-
çèí-5′-фосфосульфат (ФАФС):
Активированный в виде ФАФС сульфат далее восстанавливается в сульфит НАДФ-зависимой редуктазой:
432
Кроме указанной реакции ФАФС выполняет функцию переносчика сульфурильной группы во многих других реакциях.
Восстановление сульфита в сульфид катализирует фермент˝ сульфитредуктаза, содержащая в своем составе два типа полипеп-
тидных субъединиц. Один из них является флавопротеидом, а˝ второй представляет собой гемсодержащий железосерный бело˝к. В
качестве восстановителя данный фермент использует восс˝тановленные динуклеотиды НАДФ · Н:
SO23– + 3ÍÀÄÔ · Í + 3Í+ → S2– + 3H2O + 3HAÄÔ+
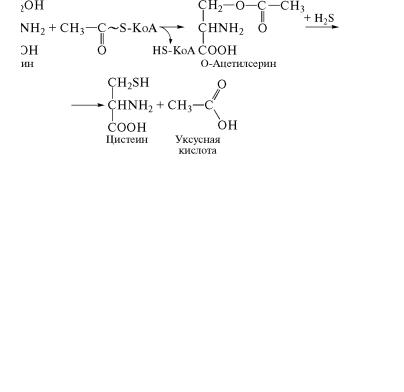
Непосредственно синтез цистеина катализирует фермент цистеинсинтетаза, содержащий в качестве кофермента пиридоксальфосфат. Субстратами данного фермента являются сульфидна˝я
ñåðà (Í2S) и активированный серин в виде О-ацетилсерина. В ак-
тивировании серина принимает участие ацетил-КоА:
В синтезе гистидина, играющего важную роль в качестве ком˝- понента каталитических центров ферментов, принимают уча˝стие
АТФ и фосфорибозилпирофосфат (ФРПФ), который образуется в˝
результате фосфорилирования рибозы.
433
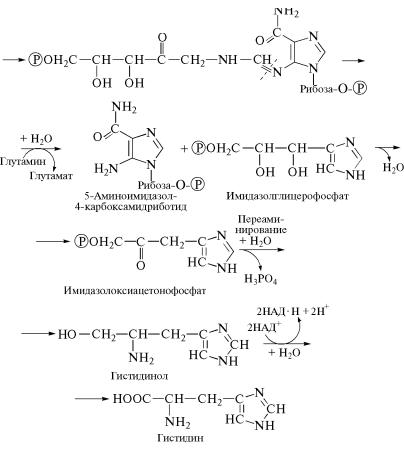
В ходе первой реакции происходит замещение пирофосфатно˝й группировки остатка рибозы на гетероциклический радика˝л аденина, входящий в состав АТФ. Затем образовавшийся продукт˝
подвергается перегруппировке, связанной с раскрытием ко˝льце-
вой структуры у аденина и рибозы фосфорибозилпирофосфат˝а. Продукт перегруппировки подвергается гидролизу и амини˝рованию за счет амидной группировки глутамина, в результате ч˝его он расщепляется на два продукта: имидазолглицерофосфат и нуклеотидное производное — 5-аминоимидазол-4-карбоксами˝дри-
ботид, которое является промежуточным соединением в синт˝езе
АТФ. Имидазолглицерофосфат далее используется для превр˝ащения в гистидин. В результате дегидратации из него образуе˝тся ке-
топроизводное, которое далее подвергается переаминиров˝анию и
434
гидролизу, превращаясь в гидроксилпроизводное — гистид˝инол. На последнем этапе гистидинол окисляется, образуя гистид˝ин.
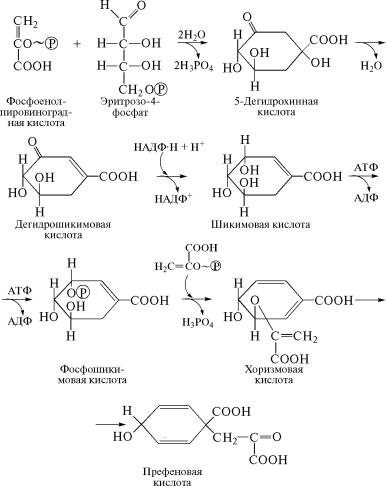
Ароматические аминокислоты фенилаланин и тирозин синте˝- зируются из эритрозо-4-фосфата и фосфоенолпировиноградно˝й
кислоты. В результате их конденсации и отщепления остатко˝в фосфорной кислоты образуется циклическое соединение — ˝5-де-
гидрохинная кислота.
Дегидрохинная кислота подвергается дегидратации и прев˝ра-
щается в 5-дегидрошикимовую кислоту, которая восстанавлив˝ает-
435
ся НАДФ-зависимым ферментом в шикимовую кислоту. На следующем этапе шикимовая кислота фосфорилируется от АТФ и конденсируется с фосфоенолпировиноградной кислотой, об˝разуя хоризмовую кислоту.
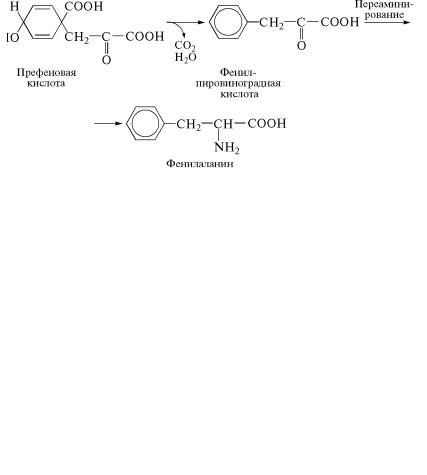
Превращение хоризмовой кислоты в префеновую катализиру˝ет фермент хоризматмутаза-префенатдегидратаза. Под действием
этого же фермента происходят декарбоксилирование и деги˝дратация префеновой кислоты и превращение ее в фенилпировиног˝-
радную кислоту, которая путем переаминирования образует˝ фенил-
аланин.
Под действием фермента хоризматмутазы-префенатдегидрат˝а- зы префеновая кислота также подвергается окислительном˝у де-
карбоксилированию с образованием ï-оксифенилпировиноград-
ной кислоты, которая вступает в реакцию переаминирования˝ и превращается в тирозин:
436

Промежуточный продукт синтеза фенилаланина и тирозина — хоризмовая кислота используется также для образования т˝риптофана. На первом этапе с участием фермента антранилатсинтетазы хоризмовая кислота превращается в антраниловую кислоту. В
ходе реакции происходит аминирование хоризмовой кислот˝ы от глутамина и отщепление от полученного продукта пировино˝град-
ной кислоты:
На следующей стадии антраниловая кислота реагирует с фос˝-
форибозилпирофосфатом (ФРПФ), образуя аминогликозид (N-5′- фосфорибозилантраниловую кислоту). В ходе этого превраще˝ния
аминогруппа антраниловой кислоты замещает пирофосфатну˝ю
группировку в молекуле фосфорибозилпирофосфата. Далее а˝ми-
ногликозид подвергается внутримолекулярной окислитель˝но-вос- становительной перегруппировке и декарбоксилированию, ˝образуя индол-3-глицерофосфат. В процессе перегруппировки про˝исходит раскрывание пентозного кольца остатка рибозы в мол˝екуле
аминогликозида и последующее декарбоксилирование образ˝овав-
шегося продукта, в результате чего инициируется замыкани˝е индольного кольца:
437

Образовавшийся в данной реакции индол-3-глицерофосфат на
следующем этапе под действием фермента триптофансинтетазы взаимодействует с серином. В качестве кофермента в активн˝ом
центре триптофансинтетазы содержится пиридоксальфосфа˝т, с
помощью которого осуществляется замещение в молекуле ин˝дол-
3-глицерофосфата глицерофосфатной группировки на радика˝л се-
рина. В процессе указанного превращения синтезируются дв˝а продукта — триптофан и 3-фосфоглицериновый альдегид:
Содержание свободных аминокислот в растительных тканях˝
подвержено постоянным изменениям. Значительное их колич˝е-
ство затрачивается на синтез белков, нуклеотидов, нуклеин˝овых кислот и других азотистых соединений. Другая часть аминок˝ислот превращается в безазотистые вещества — углеводы, жиры, о˝ргани- ческие кислоты, фенольные соединения. Концентрация проте˝и-
ногенных аминокислот существенно возрастает, когда иниц˝ииру-
ется распад белков.
11.2. ПРЕВРАЩЕНИЕ И РАСПАД АМИНОКИСЛОТ
Основной путь превращения аминокислот в безазотистые со˝-
единения — это их дезаминирование, приводящее к образов˝а-
нию кетокислот и аммонийной формы азота. У растений пре-
438
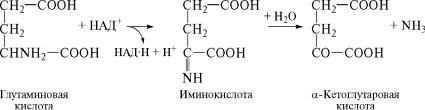
имущественно происходят реакции окислительного дезамин˝ирования, которые по своему механизму обратны реакциям восст˝а- новительного аминирования и поэтому катализируются тем˝и же ферментами — дегидрогеназами. На первом этапе под дейст˝вием
дегидрогеназы от аминокислоты отщепляется водород с обр˝азованием иминокислоты. На втором этапе иминокислота подвер˝гается гидролизу, продуктами которого являются кетокислот˝а и
аммиак.
При рассмотрении реакций восстановительного аминирован˝ия было отмечено, что в растительных тканях наиболее высокую˝ активность проявляет фермент глутаматдегидрогеназа. Этот˝ же фермент играет важную роль в осуществлении реакций окислите˝льного дезаминирования. Процесс дезаминирования глутаминов˝ой кислоты под действием глутаматдегидрогеназы может быть˝ представлен в виде следующих реакций:
Образовавшаяся в результате дезаминирования α-кетоглутаро- вая кислота далее может вступать в реакции переаминирова˝ния с различными аминокислотами и снова превращаться в глутам˝и-
новую кислоту, которая вновь подвергается дезаминирован˝ию. По такому же механизму действуют и другие дегидрогеназы, кат˝али-
зирующие обратимые реакции восстановительного аминиров˝ания
и окислительного дезаминирования. Таким образом, в резуль˝тате совместного действия дегидрогеназ и аминотрансфераз ам˝инокислоты довольно легко превращаются в соответствующие кето˝кислоты и аммиак.
В свою очередь, кетокислоты могут снова использоваться дл˝я синтеза аминокислот или подвергаться декарбоксилирован˝ию.
Декарбоксилирование кетокислот катализируют ферменты д˝екарбоксилазы, имеющие в качестве кофермента тиаминпирофосф˝ат. Продуктами этих реакций являются СО2 и соответствующие аль-
дегиды, которые далее окисляются в кислоты под действием ˝фер-
ментов альдегидоксидаз èëè дегидрогеназ альдегидов. В общем виде
процесс превращения α-кетокислот в карбоновые кислоты можно
представить в виде следующих реакций:
439

Образовавшиеся в этих реакциях карбоновые кислоты включ˝а-
ются в синтез жирных кислот или подвергаются α- è β-окисле-
íèþ.
Наряду с дезаминированием в организмах довольно активно˝
происходит декарбоксилирование аминокислот, которое ка˝тали-
зируют двухкомпонентные ферменты — декарбоксилазы аминокислот, имеющие в качестве кофермента производное витамина В6 —
пиридоксальфосфат. Хорошо изученным представителем так˝их
ферментов является глутаматдекарбоксилаза (4.1.1.15), с участием которой из глутаминовой кислоты образуется γ-аминомасляная
кислота и выделяется СО2:
В опытах показано, что особенно активно происходит накопление γ-аминомасляной кислоты в стареющих листьях, а также при прорастании семян, когда интенсивно осуществляются расп˝ад запасных белков и превращения аминокислот.
По такому же механизму происходит декарбоксилирование а˝с-
парагиновой кислоты с образованием β-аланина:
440
