
- •Кондуктометрический метод анализа
- •Подвижность ионов* при 25 °с
- •Зависимость электропроводности от концентрации
- •Лабораторные работы
- •1. Определение концентрационной зависимости электропроводности сильного электролита. Порядок выполнения работы
- •2. Определение удельной электропроводности воды. Порядок выполнения работы
- •3. Проверка закона разбавления Оствальда методом электропроводности.
- •Контрольные вопросы.
- •Кондуктометрическое титрование.
- •Определение иона so42- методом кондуктометрического титрования
- •5. Определение соляной и уксусной кислот при совместном присутствии
- •Фотометрический метод анализа
- •Лабораторные работы
- •Фотометрическое определение железа (III) методом сравнения
- •2. Фотометрическое определение меди в растворе методом градуировочного графика
- •Контрольные вопросы
- •РефрактометриЧеский метод анализа
- •Поляризация и рефракция молекул
- •Лабораторные работы
- •1.Определение содержания спирта в растворе
- •2. Идентификация вещества по значению его показателя преломления и молярной рефракции.
- •3.Определение влаги в растительных маслах.
- •Контрольные вопросы
- •Импульсный метод ямр
- •Лабораторные работы
- •1.Исследование структурных и сорбционных характеристик вещества импульсным методом ядерного магнитного резонанса.
- •2. Определение концентрации парамагнитных ионов в растворе импульсным методом ямр.
- •Коэффициенты релаксационной эффективности
- •Контрольные вопросы
- •Хроматографический метод анализа
- •Лабораторные работы
- •Определение натрия и аммония при совместном присутствии методом ионообменной хроматографии.
- •Разделение и обнаружение ионов методом бумажной хроматографии
- •Контрольные вопросы
- •Радиометрический метод
- •Некоторые типы радиоактивных превращений
- •Регистрация излучений
- •Лабораторные работы
- •Определение характеристик счетчика Гейгера-Мюллера
- •Снятие кривых ослабления радиоактивного излучения в различных материалах
- •Контрольные вопросы
- •Исследование поверхностных явлений
- •Лабораторная работа
- •Исследование адсорбции поверхностно-активных веществ (пав)
- •На границе раздела раствор - газ
- •Контрольные вопросы
- •Список литературы
- •Содержание
- •424000 Йошкар-Ола, пл. Ленина, 3
- •424006 Йошкар-Ола, ул. Панфилова, 17
3. Проверка закона разбавления Оствальда методом электропроводности.
Согласно закону
разбавления Оствальда, для константы
диссоциации бинарного электролита
можно записать:![]()
K=![]()
![]()
Учитывая, что степень диссоциации α приближенно равна отношению эквивалентных электропроводностей изучаемого раствора λ и при бесконечном разбавлении λ 0 , имеем
![]() K=
K=![]()
Порядок выполнения работы
Приготовить растворы слабой кислоты (CH3COOH) концентрации 0,1; 0,03; 0,01; 0,003; 0,001 M.
Измерить удельную электропроводность этих растворов. С учетом удельной электропроводности воды рассчитать эквивалентную электропроводность исследованных растворов.
Результаты представить в виде таблицы:
Концентрация растворов,
г-экв/л

lg C
χ раствора
Κ воды
λ
lg λ
Построить графики зависимости χ от с и lg λ от lg c.
Контрольные вопросы.
Сформулируйте понятия электропроводности и удельной электропроводности раствора. Как они связаны между собой.
Поясните влияние различных факторов на удельную электропроводность электролитов.
Какая физическая величина называется эквивалентной электропроводностью. В каком случае ее величина достигает предельного значения.
Поясните зависимость эквивалентной электропроводности от концентрации. Чем обусловлены электрофоретический и релаксационный эффекты торможения ионов.
Поясните причины аномально высокой подвижности ионов водорода и гидроксид-ионов в водных растворах.
Кондуктометрическое титрование.
При добавлении одного электролита к другому (в результате протекающих химических реакций) ионный состав раствора изменяется, при этом меняется и электропроводность раствора.
Поэтому измерение электропроводности применяется для определения эквивалентной точки в процессе титрования, если имеется значительная разница в электропроводности между исходным раствором и реактивом или продуктом реакции. Кондуктометрическое титрование широко применяется в практике химико-аналитических лабораторий, при анализе смеси кислот, солей и т. п.
Рассмотрим, как изменяется удельная электропроводность в процессе титрования раствора сульфата натрия раствором ацетата бария: Na2SO4 + Ва (CH3COO)2= BaSO4 + 2 CH3COONa, или
2 Na+ + SO42-+ Ва2+ + 2 CH3COO- = BaSO4 + 2Na+ +2 CH3COO-
Перед титрованием электропроводность раствора определяется подвижностью ионов Na+ (U=52) и SO42- (V=83). В процессе титрования концентрация ионов Na+ остается постоянной и на изменение электропроводности раствора не влияет; сульфат-ионы связываются в малорастворимый осадок BaSO4 и заменяются менее подвижными ацетат-ионами (V=42); это и приводит к уменьшению общей электропроводности раствора (отрезок «аЬ», рис. 1). После того, как все ионы будут осаждены, прибавление последующих порций реактива вызовет значительное повышение концентрации ионов Ва2+ и CH3COO- в титруемом растворе. Это приведет к резкому увеличению электропроводности раствора (участок «bс»).
При кондуктометрическом титровании точку эквивалентности находят, строя график зависимости электропроводности от объема израсходованного реактива. При этом получают не менее четырех отсчетов электропроводности до точки эквивалентности и четыре — после точки эквивалентности. Через полученные точки проводят прямые линии. Точка пересечения этих линий соответствует точке эквивалентности.
Для уменьшения влияния разбавления на электропроводность, титрование, как правило, проводят в 10—20 раз более концентрированным раствором реактива.
Тип кривой, изображенной на рис. 1, получается во всех случаях, когда более подвижный ион в процессе титрования заменяется менее подвижным; если подвижности примерно одинаковы, то зависимость изменения электропроводности будет аналогична кривой, изображенной на рис.2. Например, титрование уксуснокислого кальция раствором оксалата натрия:
Са (CH3COO)2 + Na2C2O4 = Ca2C2O4+ 2 CH3COONa
Может быть и так, что при титровании электропроводность и до точки эквивалентности, и за этой точкой возрастает, если ион замещается на более подвижный (рис.3). Например, такой ход кривой наблюдается при титровании сульфата натрия гидроокисью бария:
Na2SO4 + Ва (ОН)2= BaSO4 + 2NaOH
Р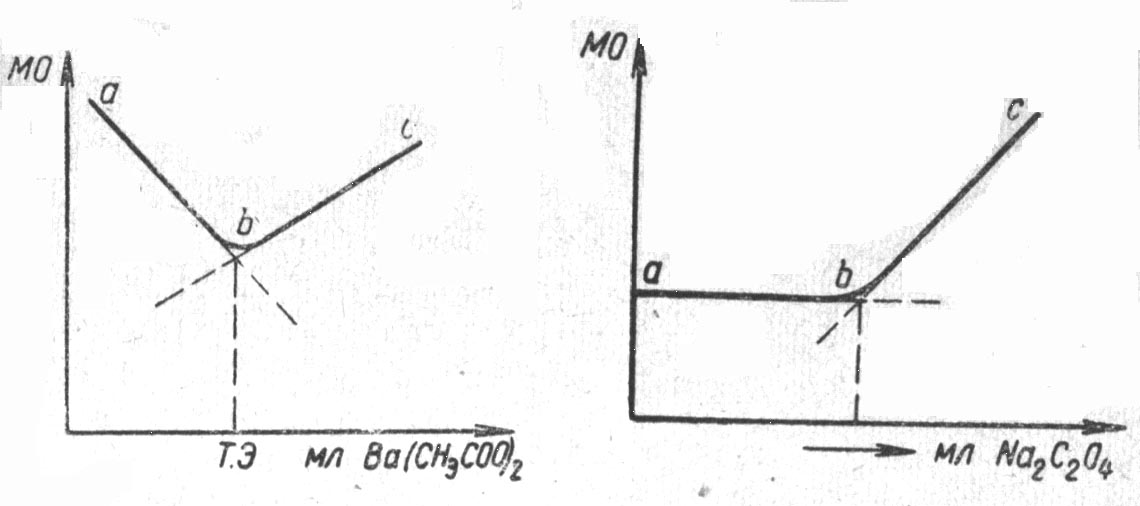 ис.1.
Кривая кондуктометрического титрования
сульфата
натрия ацетатом бария
ис.1.
Кривая кондуктометрического титрования
сульфата
натрия ацетатом бария
Рис.2. Кривая кондуктометрического
титрования ацетата кальция оксалатом натрия
Для определения концентрации вещества кондуктометрическим титрованием используются реакции нейтрализации, образования малорастворимых осадков и реакции комплексообразования. Ниже рассматриваются типичные случаи титрования кислот и оснований. При титровании сильной кислоты сильным основанием (так же, как и при титровании сильного основания сильной кислотой) (рис. 4) электропроводность раствора вначале падает, так как ионы водорода с большой подвижностью замещаются на более медленные катионы. За точкой эквивалентности дальнейшие прибавления основания (или кислоты) приводят к увеличению электропроводности.
При титровании слабых кислот сильным основанием (или слабого основания сильной кислотой) ход кривой (рис. 4) искажается гидролизом соли, образующейся в процессе титрования. Появление нейтральной соли уменьшает диссоциацию слабой кислоты, вследствие чего вначале электропроводность раствора падает. С накоплением соли в растворе в результате ее гидролиза:
CH3COONa + H2O = NaOH + CH3COOH
малоподвижный ион СНзСОO- заменяется сильноподвижным ионом ОН- и вблизи точки эквивалентности электропроводность раствора несколько возрастает. Эти противоположные эффекты дают кривые с минимумом, положение которого зависит как от концентрации, так и силы слабой кислоты.
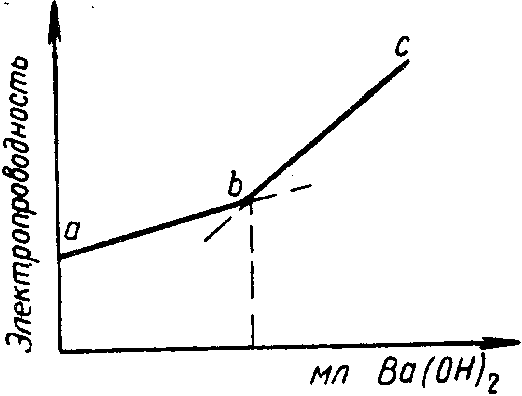
Рис 3. Кривая кондуктометрического титрования сульфата натрия гидроокисью бария
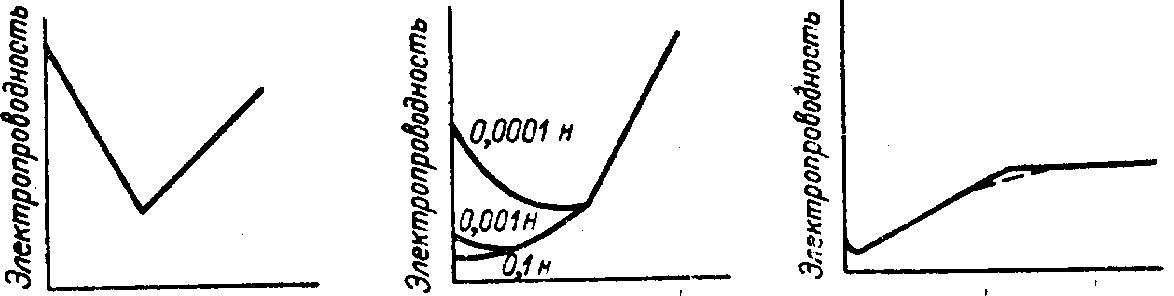
а) Объем NaOH б) Объем NaOH в) ОбъемNH4OH
Рис. 4. Кривые кондуктометрического титрования в реакциях нейтрализации:
а — сильная кислота — сильное основание; б — слабая кислота — сильное основание;
в — слабая кислота — слабое основание
При титровании слабой кислоты слабым основанием (или слабого основания слабой кислотой) электропроводность вначале возрастает (рис. 4), а после прибавления избытка реактива остается постоянной, так как слабое основание мало изменяет общую электропроводность раствора. Гидролиз в точке эквивалентности искажает кривую титрования и излома на кривой титрования не будет. В этом случае точку эквивалентности находят как пересечение прямолинейных участков на кривой титрования.
