
- •Зачем врачу нужна биологическая химия?
- •Аминокислоты используются в качестве лекарств
- •Классификация аминокислот
- •Двадцать аминокислот необходимы для синтеза белка
- •Аминокислоты обладают изомерией
- •Право- и левовращающие формы аланина
- •Для аминокислот характерна амфотерность
- •Изменение заряда аминокислот при смещении рН раствора в кислую или щелочную сторону.
- •Вторичный активный транспорт аминокислот через мембраны
- •Глутатионовая система транспорта
- •Транспорт аминокислот при участии глутатиона
- •Аминокислоты могут давать энергию
- •Пути превращений аминокислот по боковой цепи
- •Нейромедиаторы образуются из аминокислот
- •Гистамин
- •Реакция синтеза гистамина
- •Физиологические эффекты
- •Серотонин
- •Реакции синтеза серотонина
- •Гамма-аминомасляная кислота
- •Катаболизм аминокислот начинается с удаления аминогруппы
- •Трансаминирование нуждается в витамине в6
- •Механизм реакции трансаминирования
- •Реакции полного цикла трансаминирования
- •Аминотрансферазы имеют клиническое значение
- •Реакции, катализируемые аланинаминотрансферазой и аспартатаминотрансферазой
- •Креатинфосфат - срочный резерв энергии
- •Использование креатинфосфата для ресинтеза атф
- •Образование креатинина из креатинфосфата
- •Реакции синтеза креатина в почках и печени
- •Синтез креатинфосфата
- •В мышце дезаминирование аминокислот идет особым образом
- •Реакции непрямого дезаминирования аминокислот в мышечной ткани
- •В клетках постоянно образуется аммиак
- •Основные источники аммиака
- •Связывание аммиака
- •Реакция синтеза глутаминовой кислоты
- •Реакция синтеза глутамина
- •Реакция синтеза аспарагина
- •Транспорт аммиака
- •Глюкозо-аланиновый цикл
- •Реакции глюкозо-аланинового цикла (выделен рамкой).
- •Накопление аммиака представляет проблему
- •Гипотезы токсичности аммиака
- •Наследственные и приобретенные формы гипераммониемий Приобретенные формы
- •Наследственные формы
- •Для удаления аммиака есть два способа
- •Реакция дезаминирования глутамина
- •Синтез мочевины
- •Реакция синтеза карбамоилфосфата и орнитиновый цикл Синтез аммонийных солей
- •Реакции синтеза аммонийных солей Пути использования аспартата и глутамата
- •Серин и глицин превращаются друг в друга
- •Реакция взаимопревращения глицина и серина
- •Пути использования серина и глицина Обмен некоторых аминокислот тесно связан
- •Взаимосвязь обмена серина, глицина, метионина и цистеина
- •Клиническая картина
- •Основы лечения
- •Фенилкетонурия 2 типа
- •Основы лечения
- •Основы лечения
- •Альбинизм Этиология
- •Клиническая картина
- •Основы лечения
- •Нарушение обмена метионина и цистеина
- •Цистиноз нефропатический поздний
- •Цистиноз доброкачественный взрослых
- •Основы лечения
- •Нарушение распада лейцина, валина, изолейцина
- •Основы лечения
- •Изовалератацидемия
- •Нарушение обмена триптофана
- •Реакции катаболизма триптофана
- •Главное в белке - последовательность аминокислот
- •Участок белковой цепи длиной в 6 аминокислот (Сер-Цис-Тир-Лей-Глу-Ала) (пептидные связи выделены желтым цветом, аминокислоты - красной рамкой)
- •Укладка белка в виде каната и гармошкой
- •Участие водородных связей в формировании вторичной структуры
- •Укладка белка в виде β-складчатого слоя
- •Свертывание белка в глобулу
- •Часть белков является олигомерами
- •Свойства белков следуют из их строения
- •Амфотерность
- •Влияние рН на заряд белка
- •Растворимость
- •Растворы белков - коллоидные растворы
- •Белки можно удалить из раствора
- •Денатурация
- •1. Физическая денатурация
- •2. Химическая денатурация
- •Высаливание
- •Осаждение водоотнимающими средствами
- •Простых белков немного
- •Альбумины
- •Глобулины
- •Картина электрофореза белков сыворотки крови
- •Гистоны
- •Протамины
- •Коллаген
- •Эластин
- •Роль десмозина в соединении белков
- •Нуклеопротеины отвечают за продолжение жизни клетки
- •Сравнение строения азотистого основания, нуклеозида и нуклеотида
- •Строение и функции рнк и днк
- •Фосфопротеины - это, как правило, ферменты
- •Способ присоединения фосфата к белку на примере серина и тирозина Фосфорная кислота может выполнять:
- •Изменение конформации белка в фосфорилированном и дефосфорилированном состоянии
- •Липопротеины имеют огромное клиническое значение
- •Выделяют четыре основных класса липопротеинов:
- •Для гликопротеинов характерна структурная роль
- •Гликопротеины
- •Способ присоединения углевода к белку Функцией гликопротеинов являются:
- •Протеогликаны
- •Строение гиалуроновой кислоты и хондроитинсульфата
- •Хромопротеины придают тканям цвет
- •Переваривание белков начинается в желудке
- •Соляная кислота
- •Синтез соляной кислоты Функции соляной кислоты
- •Гастриксин
- •В тонком кишечнике белки должны полностью расщепляться
- •Трипсин
- •Химотрипсин
- •У детей свои причуды Особенности переваривания белков у детей Желудок
- •Кишечник
- •Проблемы жкт влияют на весь организм
- •Пищевые аллергии
- •Превращение аминокислот в толстом кишечнике
- •Реакции превращения тирозина и триптофана
- •Реакции првращения лизина и аргинина Целиакия
- •На чем основан ферментативный катализ?
- •Сходство и отличия ферментов и неорганических катализаторов
- •Этапы катализа
- •Механизмы катализа
- •Типы ферментативных реакций
- •Структурно-функциональная организация ферментов
- •Изоферменты
- •Мультиферментные комплексы
- •Строение мульферментного комплекса
- •Что означает выражение "активность фермента"?
- •Основы количественного определения активности ферментов
- •От чего зависит активность ферментов? Свойства ферментов
- •1. Зависимость скорости реакции от температуры
- •2. Зависимость скорости реакции от рН
- •Механизмы специфичности
- •Активность ферментов в клетке непостоянна
- •Регуляция активности ферментов
- •2. Компартментализация
- •3. Изменение количества фермента
- •4. Ограниченный (частичный) протеолиз проферментов
- •5. Аллостерическая регуляция
- •Общий принцип аллостерической регуляции
- •Регуляция фосфофруктокиназы конечным продуктом
- •6. Белок-белковое взаимодействие
- •Принципиальная схема активации аденилатциклазы
- •Ингибирование ферментов
- •Необратимое ингибирование
- •Механизм необратимого ингибирования ацетилхолинэстеразы
- •Механизм необратимого ингибирования циклооксигеназы Обратимое ингибирование
- •Конкурентное ингибирование
- •Конкурентное ингибирование сукцинатдегидрогеназы
- •Сходство строения сульфаниламидов и парааминобензойной кислоты, компонента витамина в9 Неконкурентное ингибирование
- •Ферменты востребованы в медицине
- •Энзимодиагностика
- •Энзимотерапия
- •Использование ферментов в медицинских технологиях
- •Использование ингибиторов ферментов
- •Оксидоредуктазы
- •Систематическое название образуется:
- •Трансферазы
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Свойства витаминов
- •Гиповитаминозы
- •Витамин а (ретинол, антиксерофтальмический)
- •Участие ретиноевой кислоты в дифференцировке, делении и росте клеток
- •Гипервитаминоз
- •Гиповитаминоз Приобретенный гиповитаминоз Причина
- •Клиническая картина
- •Наследственный гиповитаминоз
- •Гипервитаминоз
- •Гиповитаминоз
- •Гиповитаминоз
- •Антивитамины в1
- •Гиповитаминоз
- •Гиповитаминоз
- •Гиповитаминоз
- •Гиповитаминоз Причина
- •Клиническая картина
- •Лекарственные формы
- •Клиническая картина
- •Витамин н (биотин, антисеборейный)
- •Реакция карбоксилирования пропионил-sКоА с участием биотина
- •Гиповитаминоз Причина
- •Клиническая картина
- •Лекарственные формы
- •Азотистые основания имеют циклическое строение
- •Реакции синтеза амф и гмф
- •Лекарственная регуляция
- •Пурины распадаются с образованием мочевой кислоты
- •Реакции катаболизма пуринов
- •Реакции катаболизма пуриновых нуклеотидов Пуриновые основания должны использоваться повторно Реутилизация пуриновых оснований
- •Реакции реутилизации гуанина и гипоксантина
- •Накопление мочевой кислоты бьет по суставам и почкам
- •Нарушения обмена пуринов Подагра
- •Основы лечения
- •Мочекаменная болезнь
- •Основы лечения
- •Синдром Леша-Нихана
- •Синтез пиримидиновых нуклеотидов линейный
- •1. Образование карбамоилфосфата
- •2. Образование пиримидинового кольца
- •Синтез уридинмонофосфата
- •Регуляция синтеза пиримидинов Лекарственная регуляция
- •Распад пиримидинов идет до аммиака, углекислого газа и воды
- •Реакции катаболизма пиримидиновых нуклеотидов
- •Приобретенная форма
- •Существуют три процесса молекулярной биологии
- •Основной постулат молекулярной биологии
- •Центральная догма молекулярной биологии
- •Репликация происходит перед делением клетки
- •Фазы клеточного цикла
- •Синтез днк не настолько сложен как кажется Репликация днк
- •Повреждения и репарация днк
- •Рнк получает наследственную информацию Транскрипция (синтез рнк)
- •Стадии транскрипции
- •Инициация
- •Сзема процесса транскрипции
- •Процессинг предшественника рибосомальной рнк
- •Процессинг предшественника транспортной рнк
- •Лактозный оперон
- •Триптофановый оперон
- •Регуляция у эукариот Существенное усложнение эукариотических организмов повлекло за собой появление новых способов регуляции активности транскрипции:
- •Лекарственная регуляция транскрипции Ингибирование
- •Активация
- •Проблема перекодировки решена очень изящно
- •Генетический код
- •Адапторная роль транспортных рнк
- •Реакция синтеза аминоацил-тРнк
- •Синтез белков обеспечивают рибосомы Трансляция (синтез белка)
- •Инициация
- •События стадии инициации
- •Элонгация
- •Последовательность событий стадии элонгации
- •Образование пептидной связи при встраивании четвертой аминокислоты в пептид. Субъединицы рибосомы, большая часть транспортных рнк и матричная рнк не показаны.
- •Терминация
- •Реакции стадии терминации Полирибосомы
- •Новосинтезированным белкам надо "созреть"
- •Посттрансляционная модификация белков
- •Фолдинг белков
- •Трансляция является хорошей мишенью для лекарств
- •1. Инактивация факторов инициации
- •2. Нарушение кодон-антикодонового взаимодействия
- •3. Блокада стадии элонгации
- •Строение и обмен углеводов Углеводы дают энергию и строят органы
- •Функции
- •Углеводы - это производные спиртов
- •Классификация углеводов
- •Моносахариды - это структурная единица любых углеводов
- •Дисахариды часто присутствуют в пище
- •Строение крахмала и гликогена
- •Строение целлюлозы Гетерополисахариды
- •Строение гиалуроновой и хондроитинсерной кислот
- •Углеводы легко усваиваются
- •Роль целлюлозы в пищеварении
- •У детей свои причуды Особенности переваривания углеводов у детей
- •С усвоением лактозы и сахарозы бывают проблемы
- •Транспорт моносахаридов через мембраны энтероцитов Транспорт из крови через мембраны клеток
- •Пищевые моносахариды должны превратиться в глюкозу
- •Взаимопревращение сахаров
- •Превращение галактозы
- •Превращение галактозы в глюкозу Нарушения превращения галактозы
- •Превращение фруктозы
- •Пути метаболизма фруктозы и ее превращение в глюкозу
- •Наследственная фруктозурия
- •Глюкоза имеет широкие возможности
- •Активация глюкозы
- •Реакции фосфорилирования и дефосфорилирования глюкозы
- •Судьба глюкозы
- •Реакции превращения глюкозы в клетке
- •Гликоген - это легкоиспользуемый резерв энергии
- •Метаболизм гликогена
- •Мобилизация гликогена (гликогенолиз)
- •Роль ферментов в расщеплении гликогена Синтез гликогена
- •Реакции синтеза удф-глюкозы
- •Химизм реакции гликогенсинтазы
- •Роль гликогенсинтазы и гликозилтрансферазы в синтезе гликогена Синтез и распад гликогена реципрокны
- •Изменение активности ферментов обмена гликогена в зависимости от условий Способы активации синтазы гликогена
- •Способы активации фосфорилазы гликогена
- •Ковалентная модификация фосфорилазы
- •Аденилатциклазный способ активации фосфорилазы гликогена
- •Мышечные гликогенозы
- •Глюкоза – это источник оксалоацетата
- •Бескислородное окисление глюкозы включает два этапа
- •Гликолиз
- •Первый этап гликолиза
- •Второй этап гликолиза
- •Анаэробный гликолиз - самодостаточный процесс
- •Переключение между аэробным и анаэробным окислением происходит автоматически
- •Эффект Пастера
- •Роль лактатдегидрогеназы в клетке
- •Надн гликолиза могут доставляться в митохондрии
- •Челночные системы
- •Глицеролфосфатный челночный механизм
- •Малат-аспартатный челночный механизм
- •Насколько выгодно окисление глюкозы?
- •Расчет атф при анаэробном окислении
- •Аэробное окисление
- •Организм должен уметь синтезировать глюкозу
- •Глюкозо-лактатный (выделен желтым) и глюкозо-аланиновый циклы
- •Синтез глюкозы энергетически дорог
- •Обход десятой реакции гликолиза
- •Упрощенный вариант обхода десятой реакции гликолиза
- •Обход десятой реакции гликолиза
- •Регуляция глюконеогенеза
- •Гормональные и метаболические факторы, регулирующие гликолиз и глюконеогенез Регуляция гликолиза
- •Глюкоза в крови строго контролируется
- •Физиологические
- •Обезвреживание этанола
- •Реакции окисления этанола и ацетальдегида
- •Побочные эффекты обезвреживания этанола
- •Спиртовое брожение
- •Специфические реакции спиртового брожения Для синтеза рибозы и надфн существует специальный путь
- •Пентозофосфатный путь
- •Первый этап
- •Особенность пентозного шунта при активном синтезе днк Нарушения пентозофосфатного пути есть у многих людей
- •Роль надфн в антиоксидантной системе клетки
- •Функции липидов жестко связаны с их строением
- •Резервно-энергетическая функция
- •Свойства и функции липидов зависят от жирных кислот
- •Строение жирных кислот
- •Пищевые источники
- •Роль жирных кислот
- •У эйкозаноидов широкие возможности
- •Синтез эйкозаноидов
- •Строение триацилглицеролов
- •Пищевые источники
- •О гликолипидах известно немного
- •Строение гликолипидов
- •Строение церамида
- •Общее строение гликолипидов у фосфолипидов преобладает структурная функция
- •Пищевые источники фосфолипидов
- •Глицерофосфолипиды
- •Строение преобладающих в организме фосфолипидов
- •Строение менее распространенных фосфолипидов Сфингофосфолипиды
- •Холестерол жизненно необходим клеткам
- •Источники
- •Выведение из организма
- •Функции холестерола
- •Болезни накопления липидов называются липидозы
- •Липидозы
- •Дефектный фермент при болезни Гоше
- •Дефектный фермент при болезни Нимана-Пика
- •Дефектный фермент при болезни Тея-Сакса
- •Переваривание жиров идет в кишечнике Эмульгирование и гидролиз липидов
- •Переваривание в ротовой полости
- •Переваривание в желудке
- •Переваривание в кишечнике
- •Полный ферментативный гидролиз триацилглицерола
- •Действие фосфолипазы а2 и лизофосфолипазы на примере фосфатидилхолина
- •Образование мицелл
- •Без желчи липиды не переварятся
- •Роль желчи
- •Образование желчных кислот
- •Реакция активации жирной кислоты
- •Глицеролфосфатный путь образования таг
- •Нарушение желчевыделения
- •Причины нарушения формирования желчи и возникновения холелитиаза
- •У детей свои причуды Особенности переваривания жира у детей
- •Транспорт липидов - отдельная задача
- •Строение липопротеина
- •Хиломикроны и лпонп переносят триацилглицеролы
- •Характеристика хиломикронов Общая характеристика
- •Функция
- •Метаболизм
- •Характеристика липопротеинов очень низкой плотности Общая характеристика
- •Функция
- •Метаболизм
- •Обмен таг и фл - это обмен жирных кислот
- •Состояние покоя и отдыха в абсорбтивный период
- •Возможные источники и пути использования жирной кислоты в клетке Голодание, мышечная работа, покой в постабсорбтивный период
- •Триацилглицеролы нужны при нагрузке
- •Общая схема мобилизации таг и использования жирных кислот Активность таг-липазы зависит от гормонов
- •Гидролиз триацилглицеролов липазами жировой клетки
- •Активация триацилглицерол-липазы
- •Каскадный механизм активации таг-липазы
- •Последовательность реакций β-окисления жирных кислот Расчет энергетического баланса β-окисления
- •Пример. Окисление пальмитиновой кислоты
- •Окисление нечетных и ненасыщенных жирных кислот
- •Пример. Окисление линолевой кислоты
- •Кетоновые тела - это способ транспорта ацетильной группы
- •Строение кетоновых тел
- •Синтез кетоновых тел (кетогенез)
- •Реакции синтеза и утилизации кетоновых тел
- •Жиры синтезируются только при наличии энергии
- •Общая схема биосинтеза триацилглицеролов и холестерола из глюкозы
- •Синтез жирных кислот не похож на путь их окисления
- •Поступающий из митохондрий цитрат в цитозоле расщепляется атф-цитрат-лиазой до оксалоацетата и ацетил-sКоА.
- •Образование ацетил-sКоА из лимонной кислоты
- •Активные группы синтазы жирных кислот
- •Реакции синтеза жирных кислот Удлинение цепи жирных кислот
- •Синтез фл и таг тесно связаны
- •Общая схема реакций синтеза триацилглицеролов и фосфолипидов
- •Синтез таг - это запасание энергии Синтез триацилглицеролов
- •Реакции синтеза таг из фосфатидной кислоты
- •Синтез таг - это запасание энергии Синтез триацилглицеролов
- •Реакции синтеза таг из фосфатидной кислоты
- •Обмен жирных кислот и таг регулируется
- •1. Изменение количества ферментов
- •2. Ковалентная модификация
- •Регуляция активности ацетил-sКоА-карбоксилазы
- •Способы регуляции реакций обмена триацилглицеролов Метаболическая регуляция
- •Нарушения обмена таг связаны с образом жизни Жировая инфильтрация (дистрофия, перерождение) печени
- •Принцип лечения
- •Первичное ожирение
- •Вторичное ожирение
- •Принцип лечения
- •Инсулиннезависимый сахарный диабет
- •Принцип лечения
- •Синтез холестерола должен быть согласован с его выведением
- •Биосинтез холестерола
- •Регуляция синтеза
- •Регуляция активности гидроксиметилглутарил-s-КоА-редуктазы
- •Транспорт холестерола и его эфиров в организме Липопротеины низкой плотности Общая характеристика
- •Функция
- •Нарушения транспорта липидов - дислипопротеинемии
- •Виды дислипопротеинемий
- •Тип I. Гиперхиломикронемия
- •Тип II. Гипер-β-липопротеинемия
- •2 Стадия – стадия начальных изменений
- •Процесс развития атеросклероза (в динамике слева-направо)
- •Медикаменты
- •В чем заключается метаболизм?
- •Анаболизм
- •Катаболизм
- •II этап
- •III этап
- •Роль атф
- •Кругооборот атф в жизни клетки Откуда в клетке атф? Способы получения энергии в клетке
- •Два способа синтеза атф
- •Пируват окисляется до уксусной кислоты
- •Пируватдегидрогеназный мульферментный комплекс
- •Суммарное уравнение окисления пировиноградной кислоты
- •Реакции синтеза ацетил-sКоА
- •Реакции образования надн Регуляция пируватдегидрогеназного комплекса
- •Регуляция активности пируватдегидрогеназы
- •Изменение скорости реакций цтк и причины накопления кетоновых тел при некоторых состояниях
- •Для чего образуются восстановленные над и фад?
- •Окислительное фосфорилирование
- •Принцип работы дыхательной цепи
- •Общие принцип окислительного фосфорилирования
- •Каким образом энергия водорода преобразуется в энергию атф? Механизм окислительного фосфорилирования
- •Строение дыхательной цепи и механизм окислительного фосфорилирования
- •Синтез атф регулируется
- •Дыхательный контроль
- •Зависимость электрохимического градиента от скорости движения электронов
- •На клеточное дыхание можно влиять
- •Гипоэнергетические состояния
- •Разобщители окисления и фосфорилирования
- •Роль термогенина в снижении протонного градиента
- •Ингибиторы ферментов дыхательной цепи
- •Ингибиторы ферментов дыхательной цепи Как подсчитать эффективность окисления? Коэффициент p/o
- •Расчет энергетической ценности и коэффициента р/о
- •Соотношение количества атф, неорганического фосфата и кислорода при окислении аспартата Окисление аланина
- •Соотношение количества атф, неорганического фосфата и кислорода при окислении аланина Классифицируют гормоны по-разному
- •Классификация по строению
- •Виды мембраносвязанных рецепторов
- •Три механизма передачи сигнала в зависимости от вида мембранных рецепторов
- •ЦиклоАмф является наиболее популярным мессенджером
- •Этапы передачи сигнала
- •Инозитолтрифосфат и даг тоже являются вторичными мессенджерами
- •Этапы передачи сигнала
- •Гидрофобные гормоны проникают внутрь клетки
- •Цитозольный механизм действия гормонов у гормонов существует четкая иерархия
- •Регуляция некоторых гормональных систем Гипоталамус - генералитет эндокринной системы
- •Соматотропный гормон
- •Патология Гипофункция
- •Гиперфункция
- •Пептиды проопиомеланокортина
- •Липотропный гормон
- •Регуляция секреции и эффекты антидиуретического гормона
- •Гиперфункция
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология Гипофункция
- •Гиперфункция
- •Гормоны поджелудочной железы
- •Механизм действия
- •Патология
- •Минералокортикоиды
- •Активация ренин-ангиотензин-альдостероновой системы
- •У женщин
- •Гормональные изменения во время менструального цикла Мишени и эффекты Эстрогены
- •Прогестерон
- •Патология
- •Патология Гипофункция
- •Гиперфункция
- •В крови пять фракций белков
- •Электрофорез белков
- •Общий вид электрофореза
- •Электрофореграмма (вверху) и графический результат ее обработки (внизу)
- •Нормальные величины белковых фракций плазмы крови
- •Типы протеинограмм
- •Белки крови выполняют серьезные задачи Функции белков плазмы крови
- •Альбумин - основной белок крови
- •Гиперальбуминемия
- •Гипоальбуминемия
- •Альфа1-глобулины включают большинство белков острой фазы
- •Альфа2-глобулины содержат протеазы и транспортные белки
- •Бета-глобулины - это чаще транспортные белки
- •Многие белки крови являются ферментами
- •Причины изменения активности ферментов в крови
- •Ферменты сыворотки крови
- •Единицы измерения активности ферментов
- •Не весь азот крови находится в белках
- •Происхождение и типы азотемий Фракции остаточного азота
- •Дефицит железа есть у трети населения
- •Железосодержащие белки
- •Пищевые источники
- •Всасывание
- •Метаболизм железа
- •Дефицит
- •Причины дефицита железа
- •Симптомы
- •Дефицит железа есть у трети населения
- •Железосодержащие белки
- •Пищевые источники
- •Всасывание
- •Метаболизм железа
- •Дефицит
- •Причины дефицита железа
- •Симптомы
- •Гемоглобин - основной белок крови
- •Строение гемоглобина
- •Нормальные формы гемоглобина
- •Патологические формы гемоглобина
- •У гемоглобина есть молекулярные болезни Серповидно-клеточная анемия
- •Нарушение синтеза гемоглобина Порфирии
- •Талассемии
- •Эффективность транспорта кислорода регулируется Изменение рН среды
- •Механизм эффекта Бора Кооперативное взаимодействие
- •Изменение формы субъединиц гемоглобина при присоединении кислорода
- •Гем требуется для многих ферментов
- •Распад гема - многостадийный процесс
- •Превращение в кишечнике
- •Токсичность билирубина состоит в его липофильности
- •Причины основных нарушений обмена билирубина Гемолитическая желтуха
- •Механическая желтуха
- •Паренхиматозная желтуха
- •Желтухи часто встречаются у новорожденных
- •Лабораторная диагностика
- •Роль внутриклеточных ионов водорода
- •Роль внеклеточных ионов водорода
- •Показатели кислотно-основного состояния
- •Водородный показатель
- •Нормальные величины
- •Концентрация бикарбонат-ионов
- •Нормальные величины
- •Клинико-диагностическое значение
- •Концентрация буферных оснований
- •Нормальные величины
- •Клинико-диагностическое значение
- •Общее содержание кислорода
- •Фосфатная буферная система
- •Белковая буферная система
- •Изменение заряда буферных групп белка при различных рН Гемоглобиновая буферная система
- •Длительная стабилизация сдвигов рН Физиологическая компенсация нарушений кос Дыхательная система
- •Костная ткань
- •Реабсорбция бикарбонат-ионов
- •Процесс реабсорбции бикарбонат-ионов
- •Ацидогенез
- •Процесс ацидогенеза в почечных канальцах
- •Аммониегенез
- •Процесс аммониегенеза в дистальных канальцах
- •Изменение кос - частая ситуация
- •Причины нарушений кислотно-основного состояния
- •Метаболический ацидоз Причины
- •1. Повышение содержания кислот в крови
- •2. Потеря бикарбонатов
- •Компенсация
- •2. Лихорадочные состояния
- •Использование показателя рСо2 для диагностики нарушений кислотно-основного состояния
- •Вода - главное вещество организма Роль воды в организме
- •Источники воды в клетке
- •Выведение воды из организма
- •Регуляция водного баланса
- •Почки - это не только удаление шлаков
- •Экскреторная функция
- •Регулирующая функция
- •Метаболическая функция
- •Гломерулярный фильтр пропускает большую часть веществ
- •Строение почечного фильтра
- •Реабсорбция в канальцах почек - процесс многоликий
- •Процессы реабсорбции в канальцах почек
- •Петля Генле обеспечивает реабсорбцию воды и солей
- •Процессы, происходящие в восходящей части петли Генле
- •Реабсорбция кальция происходит в дистальном отделе
- •События, происходящие в дистальной части нефрона
- •Конечный отдел нефрона определяет объем мочи
- •События, происходящие конечных отделах дистальных канальцев и собирательных трубочках Как оценить работу почек? Лабораторная оценка фильтрации
- •Лабораторная оценка реабсорбции
- •Прозрачность
- •Нормальные величины
- •Физиологические изменения
- •Патологические изменения
- •У мочи есть и другие особенности Поверхностное натяжение
- •Кислотно-основная реакция
- •Нормальные величины
- •Плотность
- •Неорганические компоненты мочи
- •Нормальные величины
- •Клинико диагностическое значение
- •Хлориды
- •Нормальные величины
- •Клинико диагностическое значение
- •Органические компоненты мочи Мочевина
- •Нормальные величины
- •Мочевая кислота
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Гиппуровая кислота
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Органические кислоты
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Пигменты
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Патологические компоненты мочи
- •Глюкоза
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Кетоновые тела
- •Печень перекрещивает метаболизм углеводов, липидов и белков
- •Взаимосвязь обмена белков, жиров и углеводов
- •Липидный обмен
- •Белковый обмен
- •Тесное взаимодействие синтеза мочевины и цтк Пигментный обмен
- •Оценка метаболической функции
- •Большая часть токсинов обезвреживается в печени
- •Места биотрансформации, задержки и выведения ксенобиотиков
- •Две фазы биотрансформации ксенобиотиков
- •Превращение индола в 1 и 2 фазах биотрансформации
- •Микросомы повышают реакционную способность молекул
- •Реакции микросомального окисления
- •Оценка реакций 1-й фазы
- •Конъюгирование резко повышает водорастворимость
- •Строение основных кислот реакций конъюгации
- •Строение глутатиона Иногда от обезвреживания становится хуже
- •Органотоксичность
- •Нормальный метаболизм парацетамола и причины его токсичности Химический канцерогенез
Серотонин
Серотонин активно синтезируется в тучных клетках кожи, легких, печени, в селезенке, ЦНС.

Реакции синтеза серотонина
Физиологические эффекты
стимулирует сокращение гладких мышц желудочно-кишечного тракта и, как следствие, повышение перистальтики ЖКТ;
выражено стимулирует сокращение гладких мышц сосудов, кроме сосудов миокарда и скелетных мышц и, как следствие, повышение артериального давления;
слабо увеличивает тонус гладких мышц бронхов;
в центральной нервной системе является тормозным медиатором;
в периферических нервных окончаниях обуславливает возникновение боли и зуда (например, при укусе насекомых).
Гамма-аминомасляная кислота
Синтез γ-аминомасляной кислоты (ГАМК) происходит исключительно в центральной нервной системе – в подкорковых образованиях головного мозга.
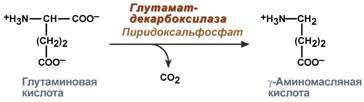
Реакция синтеза ГАМК
Физиологические эффекты
В центральной нервной системе ГАМК (наряду с глутаминовой кислотой) является тормозным медиатором. Наиболее высока ее роль в височной и лобной коре, гиппокампе, миндалевидных и гипоталамических ядрах, черной субстанции, ядрах мозжечка.
Дофамин
Синтез дофамина происходит в основном в нейронах промежуточного и среднего мозга.
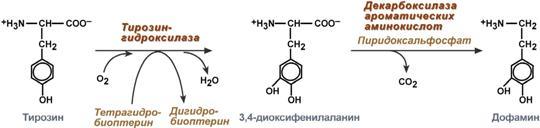
Реакции синтеза дофамина
Физиологические эффекты
Является медиатором дофаминовых рецепторов в подкорковых образованиях ЦНС, в больших дозах расширяет сосуды сердца, стимулирует частоту и силу сердечных сокращений, расширяет сосуды почек, увеличивая диурез.
Обезвреживание биогенных аминов
Существуют два типа реакций инактивация биогенных аминов – дезаминирование и метилирование.
Дезаминирование протекает с образованием свободного аммиака и с участием ФАД. Катализирует реакциюмоноаминоксидаза, она обнаружена во многих тканях, но наиболее активна в печени, желудке, почках, кишечнике, нервной ткани.
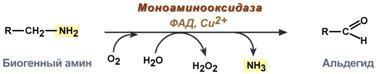
Реакция с участием моноаминоксидазы
Метилирование биогенного амина происходит при наличии у него гидроксильной группы (дофамин, серотонин). В реакции принимает участие активная форма метионина – S-аденозилметионин (SAM), образуется метилированная форма амина и S-аденозилгомоцистеин (SАГ).
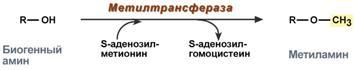
Реакция метилирования
Существуют 4 типа дезаминирования
Превращение аминокислот с участием NH2-группы сводится к ее отщеплению от углеродного скелета – реакции дезаминирования.
Типы дезаминирования
внутримолекулярное – с образованием ненасыщенной жирной кислоты:
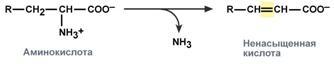
восстановительное – с образованием насыщенной жирной кислоты:

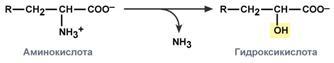
гидролитическое – с образованием карбоновой гидроксикислоты:
окислительное – с образованием кетокислот:

У человека окислительное дезаминирование является основным путем катаболизма аминокислот. Однако такие аминокислоты как серин и гистидин могут терять аминогруппу с использованием других типов дезаминирования, а треонин сразу подвергается прямому расщеплению до глицина и ацетальдегида.
Катаболизм аминокислот начинается с удаления аминогруппы
У человека основным способом дезаминирования является окислительное дезаминирование. Выделяют два варианта окислительного дезаминирования: прямое и непрямое.
Прямое окислительное дезаминирование
Прямое дезаминирование катализируется одним ферментом, в результате образуется NH3 и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода (аэробное) и не нуждаться в кислороде (анаэробное).
1. Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН. В организме человека эти ферменты присутствуют, но практически неактивны.

Реакция, катализируемая оксидазами D- и L-аминокислот
2. Анаэробное прямое окислительное дезаминирование существует только для глутаминовой кислоты, катализируется только глутаматдегидрогеназой, превращающей глутамат в α-кетоглутарат. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных). Этот тип дезаминирования теснейшим образом связан с трансаминированием аминокислот и формирует с ним процесс трансдезаминирования (см ниже).

Реакция прямого окислительного дезаминирования глутаминовой кислоты
|
|
|
Непрямое окислительное дезаминирование (трансдезаминирование)
Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты – этот перенос называется трансаминирование иего механизм довольно сложен.
В качестве кетокислоты-акцептора ("кетокислота 2") в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат ("аминокислота 2").

Схема реакции трансаминирования
В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О. При необходимости (например, голодание) углеродный скелет глюкогенных аминокислот может использоваться для синтеза глюкозы вглюконеогенезе.
Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование. В организме человека дезаминированию подвергается только глутаминовая кислота. Второй этап осуществляется глутаматдегидрогеназой (перейти вверх).
В организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, и только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма, кроме мышечных.
Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называюттрансдезаминирование.
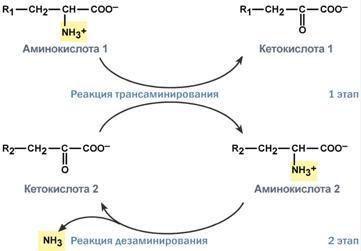
Схема обоих этапов трансдезаминирования
Если реакция идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза.
Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН.
Роль трансаминирования и трансдезаминирования
Реакции трансаминирования:
активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения,
обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога),
начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии,
необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза – для использования безазотистого остатка аминокислот в печени для кетогенеза и глюконеогенеза, вдругих органах – для его прямого вовлечения в реакции цикла трикарбоновых кислот.
при патологиях (сахарный диабет, гиперкортицизм) обуславливают наличие субстратов дляглюконеогенеза и способствуют патологической гипергликемии.
Продукт трансаминирования глутаминовая кислота:
является одной из транспортных форм аминного азота в гепатоциты,
способна реагировать со свободным аммиаком, обезвреживая его.
Процесс трансдезаминирования идет в организме непрерывно, потому что:
сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей.
