- •Зачем врачу нужна биологическая химия?
- •Аминокислоты используются в качестве лекарств
- •Классификация аминокислот
- •Двадцать аминокислот необходимы для синтеза белка
- •Аминокислоты обладают изомерией
- •Право- и левовращающие формы аланина
- •Для аминокислот характерна амфотерность
- •Изменение заряда аминокислот при смещении рН раствора в кислую или щелочную сторону.
- •Вторичный активный транспорт аминокислот через мембраны
- •Глутатионовая система транспорта
- •Транспорт аминокислот при участии глутатиона
- •Аминокислоты могут давать энергию
- •Пути превращений аминокислот по боковой цепи
- •Нейромедиаторы образуются из аминокислот
- •Гистамин
- •Реакция синтеза гистамина
- •Физиологические эффекты
- •Серотонин
- •Реакции синтеза серотонина
- •Гамма-аминомасляная кислота
- •Катаболизм аминокислот начинается с удаления аминогруппы
- •Трансаминирование нуждается в витамине в6
- •Механизм реакции трансаминирования
- •Реакции полного цикла трансаминирования
- •Аминотрансферазы имеют клиническое значение
- •Реакции, катализируемые аланинаминотрансферазой и аспартатаминотрансферазой
- •Креатинфосфат - срочный резерв энергии
- •Использование креатинфосфата для ресинтеза атф
- •Образование креатинина из креатинфосфата
- •Реакции синтеза креатина в почках и печени
- •Синтез креатинфосфата
- •В мышце дезаминирование аминокислот идет особым образом
- •Реакции непрямого дезаминирования аминокислот в мышечной ткани
- •В клетках постоянно образуется аммиак
- •Основные источники аммиака
- •Связывание аммиака
- •Реакция синтеза глутаминовой кислоты
- •Реакция синтеза глутамина
- •Реакция синтеза аспарагина
- •Транспорт аммиака
- •Глюкозо-аланиновый цикл
- •Реакции глюкозо-аланинового цикла (выделен рамкой).
- •Накопление аммиака представляет проблему
- •Гипотезы токсичности аммиака
- •Наследственные и приобретенные формы гипераммониемий Приобретенные формы
- •Наследственные формы
- •Для удаления аммиака есть два способа
- •Реакция дезаминирования глутамина
- •Синтез мочевины
- •Реакция синтеза карбамоилфосфата и орнитиновый цикл Синтез аммонийных солей
- •Реакции синтеза аммонийных солей Пути использования аспартата и глутамата
- •Серин и глицин превращаются друг в друга
- •Реакция взаимопревращения глицина и серина
- •Пути использования серина и глицина Обмен некоторых аминокислот тесно связан
- •Взаимосвязь обмена серина, глицина, метионина и цистеина
- •Клиническая картина
- •Основы лечения
- •Фенилкетонурия 2 типа
- •Основы лечения
- •Основы лечения
- •Альбинизм Этиология
- •Клиническая картина
- •Основы лечения
- •Нарушение обмена метионина и цистеина
- •Цистиноз нефропатический поздний
- •Цистиноз доброкачественный взрослых
- •Основы лечения
- •Нарушение распада лейцина, валина, изолейцина
- •Основы лечения
- •Изовалератацидемия
- •Нарушение обмена триптофана
- •Реакции катаболизма триптофана
- •Главное в белке - последовательность аминокислот
- •Участок белковой цепи длиной в 6 аминокислот (Сер-Цис-Тир-Лей-Глу-Ала) (пептидные связи выделены желтым цветом, аминокислоты - красной рамкой)
- •Укладка белка в виде каната и гармошкой
- •Участие водородных связей в формировании вторичной структуры
- •Укладка белка в виде β-складчатого слоя
- •Свертывание белка в глобулу
- •Часть белков является олигомерами
- •Свойства белков следуют из их строения
- •Амфотерность
- •Влияние рН на заряд белка
- •Растворимость
- •Растворы белков - коллоидные растворы
- •Белки можно удалить из раствора
- •Денатурация
- •1. Физическая денатурация
- •2. Химическая денатурация
- •Высаливание
- •Осаждение водоотнимающими средствами
- •Простых белков немного
- •Альбумины
- •Глобулины
- •Картина электрофореза белков сыворотки крови
- •Гистоны
- •Протамины
- •Коллаген
- •Эластин
- •Роль десмозина в соединении белков
- •Нуклеопротеины отвечают за продолжение жизни клетки
- •Сравнение строения азотистого основания, нуклеозида и нуклеотида
- •Строение и функции рнк и днк
- •Фосфопротеины - это, как правило, ферменты
- •Способ присоединения фосфата к белку на примере серина и тирозина Фосфорная кислота может выполнять:
- •Изменение конформации белка в фосфорилированном и дефосфорилированном состоянии
- •Липопротеины имеют огромное клиническое значение
- •Выделяют четыре основных класса липопротеинов:
- •Для гликопротеинов характерна структурная роль
- •Гликопротеины
- •Способ присоединения углевода к белку Функцией гликопротеинов являются:
- •Протеогликаны
- •Строение гиалуроновой кислоты и хондроитинсульфата
- •Хромопротеины придают тканям цвет
- •Переваривание белков начинается в желудке
- •Соляная кислота
- •Синтез соляной кислоты Функции соляной кислоты
- •Гастриксин
- •В тонком кишечнике белки должны полностью расщепляться
- •Трипсин
- •Химотрипсин
- •У детей свои причуды Особенности переваривания белков у детей Желудок
- •Кишечник
- •Проблемы жкт влияют на весь организм
- •Пищевые аллергии
- •Превращение аминокислот в толстом кишечнике
- •Реакции превращения тирозина и триптофана
- •Реакции првращения лизина и аргинина Целиакия
- •На чем основан ферментативный катализ?
- •Сходство и отличия ферментов и неорганических катализаторов
- •Этапы катализа
- •Механизмы катализа
- •Типы ферментативных реакций
- •Структурно-функциональная организация ферментов
- •Изоферменты
- •Мультиферментные комплексы
- •Строение мульферментного комплекса
- •Что означает выражение "активность фермента"?
- •Основы количественного определения активности ферментов
- •От чего зависит активность ферментов? Свойства ферментов
- •1. Зависимость скорости реакции от температуры
- •2. Зависимость скорости реакции от рН
- •Механизмы специфичности
- •Активность ферментов в клетке непостоянна
- •Регуляция активности ферментов
- •2. Компартментализация
- •3. Изменение количества фермента
- •4. Ограниченный (частичный) протеолиз проферментов
- •5. Аллостерическая регуляция
- •Общий принцип аллостерической регуляции
- •Регуляция фосфофруктокиназы конечным продуктом
- •6. Белок-белковое взаимодействие
- •Принципиальная схема активации аденилатциклазы
- •Ингибирование ферментов
- •Необратимое ингибирование
- •Механизм необратимого ингибирования ацетилхолинэстеразы
- •Механизм необратимого ингибирования циклооксигеназы Обратимое ингибирование
- •Конкурентное ингибирование
- •Конкурентное ингибирование сукцинатдегидрогеназы
- •Сходство строения сульфаниламидов и парааминобензойной кислоты, компонента витамина в9 Неконкурентное ингибирование
- •Ферменты востребованы в медицине
- •Энзимодиагностика
- •Энзимотерапия
- •Использование ферментов в медицинских технологиях
- •Использование ингибиторов ферментов
- •Оксидоредуктазы
- •Систематическое название образуется:
- •Трансферазы
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Свойства витаминов
- •Гиповитаминозы
- •Витамин а (ретинол, антиксерофтальмический)
- •Участие ретиноевой кислоты в дифференцировке, делении и росте клеток
- •Гипервитаминоз
- •Гиповитаминоз Приобретенный гиповитаминоз Причина
- •Клиническая картина
- •Наследственный гиповитаминоз
- •Гипервитаминоз
- •Гиповитаминоз
- •Гиповитаминоз
- •Антивитамины в1
- •Гиповитаминоз
- •Гиповитаминоз
- •Гиповитаминоз
- •Гиповитаминоз Причина
- •Клиническая картина
- •Лекарственные формы
- •Клиническая картина
- •Витамин н (биотин, антисеборейный)
- •Реакция карбоксилирования пропионил-sКоА с участием биотина
- •Гиповитаминоз Причина
- •Клиническая картина
- •Лекарственные формы
- •Азотистые основания имеют циклическое строение
- •Реакции синтеза амф и гмф
- •Лекарственная регуляция
- •Пурины распадаются с образованием мочевой кислоты
- •Реакции катаболизма пуринов
- •Реакции катаболизма пуриновых нуклеотидов Пуриновые основания должны использоваться повторно Реутилизация пуриновых оснований
- •Реакции реутилизации гуанина и гипоксантина
- •Накопление мочевой кислоты бьет по суставам и почкам
- •Нарушения обмена пуринов Подагра
- •Основы лечения
- •Мочекаменная болезнь
- •Основы лечения
- •Синдром Леша-Нихана
- •Синтез пиримидиновых нуклеотидов линейный
- •1. Образование карбамоилфосфата
- •2. Образование пиримидинового кольца
- •Синтез уридинмонофосфата
- •Регуляция синтеза пиримидинов Лекарственная регуляция
- •Распад пиримидинов идет до аммиака, углекислого газа и воды
- •Реакции катаболизма пиримидиновых нуклеотидов
- •Приобретенная форма
- •Существуют три процесса молекулярной биологии
- •Основной постулат молекулярной биологии
- •Центральная догма молекулярной биологии
- •Репликация происходит перед делением клетки
- •Фазы клеточного цикла
- •Синтез днк не настолько сложен как кажется Репликация днк
- •Повреждения и репарация днк
- •Рнк получает наследственную информацию Транскрипция (синтез рнк)
- •Стадии транскрипции
- •Инициация
- •Сзема процесса транскрипции
- •Процессинг предшественника рибосомальной рнк
- •Процессинг предшественника транспортной рнк
- •Лактозный оперон
- •Триптофановый оперон
- •Регуляция у эукариот Существенное усложнение эукариотических организмов повлекло за собой появление новых способов регуляции активности транскрипции:
- •Лекарственная регуляция транскрипции Ингибирование
- •Активация
- •Проблема перекодировки решена очень изящно
- •Генетический код
- •Адапторная роль транспортных рнк
- •Реакция синтеза аминоацил-тРнк
- •Синтез белков обеспечивают рибосомы Трансляция (синтез белка)
- •Инициация
- •События стадии инициации
- •Элонгация
- •Последовательность событий стадии элонгации
- •Образование пептидной связи при встраивании четвертой аминокислоты в пептид. Субъединицы рибосомы, большая часть транспортных рнк и матричная рнк не показаны.
- •Терминация
- •Реакции стадии терминации Полирибосомы
- •Новосинтезированным белкам надо "созреть"
- •Посттрансляционная модификация белков
- •Фолдинг белков
- •Трансляция является хорошей мишенью для лекарств
- •1. Инактивация факторов инициации
- •2. Нарушение кодон-антикодонового взаимодействия
- •3. Блокада стадии элонгации
- •Строение и обмен углеводов Углеводы дают энергию и строят органы
- •Функции
- •Углеводы - это производные спиртов
- •Классификация углеводов
- •Моносахариды - это структурная единица любых углеводов
- •Дисахариды часто присутствуют в пище
- •Строение крахмала и гликогена
- •Строение целлюлозы Гетерополисахариды
- •Строение гиалуроновой и хондроитинсерной кислот
- •Углеводы легко усваиваются
- •Роль целлюлозы в пищеварении
- •У детей свои причуды Особенности переваривания углеводов у детей
- •С усвоением лактозы и сахарозы бывают проблемы
- •Транспорт моносахаридов через мембраны энтероцитов Транспорт из крови через мембраны клеток
- •Пищевые моносахариды должны превратиться в глюкозу
- •Взаимопревращение сахаров
- •Превращение галактозы
- •Превращение галактозы в глюкозу Нарушения превращения галактозы
- •Превращение фруктозы
- •Пути метаболизма фруктозы и ее превращение в глюкозу
- •Наследственная фруктозурия
- •Глюкоза имеет широкие возможности
- •Активация глюкозы
- •Реакции фосфорилирования и дефосфорилирования глюкозы
- •Судьба глюкозы
- •Реакции превращения глюкозы в клетке
- •Гликоген - это легкоиспользуемый резерв энергии
- •Метаболизм гликогена
- •Мобилизация гликогена (гликогенолиз)
- •Роль ферментов в расщеплении гликогена Синтез гликогена
- •Реакции синтеза удф-глюкозы
- •Химизм реакции гликогенсинтазы
- •Роль гликогенсинтазы и гликозилтрансферазы в синтезе гликогена Синтез и распад гликогена реципрокны
- •Изменение активности ферментов обмена гликогена в зависимости от условий Способы активации синтазы гликогена
- •Способы активации фосфорилазы гликогена
- •Ковалентная модификация фосфорилазы
- •Аденилатциклазный способ активации фосфорилазы гликогена
- •Мышечные гликогенозы
- •Глюкоза – это источник оксалоацетата
- •Бескислородное окисление глюкозы включает два этапа
- •Гликолиз
- •Первый этап гликолиза
- •Второй этап гликолиза
- •Анаэробный гликолиз - самодостаточный процесс
- •Переключение между аэробным и анаэробным окислением происходит автоматически
- •Эффект Пастера
- •Роль лактатдегидрогеназы в клетке
- •Надн гликолиза могут доставляться в митохондрии
- •Челночные системы
- •Глицеролфосфатный челночный механизм
- •Малат-аспартатный челночный механизм
- •Насколько выгодно окисление глюкозы?
- •Расчет атф при анаэробном окислении
- •Аэробное окисление
- •Организм должен уметь синтезировать глюкозу
- •Глюкозо-лактатный (выделен желтым) и глюкозо-аланиновый циклы
- •Синтез глюкозы энергетически дорог
- •Обход десятой реакции гликолиза
- •Упрощенный вариант обхода десятой реакции гликолиза
- •Обход десятой реакции гликолиза
- •Регуляция глюконеогенеза
- •Гормональные и метаболические факторы, регулирующие гликолиз и глюконеогенез Регуляция гликолиза
- •Глюкоза в крови строго контролируется
- •Физиологические
- •Обезвреживание этанола
- •Реакции окисления этанола и ацетальдегида
- •Побочные эффекты обезвреживания этанола
- •Спиртовое брожение
- •Специфические реакции спиртового брожения Для синтеза рибозы и надфн существует специальный путь
- •Пентозофосфатный путь
- •Первый этап
- •Особенность пентозного шунта при активном синтезе днк Нарушения пентозофосфатного пути есть у многих людей
- •Роль надфн в антиоксидантной системе клетки
- •Функции липидов жестко связаны с их строением
- •Резервно-энергетическая функция
- •Свойства и функции липидов зависят от жирных кислот
- •Строение жирных кислот
- •Пищевые источники
- •Роль жирных кислот
- •У эйкозаноидов широкие возможности
- •Синтез эйкозаноидов
- •Строение триацилглицеролов
- •Пищевые источники
- •О гликолипидах известно немного
- •Строение гликолипидов
- •Строение церамида
- •Общее строение гликолипидов у фосфолипидов преобладает структурная функция
- •Пищевые источники фосфолипидов
- •Глицерофосфолипиды
- •Строение преобладающих в организме фосфолипидов
- •Строение менее распространенных фосфолипидов Сфингофосфолипиды
- •Холестерол жизненно необходим клеткам
- •Источники
- •Выведение из организма
- •Функции холестерола
- •Болезни накопления липидов называются липидозы
- •Липидозы
- •Дефектный фермент при болезни Гоше
- •Дефектный фермент при болезни Нимана-Пика
- •Дефектный фермент при болезни Тея-Сакса
- •Переваривание жиров идет в кишечнике Эмульгирование и гидролиз липидов
- •Переваривание в ротовой полости
- •Переваривание в желудке
- •Переваривание в кишечнике
- •Полный ферментативный гидролиз триацилглицерола
- •Действие фосфолипазы а2 и лизофосфолипазы на примере фосфатидилхолина
- •Образование мицелл
- •Без желчи липиды не переварятся
- •Роль желчи
- •Образование желчных кислот
- •Реакция активации жирной кислоты
- •Глицеролфосфатный путь образования таг
- •Нарушение желчевыделения
- •Причины нарушения формирования желчи и возникновения холелитиаза
- •У детей свои причуды Особенности переваривания жира у детей
- •Транспорт липидов - отдельная задача
- •Строение липопротеина
- •Хиломикроны и лпонп переносят триацилглицеролы
- •Характеристика хиломикронов Общая характеристика
- •Функция
- •Метаболизм
- •Характеристика липопротеинов очень низкой плотности Общая характеристика
- •Функция
- •Метаболизм
- •Обмен таг и фл - это обмен жирных кислот
- •Состояние покоя и отдыха в абсорбтивный период
- •Возможные источники и пути использования жирной кислоты в клетке Голодание, мышечная работа, покой в постабсорбтивный период
- •Триацилглицеролы нужны при нагрузке
- •Общая схема мобилизации таг и использования жирных кислот Активность таг-липазы зависит от гормонов
- •Гидролиз триацилглицеролов липазами жировой клетки
- •Активация триацилглицерол-липазы
- •Каскадный механизм активации таг-липазы
- •Последовательность реакций β-окисления жирных кислот Расчет энергетического баланса β-окисления
- •Пример. Окисление пальмитиновой кислоты
- •Окисление нечетных и ненасыщенных жирных кислот
- •Пример. Окисление линолевой кислоты
- •Кетоновые тела - это способ транспорта ацетильной группы
- •Строение кетоновых тел
- •Синтез кетоновых тел (кетогенез)
- •Реакции синтеза и утилизации кетоновых тел
- •Жиры синтезируются только при наличии энергии
- •Общая схема биосинтеза триацилглицеролов и холестерола из глюкозы
- •Синтез жирных кислот не похож на путь их окисления
- •Поступающий из митохондрий цитрат в цитозоле расщепляется атф-цитрат-лиазой до оксалоацетата и ацетил-sКоА.
- •Образование ацетил-sКоА из лимонной кислоты
- •Активные группы синтазы жирных кислот
- •Реакции синтеза жирных кислот Удлинение цепи жирных кислот
- •Синтез фл и таг тесно связаны
- •Общая схема реакций синтеза триацилглицеролов и фосфолипидов
- •Синтез таг - это запасание энергии Синтез триацилглицеролов
- •Реакции синтеза таг из фосфатидной кислоты
- •Синтез таг - это запасание энергии Синтез триацилглицеролов
- •Реакции синтеза таг из фосфатидной кислоты
- •Обмен жирных кислот и таг регулируется
- •1. Изменение количества ферментов
- •2. Ковалентная модификация
- •Регуляция активности ацетил-sКоА-карбоксилазы
- •Способы регуляции реакций обмена триацилглицеролов Метаболическая регуляция
- •Нарушения обмена таг связаны с образом жизни Жировая инфильтрация (дистрофия, перерождение) печени
- •Принцип лечения
- •Первичное ожирение
- •Вторичное ожирение
- •Принцип лечения
- •Инсулиннезависимый сахарный диабет
- •Принцип лечения
- •Синтез холестерола должен быть согласован с его выведением
- •Биосинтез холестерола
- •Регуляция синтеза
- •Регуляция активности гидроксиметилглутарил-s-КоА-редуктазы
- •Транспорт холестерола и его эфиров в организме Липопротеины низкой плотности Общая характеристика
- •Функция
- •Нарушения транспорта липидов - дислипопротеинемии
- •Виды дислипопротеинемий
- •Тип I. Гиперхиломикронемия
- •Тип II. Гипер-β-липопротеинемия
- •2 Стадия – стадия начальных изменений
- •Процесс развития атеросклероза (в динамике слева-направо)
- •Медикаменты
- •В чем заключается метаболизм?
- •Анаболизм
- •Катаболизм
- •II этап
- •III этап
- •Роль атф
- •Кругооборот атф в жизни клетки Откуда в клетке атф? Способы получения энергии в клетке
- •Два способа синтеза атф
- •Пируват окисляется до уксусной кислоты
- •Пируватдегидрогеназный мульферментный комплекс
- •Суммарное уравнение окисления пировиноградной кислоты
- •Реакции синтеза ацетил-sКоА
- •Реакции образования надн Регуляция пируватдегидрогеназного комплекса
- •Регуляция активности пируватдегидрогеназы
- •Изменение скорости реакций цтк и причины накопления кетоновых тел при некоторых состояниях
- •Для чего образуются восстановленные над и фад?
- •Окислительное фосфорилирование
- •Принцип работы дыхательной цепи
- •Общие принцип окислительного фосфорилирования
- •Каким образом энергия водорода преобразуется в энергию атф? Механизм окислительного фосфорилирования
- •Строение дыхательной цепи и механизм окислительного фосфорилирования
- •Синтез атф регулируется
- •Дыхательный контроль
- •Зависимость электрохимического градиента от скорости движения электронов
- •На клеточное дыхание можно влиять
- •Гипоэнергетические состояния
- •Разобщители окисления и фосфорилирования
- •Роль термогенина в снижении протонного градиента
- •Ингибиторы ферментов дыхательной цепи
- •Ингибиторы ферментов дыхательной цепи Как подсчитать эффективность окисления? Коэффициент p/o
- •Расчет энергетической ценности и коэффициента р/о
- •Соотношение количества атф, неорганического фосфата и кислорода при окислении аспартата Окисление аланина
- •Соотношение количества атф, неорганического фосфата и кислорода при окислении аланина Классифицируют гормоны по-разному
- •Классификация по строению
- •Виды мембраносвязанных рецепторов
- •Три механизма передачи сигнала в зависимости от вида мембранных рецепторов
- •ЦиклоАмф является наиболее популярным мессенджером
- •Этапы передачи сигнала
- •Инозитолтрифосфат и даг тоже являются вторичными мессенджерами
- •Этапы передачи сигнала
- •Гидрофобные гормоны проникают внутрь клетки
- •Цитозольный механизм действия гормонов у гормонов существует четкая иерархия
- •Регуляция некоторых гормональных систем Гипоталамус - генералитет эндокринной системы
- •Соматотропный гормон
- •Патология Гипофункция
- •Гиперфункция
- •Пептиды проопиомеланокортина
- •Липотропный гормон
- •Регуляция секреции и эффекты антидиуретического гормона
- •Гиперфункция
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология Гипофункция
- •Гиперфункция
- •Гормоны поджелудочной железы
- •Механизм действия
- •Патология
- •Минералокортикоиды
- •Активация ренин-ангиотензин-альдостероновой системы
- •У женщин
- •Гормональные изменения во время менструального цикла Мишени и эффекты Эстрогены
- •Прогестерон
- •Патология
- •Патология Гипофункция
- •Гиперфункция
- •В крови пять фракций белков
- •Электрофорез белков
- •Общий вид электрофореза
- •Электрофореграмма (вверху) и графический результат ее обработки (внизу)
- •Нормальные величины белковых фракций плазмы крови
- •Типы протеинограмм
- •Белки крови выполняют серьезные задачи Функции белков плазмы крови
- •Альбумин - основной белок крови
- •Гиперальбуминемия
- •Гипоальбуминемия
- •Альфа1-глобулины включают большинство белков острой фазы
- •Альфа2-глобулины содержат протеазы и транспортные белки
- •Бета-глобулины - это чаще транспортные белки
- •Многие белки крови являются ферментами
- •Причины изменения активности ферментов в крови
- •Ферменты сыворотки крови
- •Единицы измерения активности ферментов
- •Не весь азот крови находится в белках
- •Происхождение и типы азотемий Фракции остаточного азота
- •Дефицит железа есть у трети населения
- •Железосодержащие белки
- •Пищевые источники
- •Всасывание
- •Метаболизм железа
- •Дефицит
- •Причины дефицита железа
- •Симптомы
- •Дефицит железа есть у трети населения
- •Железосодержащие белки
- •Пищевые источники
- •Всасывание
- •Метаболизм железа
- •Дефицит
- •Причины дефицита железа
- •Симптомы
- •Гемоглобин - основной белок крови
- •Строение гемоглобина
- •Нормальные формы гемоглобина
- •Патологические формы гемоглобина
- •У гемоглобина есть молекулярные болезни Серповидно-клеточная анемия
- •Нарушение синтеза гемоглобина Порфирии
- •Талассемии
- •Эффективность транспорта кислорода регулируется Изменение рН среды
- •Механизм эффекта Бора Кооперативное взаимодействие
- •Изменение формы субъединиц гемоглобина при присоединении кислорода
- •Гем требуется для многих ферментов
- •Распад гема - многостадийный процесс
- •Превращение в кишечнике
- •Токсичность билирубина состоит в его липофильности
- •Причины основных нарушений обмена билирубина Гемолитическая желтуха
- •Механическая желтуха
- •Паренхиматозная желтуха
- •Желтухи часто встречаются у новорожденных
- •Лабораторная диагностика
- •Роль внутриклеточных ионов водорода
- •Роль внеклеточных ионов водорода
- •Показатели кислотно-основного состояния
- •Водородный показатель
- •Нормальные величины
- •Концентрация бикарбонат-ионов
- •Нормальные величины
- •Клинико-диагностическое значение
- •Концентрация буферных оснований
- •Нормальные величины
- •Клинико-диагностическое значение
- •Общее содержание кислорода
- •Фосфатная буферная система
- •Белковая буферная система
- •Изменение заряда буферных групп белка при различных рН Гемоглобиновая буферная система
- •Длительная стабилизация сдвигов рН Физиологическая компенсация нарушений кос Дыхательная система
- •Костная ткань
- •Реабсорбция бикарбонат-ионов
- •Процесс реабсорбции бикарбонат-ионов
- •Ацидогенез
- •Процесс ацидогенеза в почечных канальцах
- •Аммониегенез
- •Процесс аммониегенеза в дистальных канальцах
- •Изменение кос - частая ситуация
- •Причины нарушений кислотно-основного состояния
- •Метаболический ацидоз Причины
- •1. Повышение содержания кислот в крови
- •2. Потеря бикарбонатов
- •Компенсация
- •2. Лихорадочные состояния
- •Использование показателя рСо2 для диагностики нарушений кислотно-основного состояния
- •Вода - главное вещество организма Роль воды в организме
- •Источники воды в клетке
- •Выведение воды из организма
- •Регуляция водного баланса
- •Почки - это не только удаление шлаков
- •Экскреторная функция
- •Регулирующая функция
- •Метаболическая функция
- •Гломерулярный фильтр пропускает большую часть веществ
- •Строение почечного фильтра
- •Реабсорбция в канальцах почек - процесс многоликий
- •Процессы реабсорбции в канальцах почек
- •Петля Генле обеспечивает реабсорбцию воды и солей
- •Процессы, происходящие в восходящей части петли Генле
- •Реабсорбция кальция происходит в дистальном отделе
- •События, происходящие в дистальной части нефрона
- •Конечный отдел нефрона определяет объем мочи
- •События, происходящие конечных отделах дистальных канальцев и собирательных трубочках Как оценить работу почек? Лабораторная оценка фильтрации
- •Лабораторная оценка реабсорбции
- •Прозрачность
- •Нормальные величины
- •Физиологические изменения
- •Патологические изменения
- •У мочи есть и другие особенности Поверхностное натяжение
- •Кислотно-основная реакция
- •Нормальные величины
- •Плотность
- •Неорганические компоненты мочи
- •Нормальные величины
- •Клинико диагностическое значение
- •Хлориды
- •Нормальные величины
- •Клинико диагностическое значение
- •Органические компоненты мочи Мочевина
- •Нормальные величины
- •Мочевая кислота
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Гиппуровая кислота
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Органические кислоты
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Пигменты
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Патологические компоненты мочи
- •Глюкоза
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Кетоновые тела
- •Печень перекрещивает метаболизм углеводов, липидов и белков
- •Взаимосвязь обмена белков, жиров и углеводов
- •Липидный обмен
- •Белковый обмен
- •Тесное взаимодействие синтеза мочевины и цтк Пигментный обмен
- •Оценка метаболической функции
- •Большая часть токсинов обезвреживается в печени
- •Места биотрансформации, задержки и выведения ксенобиотиков
- •Две фазы биотрансформации ксенобиотиков
- •Превращение индола в 1 и 2 фазах биотрансформации
- •Микросомы повышают реакционную способность молекул
- •Реакции микросомального окисления
- •Оценка реакций 1-й фазы
- •Конъюгирование резко повышает водорастворимость
- •Строение основных кислот реакций конъюгации
- •Строение глутатиона Иногда от обезвреживания становится хуже
- •Органотоксичность
- •Нормальный метаболизм парацетамола и причины его токсичности Химический канцерогенез
Гем требуется для многих ферментов
Гем является небелковой частью многих гемопротеинов:
гемоглобин (до 85% общего количества гема организма), локализованный в эритроцитах и клетках костного мозга,
миоглобин скелетных мышц и миокарда (17%),
цитохромы дыхательной цепи и P450, цитохромоксидаза, гомогентизатоксидаза, пероксидаза,миелопероксидаза, каталаза, тиреопероксидаза и т.д. – менее 1%.
Строение и синтез гема
Синтез гема в основном идет в предшественниках эритроцитов, клетках печени, почек, слизистой кишечника, и в остальных тканях. Первая реакция синтеза с участием δ-аминолевулинат-синтазы (греч. δ - "дельта") происходит в митохондриях. Следующая реакция при участии аминолевулинатдегидратазы(порфобилиноген-синтазы) протекает в цитозоле.
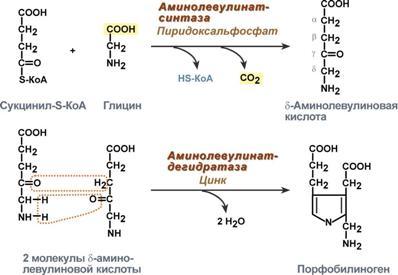
Синтез порфобилиногена
После синтеза порфобилиногена четыре его молекулы конденсируются в тетрапиррол. Различают два вида тетрапирролов - уропорфириноген типа I и уропорфириноген типа III. В синтезе обоих видов порфиринов принимает участие уропорфириноген I-синтаза, в образования уропорфириногена III дополнительно принимает участие фермент уропорфириноген III-косинтаза.
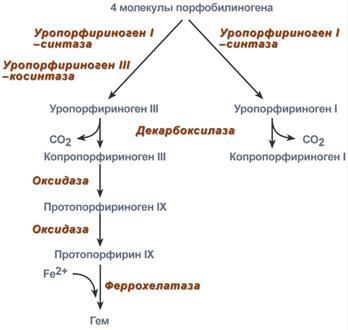
Синтез гема из порфобилиногена
Далее уропорфириногены превращаются в соответствующие копропорфириногены. Копропорфириноген III окисляется в протопорфириноген IX и далее в протопорфирин IX. Последний после связывания с железом образует гем, реакцию катализирует феррохелатаза (гемсинтаза).
Регуляция синтеза гема
1. Скорость синтеза глобиновых цепей зависит от наличия гема, он ускоряет биосинтез "своих" белков.
2. Основным регуляторным ферментом синтеза гема является аминолевулинатсинтаза.
гем после взаимодействия с молекулой белка-репрессора формирует активный репрессорный комплекс, связывается с ДНК и подавляет транскрипцию, мРНК для фермента не образуется и синтез фермента прекращается. Также имеется отрицательный аллостерический эффект гема на фермент.
|
Подавление гемом синтеза аминолевулинатсинтазы |
Стимуляция синтеза аминолевулинатсинтазы ионами железа |
с другой стороны, достаточное количество ионов железа оказывает положительный эффект при синтезе молекулы аминолевулинатсинтазы. В клетке имеется особый железосвязывающий белок, который в отсутствии ионов железа обладает сродством к мРНК фермента и блокирует ее трансляцию в рибосоме, т.е. синтез белковой цепи. Ионы железа связываются с этим железосвязывающим белком, образуя с ним неактивный комплекс, что инициирует синтез фермента.
3. Положительным модулятором аминолевулинатсинтазы служит гипоксия тканей, которая в эритропоэтических тканях индуцирует синтез фермента.
4. В печени повышение активности аминолевулинатсинтазы вызывают соединения, усиливающие работу микросомальной системы окисления (жирорастворимые токсины, стероиды) – при этом возрастает потребление гема для образования цитохрома Р450, что снижает внутриклеточную концентрацию свободного гема. В результате происходит дерепрессия синтеза фермента.
Распад гема - многостадийный процесс
За сутки у человека распадается около 9 г гемопротеинов, в основном это гемоглобин эритроцитов. Эритроциты живут 90-120 дней, после чего лизируются в кровеносном русле или в селезенке.
При разрушении эритроцитов в кровяном русле высвобождаемый гемоглобин образует комплекс с белком-переносчиком гаптоглобином (фракция α2-глобулинов крови) и переносится в клетки ретикуло-эндотелиальной системы (РЭС) селезенки (главным образом), печени и костного мозга.
Синтез билирубина
В клетках РЭС гем в составе гемоглобина окисляется молекулярным кислородом. В реакциях последовательно происходит разрыв метинового мостика между 1-м и 2-м пиррольными кольцами гема с их восстановлением, отщеплением железа и белковой части и образованием оранжевого пигмента билирубина.
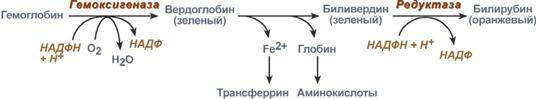
Реакции синтеза билирубина
Билирубин – токсичное, жирорастворимое вещество, способное нарушать окислительное фосфорилирование в клетках. Особенно чувствительны к нему клетки нервной ткани.

Строение билирубина
Выведение билирубина
Из клеток ретикуло-эндотелиальной системы билирубин попадает в кровь. Здесь он находится в комплексе сальбумином плазмы, в гораздо меньшем количестве – в комплексах с металлами, аминокислотами, пептидами и другими малыми молекулами. Образование таких комплексов не позволяет выделяться билирубину с мочой. Билирубин в комплексе с альбумином называется свободный (неконъюгированный) или непрямой билирубин.

Этапы метаболизма билирубина в организме
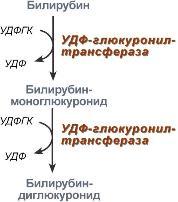
Из сосудистого русла в гепатоциты билирубин попадает с помощью белка-переносчика (лигандина). В клетке протекает реакция связывания билирубина с УДФ-глюкуроновой кислотой, при этом образуются моно- идиглюкурониды. Кроме глюкуроновой кислоты, в реакцию могут вступать сульфаты, фосфаты, глюкозиды. Билирубин-глюкуронид получил название связанный (конъюгированный) или прямой билирубин.
|
Реакции синтеза билирубин-диглюкуронида |
Строение билирубин-диглюкуронида |
После образования билирубин-глюкурониды АТФ-зависимым переносчиком секретируются в желчные протоки и далее в кишечник, где при участии бактериальной β-глюкуронидазы превращаются в свободныйбилирубин.
Одновременно некоторое количество билирубин-глюкуронидов может попадать (особенно у взрослых) из желчи в кровь по межклеточным щелям.
Таким образом, в крови в норме одновременно существуют две формы билирубина: свободный, попадающий сюда из клеток РЭС (около 80% всего количества), и связанный, попадающий из желчных протоков (до 20%).