- •Зачем врачу нужна биологическая химия?
- •Аминокислоты используются в качестве лекарств
- •Классификация аминокислот
- •Двадцать аминокислот необходимы для синтеза белка
- •Аминокислоты обладают изомерией
- •Право- и левовращающие формы аланина
- •Для аминокислот характерна амфотерность
- •Изменение заряда аминокислот при смещении рН раствора в кислую или щелочную сторону.
- •Вторичный активный транспорт аминокислот через мембраны
- •Глутатионовая система транспорта
- •Транспорт аминокислот при участии глутатиона
- •Аминокислоты могут давать энергию
- •Пути превращений аминокислот по боковой цепи
- •Нейромедиаторы образуются из аминокислот
- •Гистамин
- •Реакция синтеза гистамина
- •Физиологические эффекты
- •Серотонин
- •Реакции синтеза серотонина
- •Гамма-аминомасляная кислота
- •Катаболизм аминокислот начинается с удаления аминогруппы
- •Трансаминирование нуждается в витамине в6
- •Механизм реакции трансаминирования
- •Реакции полного цикла трансаминирования
- •Аминотрансферазы имеют клиническое значение
- •Реакции, катализируемые аланинаминотрансферазой и аспартатаминотрансферазой
- •Креатинфосфат - срочный резерв энергии
- •Использование креатинфосфата для ресинтеза атф
- •Образование креатинина из креатинфосфата
- •Реакции синтеза креатина в почках и печени
- •Синтез креатинфосфата
- •В мышце дезаминирование аминокислот идет особым образом
- •Реакции непрямого дезаминирования аминокислот в мышечной ткани
- •В клетках постоянно образуется аммиак
- •Основные источники аммиака
- •Связывание аммиака
- •Реакция синтеза глутаминовой кислоты
- •Реакция синтеза глутамина
- •Реакция синтеза аспарагина
- •Транспорт аммиака
- •Глюкозо-аланиновый цикл
- •Реакции глюкозо-аланинового цикла (выделен рамкой).
- •Накопление аммиака представляет проблему
- •Гипотезы токсичности аммиака
- •Наследственные и приобретенные формы гипераммониемий Приобретенные формы
- •Наследственные формы
- •Для удаления аммиака есть два способа
- •Реакция дезаминирования глутамина
- •Синтез мочевины
- •Реакция синтеза карбамоилфосфата и орнитиновый цикл Синтез аммонийных солей
- •Реакции синтеза аммонийных солей Пути использования аспартата и глутамата
- •Серин и глицин превращаются друг в друга
- •Реакция взаимопревращения глицина и серина
- •Пути использования серина и глицина Обмен некоторых аминокислот тесно связан
- •Взаимосвязь обмена серина, глицина, метионина и цистеина
- •Клиническая картина
- •Основы лечения
- •Фенилкетонурия 2 типа
- •Основы лечения
- •Основы лечения
- •Альбинизм Этиология
- •Клиническая картина
- •Основы лечения
- •Нарушение обмена метионина и цистеина
- •Цистиноз нефропатический поздний
- •Цистиноз доброкачественный взрослых
- •Основы лечения
- •Нарушение распада лейцина, валина, изолейцина
- •Основы лечения
- •Изовалератацидемия
- •Нарушение обмена триптофана
- •Реакции катаболизма триптофана
- •Главное в белке - последовательность аминокислот
- •Участок белковой цепи длиной в 6 аминокислот (Сер-Цис-Тир-Лей-Глу-Ала) (пептидные связи выделены желтым цветом, аминокислоты - красной рамкой)
- •Укладка белка в виде каната и гармошкой
- •Участие водородных связей в формировании вторичной структуры
- •Укладка белка в виде β-складчатого слоя
- •Свертывание белка в глобулу
- •Часть белков является олигомерами
- •Свойства белков следуют из их строения
- •Амфотерность
- •Влияние рН на заряд белка
- •Растворимость
- •Растворы белков - коллоидные растворы
- •Белки можно удалить из раствора
- •Денатурация
- •1. Физическая денатурация
- •2. Химическая денатурация
- •Высаливание
- •Осаждение водоотнимающими средствами
- •Простых белков немного
- •Альбумины
- •Глобулины
- •Картина электрофореза белков сыворотки крови
- •Гистоны
- •Протамины
- •Коллаген
- •Эластин
- •Роль десмозина в соединении белков
- •Нуклеопротеины отвечают за продолжение жизни клетки
- •Сравнение строения азотистого основания, нуклеозида и нуклеотида
- •Строение и функции рнк и днк
- •Фосфопротеины - это, как правило, ферменты
- •Способ присоединения фосфата к белку на примере серина и тирозина Фосфорная кислота может выполнять:
- •Изменение конформации белка в фосфорилированном и дефосфорилированном состоянии
- •Липопротеины имеют огромное клиническое значение
- •Выделяют четыре основных класса липопротеинов:
- •Для гликопротеинов характерна структурная роль
- •Гликопротеины
- •Способ присоединения углевода к белку Функцией гликопротеинов являются:
- •Протеогликаны
- •Строение гиалуроновой кислоты и хондроитинсульфата
- •Хромопротеины придают тканям цвет
- •Переваривание белков начинается в желудке
- •Соляная кислота
- •Синтез соляной кислоты Функции соляной кислоты
- •Гастриксин
- •В тонком кишечнике белки должны полностью расщепляться
- •Трипсин
- •Химотрипсин
- •У детей свои причуды Особенности переваривания белков у детей Желудок
- •Кишечник
- •Проблемы жкт влияют на весь организм
- •Пищевые аллергии
- •Превращение аминокислот в толстом кишечнике
- •Реакции превращения тирозина и триптофана
- •Реакции првращения лизина и аргинина Целиакия
- •На чем основан ферментативный катализ?
- •Сходство и отличия ферментов и неорганических катализаторов
- •Этапы катализа
- •Механизмы катализа
- •Типы ферментативных реакций
- •Структурно-функциональная организация ферментов
- •Изоферменты
- •Мультиферментные комплексы
- •Строение мульферментного комплекса
- •Что означает выражение "активность фермента"?
- •Основы количественного определения активности ферментов
- •От чего зависит активность ферментов? Свойства ферментов
- •1. Зависимость скорости реакции от температуры
- •2. Зависимость скорости реакции от рН
- •Механизмы специфичности
- •Активность ферментов в клетке непостоянна
- •Регуляция активности ферментов
- •2. Компартментализация
- •3. Изменение количества фермента
- •4. Ограниченный (частичный) протеолиз проферментов
- •5. Аллостерическая регуляция
- •Общий принцип аллостерической регуляции
- •Регуляция фосфофруктокиназы конечным продуктом
- •6. Белок-белковое взаимодействие
- •Принципиальная схема активации аденилатциклазы
- •Ингибирование ферментов
- •Необратимое ингибирование
- •Механизм необратимого ингибирования ацетилхолинэстеразы
- •Механизм необратимого ингибирования циклооксигеназы Обратимое ингибирование
- •Конкурентное ингибирование
- •Конкурентное ингибирование сукцинатдегидрогеназы
- •Сходство строения сульфаниламидов и парааминобензойной кислоты, компонента витамина в9 Неконкурентное ингибирование
- •Ферменты востребованы в медицине
- •Энзимодиагностика
- •Энзимотерапия
- •Использование ферментов в медицинских технологиях
- •Использование ингибиторов ферментов
- •Оксидоредуктазы
- •Систематическое название образуется:
- •Трансферазы
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Свойства витаминов
- •Гиповитаминозы
- •Витамин а (ретинол, антиксерофтальмический)
- •Участие ретиноевой кислоты в дифференцировке, делении и росте клеток
- •Гипервитаминоз
- •Гиповитаминоз Приобретенный гиповитаминоз Причина
- •Клиническая картина
- •Наследственный гиповитаминоз
- •Гипервитаминоз
- •Гиповитаминоз
- •Гиповитаминоз
- •Антивитамины в1
- •Гиповитаминоз
- •Гиповитаминоз
- •Гиповитаминоз
- •Гиповитаминоз Причина
- •Клиническая картина
- •Лекарственные формы
- •Клиническая картина
- •Витамин н (биотин, антисеборейный)
- •Реакция карбоксилирования пропионил-sКоА с участием биотина
- •Гиповитаминоз Причина
- •Клиническая картина
- •Лекарственные формы
- •Азотистые основания имеют циклическое строение
- •Реакции синтеза амф и гмф
- •Лекарственная регуляция
- •Пурины распадаются с образованием мочевой кислоты
- •Реакции катаболизма пуринов
- •Реакции катаболизма пуриновых нуклеотидов Пуриновые основания должны использоваться повторно Реутилизация пуриновых оснований
- •Реакции реутилизации гуанина и гипоксантина
- •Накопление мочевой кислоты бьет по суставам и почкам
- •Нарушения обмена пуринов Подагра
- •Основы лечения
- •Мочекаменная болезнь
- •Основы лечения
- •Синдром Леша-Нихана
- •Синтез пиримидиновых нуклеотидов линейный
- •1. Образование карбамоилфосфата
- •2. Образование пиримидинового кольца
- •Синтез уридинмонофосфата
- •Регуляция синтеза пиримидинов Лекарственная регуляция
- •Распад пиримидинов идет до аммиака, углекислого газа и воды
- •Реакции катаболизма пиримидиновых нуклеотидов
- •Приобретенная форма
- •Существуют три процесса молекулярной биологии
- •Основной постулат молекулярной биологии
- •Центральная догма молекулярной биологии
- •Репликация происходит перед делением клетки
- •Фазы клеточного цикла
- •Синтез днк не настолько сложен как кажется Репликация днк
- •Повреждения и репарация днк
- •Рнк получает наследственную информацию Транскрипция (синтез рнк)
- •Стадии транскрипции
- •Инициация
- •Сзема процесса транскрипции
- •Процессинг предшественника рибосомальной рнк
- •Процессинг предшественника транспортной рнк
- •Лактозный оперон
- •Триптофановый оперон
- •Регуляция у эукариот Существенное усложнение эукариотических организмов повлекло за собой появление новых способов регуляции активности транскрипции:
- •Лекарственная регуляция транскрипции Ингибирование
- •Активация
- •Проблема перекодировки решена очень изящно
- •Генетический код
- •Адапторная роль транспортных рнк
- •Реакция синтеза аминоацил-тРнк
- •Синтез белков обеспечивают рибосомы Трансляция (синтез белка)
- •Инициация
- •События стадии инициации
- •Элонгация
- •Последовательность событий стадии элонгации
- •Образование пептидной связи при встраивании четвертой аминокислоты в пептид. Субъединицы рибосомы, большая часть транспортных рнк и матричная рнк не показаны.
- •Терминация
- •Реакции стадии терминации Полирибосомы
- •Новосинтезированным белкам надо "созреть"
- •Посттрансляционная модификация белков
- •Фолдинг белков
- •Трансляция является хорошей мишенью для лекарств
- •1. Инактивация факторов инициации
- •2. Нарушение кодон-антикодонового взаимодействия
- •3. Блокада стадии элонгации
- •Строение и обмен углеводов Углеводы дают энергию и строят органы
- •Функции
- •Углеводы - это производные спиртов
- •Классификация углеводов
- •Моносахариды - это структурная единица любых углеводов
- •Дисахариды часто присутствуют в пище
- •Строение крахмала и гликогена
- •Строение целлюлозы Гетерополисахариды
- •Строение гиалуроновой и хондроитинсерной кислот
- •Углеводы легко усваиваются
- •Роль целлюлозы в пищеварении
- •У детей свои причуды Особенности переваривания углеводов у детей
- •С усвоением лактозы и сахарозы бывают проблемы
- •Транспорт моносахаридов через мембраны энтероцитов Транспорт из крови через мембраны клеток
- •Пищевые моносахариды должны превратиться в глюкозу
- •Взаимопревращение сахаров
- •Превращение галактозы
- •Превращение галактозы в глюкозу Нарушения превращения галактозы
- •Превращение фруктозы
- •Пути метаболизма фруктозы и ее превращение в глюкозу
- •Наследственная фруктозурия
- •Глюкоза имеет широкие возможности
- •Активация глюкозы
- •Реакции фосфорилирования и дефосфорилирования глюкозы
- •Судьба глюкозы
- •Реакции превращения глюкозы в клетке
- •Гликоген - это легкоиспользуемый резерв энергии
- •Метаболизм гликогена
- •Мобилизация гликогена (гликогенолиз)
- •Роль ферментов в расщеплении гликогена Синтез гликогена
- •Реакции синтеза удф-глюкозы
- •Химизм реакции гликогенсинтазы
- •Роль гликогенсинтазы и гликозилтрансферазы в синтезе гликогена Синтез и распад гликогена реципрокны
- •Изменение активности ферментов обмена гликогена в зависимости от условий Способы активации синтазы гликогена
- •Способы активации фосфорилазы гликогена
- •Ковалентная модификация фосфорилазы
- •Аденилатциклазный способ активации фосфорилазы гликогена
- •Мышечные гликогенозы
- •Глюкоза – это источник оксалоацетата
- •Бескислородное окисление глюкозы включает два этапа
- •Гликолиз
- •Первый этап гликолиза
- •Второй этап гликолиза
- •Анаэробный гликолиз - самодостаточный процесс
- •Переключение между аэробным и анаэробным окислением происходит автоматически
- •Эффект Пастера
- •Роль лактатдегидрогеназы в клетке
- •Надн гликолиза могут доставляться в митохондрии
- •Челночные системы
- •Глицеролфосфатный челночный механизм
- •Малат-аспартатный челночный механизм
- •Насколько выгодно окисление глюкозы?
- •Расчет атф при анаэробном окислении
- •Аэробное окисление
- •Организм должен уметь синтезировать глюкозу
- •Глюкозо-лактатный (выделен желтым) и глюкозо-аланиновый циклы
- •Синтез глюкозы энергетически дорог
- •Обход десятой реакции гликолиза
- •Упрощенный вариант обхода десятой реакции гликолиза
- •Обход десятой реакции гликолиза
- •Регуляция глюконеогенеза
- •Гормональные и метаболические факторы, регулирующие гликолиз и глюконеогенез Регуляция гликолиза
- •Глюкоза в крови строго контролируется
- •Физиологические
- •Обезвреживание этанола
- •Реакции окисления этанола и ацетальдегида
- •Побочные эффекты обезвреживания этанола
- •Спиртовое брожение
- •Специфические реакции спиртового брожения Для синтеза рибозы и надфн существует специальный путь
- •Пентозофосфатный путь
- •Первый этап
- •Особенность пентозного шунта при активном синтезе днк Нарушения пентозофосфатного пути есть у многих людей
- •Роль надфн в антиоксидантной системе клетки
- •Функции липидов жестко связаны с их строением
- •Резервно-энергетическая функция
- •Свойства и функции липидов зависят от жирных кислот
- •Строение жирных кислот
- •Пищевые источники
- •Роль жирных кислот
- •У эйкозаноидов широкие возможности
- •Синтез эйкозаноидов
- •Строение триацилглицеролов
- •Пищевые источники
- •О гликолипидах известно немного
- •Строение гликолипидов
- •Строение церамида
- •Общее строение гликолипидов у фосфолипидов преобладает структурная функция
- •Пищевые источники фосфолипидов
- •Глицерофосфолипиды
- •Строение преобладающих в организме фосфолипидов
- •Строение менее распространенных фосфолипидов Сфингофосфолипиды
- •Холестерол жизненно необходим клеткам
- •Источники
- •Выведение из организма
- •Функции холестерола
- •Болезни накопления липидов называются липидозы
- •Липидозы
- •Дефектный фермент при болезни Гоше
- •Дефектный фермент при болезни Нимана-Пика
- •Дефектный фермент при болезни Тея-Сакса
- •Переваривание жиров идет в кишечнике Эмульгирование и гидролиз липидов
- •Переваривание в ротовой полости
- •Переваривание в желудке
- •Переваривание в кишечнике
- •Полный ферментативный гидролиз триацилглицерола
- •Действие фосфолипазы а2 и лизофосфолипазы на примере фосфатидилхолина
- •Образование мицелл
- •Без желчи липиды не переварятся
- •Роль желчи
- •Образование желчных кислот
- •Реакция активации жирной кислоты
- •Глицеролфосфатный путь образования таг
- •Нарушение желчевыделения
- •Причины нарушения формирования желчи и возникновения холелитиаза
- •У детей свои причуды Особенности переваривания жира у детей
- •Транспорт липидов - отдельная задача
- •Строение липопротеина
- •Хиломикроны и лпонп переносят триацилглицеролы
- •Характеристика хиломикронов Общая характеристика
- •Функция
- •Метаболизм
- •Характеристика липопротеинов очень низкой плотности Общая характеристика
- •Функция
- •Метаболизм
- •Обмен таг и фл - это обмен жирных кислот
- •Состояние покоя и отдыха в абсорбтивный период
- •Возможные источники и пути использования жирной кислоты в клетке Голодание, мышечная работа, покой в постабсорбтивный период
- •Триацилглицеролы нужны при нагрузке
- •Общая схема мобилизации таг и использования жирных кислот Активность таг-липазы зависит от гормонов
- •Гидролиз триацилглицеролов липазами жировой клетки
- •Активация триацилглицерол-липазы
- •Каскадный механизм активации таг-липазы
- •Последовательность реакций β-окисления жирных кислот Расчет энергетического баланса β-окисления
- •Пример. Окисление пальмитиновой кислоты
- •Окисление нечетных и ненасыщенных жирных кислот
- •Пример. Окисление линолевой кислоты
- •Кетоновые тела - это способ транспорта ацетильной группы
- •Строение кетоновых тел
- •Синтез кетоновых тел (кетогенез)
- •Реакции синтеза и утилизации кетоновых тел
- •Жиры синтезируются только при наличии энергии
- •Общая схема биосинтеза триацилглицеролов и холестерола из глюкозы
- •Синтез жирных кислот не похож на путь их окисления
- •Поступающий из митохондрий цитрат в цитозоле расщепляется атф-цитрат-лиазой до оксалоацетата и ацетил-sКоА.
- •Образование ацетил-sКоА из лимонной кислоты
- •Активные группы синтазы жирных кислот
- •Реакции синтеза жирных кислот Удлинение цепи жирных кислот
- •Синтез фл и таг тесно связаны
- •Общая схема реакций синтеза триацилглицеролов и фосфолипидов
- •Синтез таг - это запасание энергии Синтез триацилглицеролов
- •Реакции синтеза таг из фосфатидной кислоты
- •Синтез таг - это запасание энергии Синтез триацилглицеролов
- •Реакции синтеза таг из фосфатидной кислоты
- •Обмен жирных кислот и таг регулируется
- •1. Изменение количества ферментов
- •2. Ковалентная модификация
- •Регуляция активности ацетил-sКоА-карбоксилазы
- •Способы регуляции реакций обмена триацилглицеролов Метаболическая регуляция
- •Нарушения обмена таг связаны с образом жизни Жировая инфильтрация (дистрофия, перерождение) печени
- •Принцип лечения
- •Первичное ожирение
- •Вторичное ожирение
- •Принцип лечения
- •Инсулиннезависимый сахарный диабет
- •Принцип лечения
- •Синтез холестерола должен быть согласован с его выведением
- •Биосинтез холестерола
- •Регуляция синтеза
- •Регуляция активности гидроксиметилглутарил-s-КоА-редуктазы
- •Транспорт холестерола и его эфиров в организме Липопротеины низкой плотности Общая характеристика
- •Функция
- •Нарушения транспорта липидов - дислипопротеинемии
- •Виды дислипопротеинемий
- •Тип I. Гиперхиломикронемия
- •Тип II. Гипер-β-липопротеинемия
- •2 Стадия – стадия начальных изменений
- •Процесс развития атеросклероза (в динамике слева-направо)
- •Медикаменты
- •В чем заключается метаболизм?
- •Анаболизм
- •Катаболизм
- •II этап
- •III этап
- •Роль атф
- •Кругооборот атф в жизни клетки Откуда в клетке атф? Способы получения энергии в клетке
- •Два способа синтеза атф
- •Пируват окисляется до уксусной кислоты
- •Пируватдегидрогеназный мульферментный комплекс
- •Суммарное уравнение окисления пировиноградной кислоты
- •Реакции синтеза ацетил-sКоА
- •Реакции образования надн Регуляция пируватдегидрогеназного комплекса
- •Регуляция активности пируватдегидрогеназы
- •Изменение скорости реакций цтк и причины накопления кетоновых тел при некоторых состояниях
- •Для чего образуются восстановленные над и фад?
- •Окислительное фосфорилирование
- •Принцип работы дыхательной цепи
- •Общие принцип окислительного фосфорилирования
- •Каким образом энергия водорода преобразуется в энергию атф? Механизм окислительного фосфорилирования
- •Строение дыхательной цепи и механизм окислительного фосфорилирования
- •Синтез атф регулируется
- •Дыхательный контроль
- •Зависимость электрохимического градиента от скорости движения электронов
- •На клеточное дыхание можно влиять
- •Гипоэнергетические состояния
- •Разобщители окисления и фосфорилирования
- •Роль термогенина в снижении протонного градиента
- •Ингибиторы ферментов дыхательной цепи
- •Ингибиторы ферментов дыхательной цепи Как подсчитать эффективность окисления? Коэффициент p/o
- •Расчет энергетической ценности и коэффициента р/о
- •Соотношение количества атф, неорганического фосфата и кислорода при окислении аспартата Окисление аланина
- •Соотношение количества атф, неорганического фосфата и кислорода при окислении аланина Классифицируют гормоны по-разному
- •Классификация по строению
- •Виды мембраносвязанных рецепторов
- •Три механизма передачи сигнала в зависимости от вида мембранных рецепторов
- •ЦиклоАмф является наиболее популярным мессенджером
- •Этапы передачи сигнала
- •Инозитолтрифосфат и даг тоже являются вторичными мессенджерами
- •Этапы передачи сигнала
- •Гидрофобные гормоны проникают внутрь клетки
- •Цитозольный механизм действия гормонов у гормонов существует четкая иерархия
- •Регуляция некоторых гормональных систем Гипоталамус - генералитет эндокринной системы
- •Соматотропный гормон
- •Патология Гипофункция
- •Гиперфункция
- •Пептиды проопиомеланокортина
- •Липотропный гормон
- •Регуляция секреции и эффекты антидиуретического гормона
- •Гиперфункция
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология Гипофункция
- •Гиперфункция
- •Гормоны поджелудочной железы
- •Механизм действия
- •Патология
- •Минералокортикоиды
- •Активация ренин-ангиотензин-альдостероновой системы
- •У женщин
- •Гормональные изменения во время менструального цикла Мишени и эффекты Эстрогены
- •Прогестерон
- •Патология
- •Патология Гипофункция
- •Гиперфункция
- •В крови пять фракций белков
- •Электрофорез белков
- •Общий вид электрофореза
- •Электрофореграмма (вверху) и графический результат ее обработки (внизу)
- •Нормальные величины белковых фракций плазмы крови
- •Типы протеинограмм
- •Белки крови выполняют серьезные задачи Функции белков плазмы крови
- •Альбумин - основной белок крови
- •Гиперальбуминемия
- •Гипоальбуминемия
- •Альфа1-глобулины включают большинство белков острой фазы
- •Альфа2-глобулины содержат протеазы и транспортные белки
- •Бета-глобулины - это чаще транспортные белки
- •Многие белки крови являются ферментами
- •Причины изменения активности ферментов в крови
- •Ферменты сыворотки крови
- •Единицы измерения активности ферментов
- •Не весь азот крови находится в белках
- •Происхождение и типы азотемий Фракции остаточного азота
- •Дефицит железа есть у трети населения
- •Железосодержащие белки
- •Пищевые источники
- •Всасывание
- •Метаболизм железа
- •Дефицит
- •Причины дефицита железа
- •Симптомы
- •Дефицит железа есть у трети населения
- •Железосодержащие белки
- •Пищевые источники
- •Всасывание
- •Метаболизм железа
- •Дефицит
- •Причины дефицита железа
- •Симптомы
- •Гемоглобин - основной белок крови
- •Строение гемоглобина
- •Нормальные формы гемоглобина
- •Патологические формы гемоглобина
- •У гемоглобина есть молекулярные болезни Серповидно-клеточная анемия
- •Нарушение синтеза гемоглобина Порфирии
- •Талассемии
- •Эффективность транспорта кислорода регулируется Изменение рН среды
- •Механизм эффекта Бора Кооперативное взаимодействие
- •Изменение формы субъединиц гемоглобина при присоединении кислорода
- •Гем требуется для многих ферментов
- •Распад гема - многостадийный процесс
- •Превращение в кишечнике
- •Токсичность билирубина состоит в его липофильности
- •Причины основных нарушений обмена билирубина Гемолитическая желтуха
- •Механическая желтуха
- •Паренхиматозная желтуха
- •Желтухи часто встречаются у новорожденных
- •Лабораторная диагностика
- •Роль внутриклеточных ионов водорода
- •Роль внеклеточных ионов водорода
- •Показатели кислотно-основного состояния
- •Водородный показатель
- •Нормальные величины
- •Концентрация бикарбонат-ионов
- •Нормальные величины
- •Клинико-диагностическое значение
- •Концентрация буферных оснований
- •Нормальные величины
- •Клинико-диагностическое значение
- •Общее содержание кислорода
- •Фосфатная буферная система
- •Белковая буферная система
- •Изменение заряда буферных групп белка при различных рН Гемоглобиновая буферная система
- •Длительная стабилизация сдвигов рН Физиологическая компенсация нарушений кос Дыхательная система
- •Костная ткань
- •Реабсорбция бикарбонат-ионов
- •Процесс реабсорбции бикарбонат-ионов
- •Ацидогенез
- •Процесс ацидогенеза в почечных канальцах
- •Аммониегенез
- •Процесс аммониегенеза в дистальных канальцах
- •Изменение кос - частая ситуация
- •Причины нарушений кислотно-основного состояния
- •Метаболический ацидоз Причины
- •1. Повышение содержания кислот в крови
- •2. Потеря бикарбонатов
- •Компенсация
- •2. Лихорадочные состояния
- •Использование показателя рСо2 для диагностики нарушений кислотно-основного состояния
- •Вода - главное вещество организма Роль воды в организме
- •Источники воды в клетке
- •Выведение воды из организма
- •Регуляция водного баланса
- •Почки - это не только удаление шлаков
- •Экскреторная функция
- •Регулирующая функция
- •Метаболическая функция
- •Гломерулярный фильтр пропускает большую часть веществ
- •Строение почечного фильтра
- •Реабсорбция в канальцах почек - процесс многоликий
- •Процессы реабсорбции в канальцах почек
- •Петля Генле обеспечивает реабсорбцию воды и солей
- •Процессы, происходящие в восходящей части петли Генле
- •Реабсорбция кальция происходит в дистальном отделе
- •События, происходящие в дистальной части нефрона
- •Конечный отдел нефрона определяет объем мочи
- •События, происходящие конечных отделах дистальных канальцев и собирательных трубочках Как оценить работу почек? Лабораторная оценка фильтрации
- •Лабораторная оценка реабсорбции
- •Прозрачность
- •Нормальные величины
- •Физиологические изменения
- •Патологические изменения
- •У мочи есть и другие особенности Поверхностное натяжение
- •Кислотно-основная реакция
- •Нормальные величины
- •Плотность
- •Неорганические компоненты мочи
- •Нормальные величины
- •Клинико диагностическое значение
- •Хлориды
- •Нормальные величины
- •Клинико диагностическое значение
- •Органические компоненты мочи Мочевина
- •Нормальные величины
- •Мочевая кислота
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Гиппуровая кислота
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Органические кислоты
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Пигменты
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Патологические компоненты мочи
- •Глюкоза
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Кетоновые тела
- •Печень перекрещивает метаболизм углеводов, липидов и белков
- •Взаимосвязь обмена белков, жиров и углеводов
- •Липидный обмен
- •Белковый обмен
- •Тесное взаимодействие синтеза мочевины и цтк Пигментный обмен
- •Оценка метаболической функции
- •Большая часть токсинов обезвреживается в печени
- •Места биотрансформации, задержки и выведения ксенобиотиков
- •Две фазы биотрансформации ксенобиотиков
- •Превращение индола в 1 и 2 фазах биотрансформации
- •Микросомы повышают реакционную способность молекул
- •Реакции микросомального окисления
- •Оценка реакций 1-й фазы
- •Конъюгирование резко повышает водорастворимость
- •Строение основных кислот реакций конъюгации
- •Строение глутатиона Иногда от обезвреживания становится хуже
- •Органотоксичность
- •Нормальный метаболизм парацетамола и причины его токсичности Химический канцерогенез
Право- и левовращающие формы аланина
Деление на L- и D-формы не соответствует делению на право- и левовращающие. Для одних аминокислот L-формы (или D-формы) являются правовращающими, для других – левовращающими. Например, L-аланин – правовращающий, а L-фенилаланин – левовращающий. При смешивании L- и D-форм одной аминокислоты образуется рацемическая смесь, не обладающая оптической активностью.
Для аминокислот характерна амфотерность
Основным физико-химическим свойством аминокислот является амфотерность.
Понятие амфотерность означает, что вещество сочетает в себе свойства как кислот, так и оснований. В водном растворе аминокислоты одновременно ведут себя как кислоты – доноры протонов и как основания – акцепторы протонов.
Если общий заряд аминокислоты равен 0, то это ее состояние называют изоэлектрическим. Величина рН, при которой заряд аминокислоты равен 0, называется изоэлектрической точкой (ИЭТ, pI). Значение изоэлектрической точки зависит от строения радикала аминокислоты:
ИЭТ большинства аминокислот располагается в диапазоне рН от 5,5 (фенилаланин) до 6,3 (пролин),
ИЭТ кислых аминокислот - для глутамата 3,2, для аспартата 2,8,
ИЭТ основных аминокислот - для гистидина 7,6, для аргинина 10,8, для лизина 9,7.
Заряд аминокислот зависит от величины рН среды и от строения их радикала.
При снижении концентрации ионов водорода в растворе (защелачивание среды) повышается их отрыв от аминогруппы и карбоксигруппы аминокислот. Иными словами, от аминокислоты отрывается положительный заряд и она становится отрицательно заряженной. Когда рН снижается (закисление среды), то имеющиеся в растворе ионы Н+ присоединяются к амино- и карбоксигруппам – заряд становится положительным.
Отправным пунктом для понимания причин появления заряда у конкретной аминокислоты является величина изоэлектрической точки. К сказанному абзацем выше необходимо добавить одну очень существенную вещь – изменение рН рассматривается относительно изоэлектрической точки. Если рН ниже ИЭТ – заряд аминокислоты становится положительным, если рН выше – отрицательным.
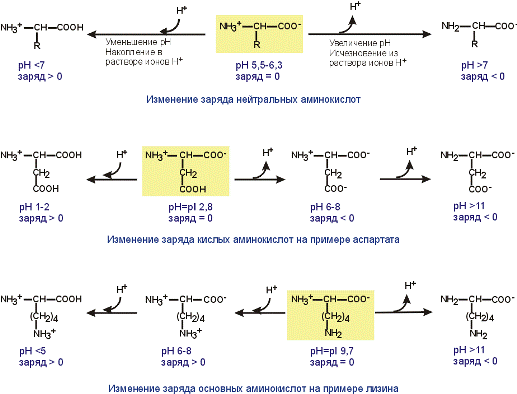
Изменение заряда аминокислот при смещении рН раствора в кислую или щелочную сторону.
Аминокислоты соединяются пептидной связью
Аминокислоты способны соединяться между собой связями, которые называются пептидными, при этом образуется полимерная молекула. Если количество аминокислот не превышает 10, то новое соединение называется пептид; если от 10 до 40 аминокислот – полипептид, если более 40 аминокислот – белок.
Пептидная связь –это связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты.
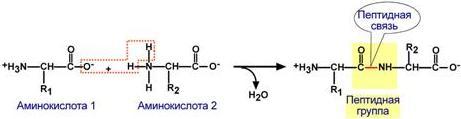
Образование пептидной связи
При необходимости назвать пептид ко всем названиям аминокислот добавляют суффикс "-ил", только последняя аминокислота сохраняет свое название неизменным.
Например, аланил-серил-триптофан или γ-глутаминил-цистеинил-глицин (по-другому называемый глутатион).
К свойствам пептидной связи относятся:
1. Копланарность
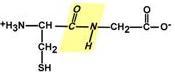
Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи.
2.Транс-положение заместителей
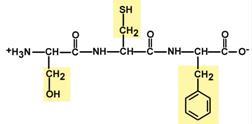
Радикалы аминокислот по отношению к оси C-N связи находятся по "разные" стороны, в транс-положении.
3. Две равнозначные формы

Пептидная связь имеет кетоформу и енольную форму.
4. Способность к образованию водородных связей.

Атомы углерода и азота, входящие в пептидную связь обладают способностью образовывать две водородные связи с другими пептидными группами.
5. Пептидная связь имеет частично характер двойной связи.
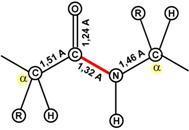
Длина пептидной связи меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено. Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов).
Направления метаболизма аминокислот
Существуют три источника аминокислот в клетке – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот.
Путь дальнейшего превращения аминокислот зависит от вида и функции клетки, условий ее существования и гормональных влияний. Спектр веществ, получаемых клеткой из аминокислот, чрезвычайно широк.
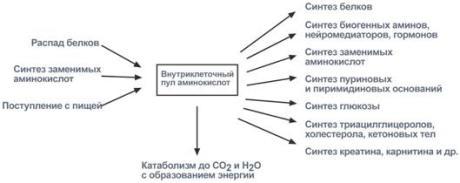
Возможные пути превращений аминокислот
Реакции превращения аминокислот в клетке условно разделяют на три части, в зависимости от реагирующей группы:
• по боковой цепи (радикалу) (перейти), • по карбоксильной группе (перейти), • с участием аминогруппы (перейти).
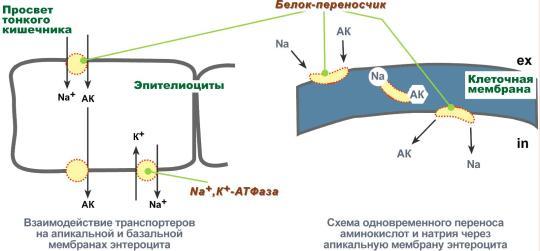
Аминокислоты надо переносить через мембраны
Перенос аминокислот через мембраны клеток, как при всасывании из полости кишечника в энтероциты, так и при переходе из крови в клетки различных тканей, осуществляется при помощи двух механизмов:вторичный активный транспорт и глутатионовая транспортная система.
Транспорт аминокислот через мембраны
Вторичный активный транспорт
Вторичный активный транспорт – это перенос веществ, в данном случае аминокислот, с использованием градиента концентрации натрия между внутренней и наружной сторонами клеточной мембраны.
Вторичный активный транспорт основан на использовании низкой концентрации ионов натрия внутри клеток, создаваемой мембранным ферментом Na+,K+-АТФазой. Специфический белок-транспортер связывает на апикальной поверхности энтероцитов аминокислоту и ион натрия. Важно то, что в отсутствие натрия аминокислота не в состоянии связаться с белком-переносчиком.
Затем, изменив свое положение в мембране, белок отдает ион натрия в цитозоль по градиенту концентрации. Сразу после этого аминокислота теряет связь с белком и остается в цитоплазме.