
- •Лекции по общей химии Введение.
- •Основные законы химии.
- •Стехиометрические законы.
- •Газовые законы.
- •3. Уравнение состояния идеального газа (Клапейрона-Менделеева).
- •Строение атома
- •Квантово-механическая модель строения атома
- •Лекция 3. Периодический закон и электронные конфигурации атомов.
- •Радиусы атомов. Потенциал ионизации. Сродство к электрону. Электроотрицательность.
- •Лекции 2, 3 Химическая связь. Метод молекулярных орбиталей (ммо).
- •Рассмотрим молекулы нf и ВеН2, в которых имеет место образование несвязывающих мо. Сравнение методов мвс и ммо.
- •О валентности.
- •Металлическая связь.
- •Ионная связь.
- •Водородная связь.
- •Межмолекулярные взаимодействия.
- •Взаимосвязь между типом хс и свойствами веществ.
- •Стеклообразное состояние вещества.
- •Применение процессов возбуждения электронов для практических целей.
- •Основы химической термоднамики. Функции состояния.
- •Внутренняя энергия
- •Энтальпия.
- •Энтропия.
- •2 Закон (Начало)т/д: в изолированной системе самопроизвольно протекают только такие процессы, которые ведут к росту энтропии.
- •Энергия Гиббса.
- •Энергия Гельмгольца.
- •Кинетика химических реакций.
- •Зависимость скорости реакции от температуры.
- •Катализ.
- •Цепные реакции.
- •Химическое равновесие.
- •Растворы.
- •Свойства разбавленных растворов неэлектролитов (коллигативные свойства – независящие от природы вещества).
- •Осмос и осмотическое давление.
- •Диссоциация кислот, оснований, солей.
- •Протонная теория кислот и оснований Бренстеда и Лоури.
- •Произведение растворимости.
- •Особенности растворов сильных электролитов.
- •Ионные реакции в растворах электролитов.
- •Комплексные соединения.
- •Количественные характеристики процесса гидролиза.
- •Буферные растворы.
- •Окислительно-восстановительные реакции.
- •Окислительно-восстановительная двойственность.
- •Составление уравнений овр.
- •Окислительно-восстановительный (электродный) потенциал.
- •Окислительно-восстановительная способность двух форм электрохимической системы.
- •Эдс как количественная характеристика возможности протекания окислительно-восстановительного процесса.
- •Окислительно-восстановительная способность двух форм электрохимической системы.
- •Уравнение Нернста.
- •1.Взаимодействие металлов с водой.
- •2.Взаимодействие металлов с растворами щелочей.
- •3.Взаимодействие металлов с кислотами, в которых окислитель – катион водорода.
- •4.Взаимодействие металлов с концентрированной серной кислотой.
- •Взаимодействие концентрированной серной с неметаллами-восстановителями.
- •5.Взаимодействие металлов с азотной кислотой (разб. И конц.).
- •Взаимодействие азотной кислоты с неметаллами
- •Взаимодействие металлов с растворами солей.
- •Окислительно-восстановительные свойства воды.
- •Коррозия металлов
- •Газовая коррозия
- •Образование оксидной пленки на металлах
- •Атмосферная коррозия
- •Электрохимическая коррозия
- •Методы защиты от коррозии.
- •1. Модификация самого металла:
- •2.Отделение (предохранение) металла от окружающей среды с помощью защитных покрытий (неметаллических):
- •3.Металлические защитные покрытия.
- •4.Электорохимические методы защиты (суть – заставить разрушаться болванкам).
- •5.Специальная обработка электролита или среды, в которой находится металл (удаление или уменьшение концентрации веществ, вызывающих коррозию).
- •6.Химическая обработка для повышения коррозионной стойкости (пассивация поверхности металла) - то, что не использовалось в выше приведенных методах, часто в расплавах или при повышенных температурах.
- •Измерение э.Д.С. Химических источников тока.
- •Химические источники электрической энергии (хиээ)
- •Аккумуляторы.
- •Типы аккумуляторов
- •Свинцово-кислотные аккумуляторы.
- •Принцип действия
- •Устройство
- •Литий-ионные аккумуляторы.
- •Литиевые элементы различных электрохимических систем
- •Электролиз.
- •Законы электролиза м. Фарадея.
- •Практическое применение электролиза.
- •Электрофорез и электродиализ.
- •Металлы и сплавы.
- •Классификация металлов.
- •Основные методы получения металлов.
- •Получение металлов высокой чистоты.
- •Металлы и сплавы
Радиусы атомов. Потенциал ионизации. Сродство к электрону. Электроотрицательность.
Периодичность электронного строения атомов элементов ПС определяет и периодичность в изменении их физических свойств. В первую очередь прослеживается четкая связь между строением атома и периодическим изменением таких физических свойств как величины атомных радиусов, потенциала ионизации, сродства к электрону и электроотрицательности.
АТОМНЫЕ РАДИУСЫ (ОБЪЕМЫ).
Орбитальный радиус свободного атома – это расстояние от центра атома до главного максимума плотности внешнего электронного слоя. Он характеризует атом в основном состоянии и определяется с помощью метода рентгеноструктурного анализа. С помощью этого метода определяют графически положение максимума функции радиального распределения (Ф.Р.Р) – F2(r), которая характеризует вероятность нахождения электрона на некотором расстоянии от ядра (см. рис.)
За эффективный (ковалентный) радиус принимают половину межъядерного расстояния в ковалентной гомоядерной (молекула простого вещества) двухатомной молекуле (т.е. половина длины связи). Например: длина связи в молекуле F2, установленная методами рентгеноструктурного анализа и электронографии, основанной на изучении дифракции электронов, равна 1,28 нм. Следовательно эффективный радиус равен 0,64 нм. Следует отметить, что для твердых металлов атомные радиуса всегда больше длины связи: длина связи в молекуле Li2 равна 1,52 нм, а радиус атома лития 1.22 нм.
Значения атомных радиусов элементов находятся в периодической зависимости от атомного номера элемента. В периоде при движении слева направо наблюдается уменьшение атомных радиусов, т.к. увеличивается притяжение электронов к ядру, несмотря на силы отталкивания между электронами, количество которых увеличивается. При движении группах сверху вниз имеет место увеличение атомных радиусов из-за увеличения числа электронных слоев атома. Радиусы катионов меньше, а радиусы анионов больше, чем радиусы атомов.
ПОТЕНЦИАЛ ИОНИЗАЦИИ (П.И.).
П.И. – это энергия, затраченная в вакууме на удаление электрона из атома на бесконечно большое расстояние. Ме = Меn+ + е + I . (+) соответствует затрате энергии извне – система энергию получает.
Измеряется в электрон-вольтах или кДж. 1 эВ = 1.6 10-19Дж. Например: IСа= 6,11 эВ. Чем меньше потенциал ионизации, тем легче электрон оторвать от атома. Легче всего удалить первый электрон, затем второй и т.д., поэтому I1 I2 I3. Фактически, П.И. – это мера степени металлических свойств элемента. Чем меньше П.И., тем сильнее выражены металлические свойства атома.
В группе придвижении сверху вниз (с увеличением порядкового номера) наблюдается уменьшение П.И., что связано с увеличением атомных радиусов, большим расстоянием до ядра и. соответственно, меньшим притяжением к ядру. В периоде с увеличением порядкового номера – в основном, постепенное увеличение П.И., связанное с ростом заряда ядра и, соответственно с большим притяжением электронов к ядру. Однако есть исключения, связанные с особенностями электронной структуры атомов. Например, у атомов элементов 2 периода зависимость следующая (см рис).
Причины в следующем:
- П.И.(В) П.И.(Ве), т.к. электронная структура 2s2 (Ве) более устойчива, чем бора (2s22р1).
- П.И. (О) П.И (N), поскольку электронная структура 2р3 (азота) более устойчива, чем 2р4 (кислорода).
У d и f-элементов, имеющих близкие свойства, вследствие эффекта экранирования (уменьшение воздействия на данный электрон положительного заряда ядра из-за наличия между ним и ядром других электронов)и различной глубины проникновения электронов к ядру (электрон может находиться в любой точке атомного пространства), потенциал ионизации меняется незначительно.
СРОДСТВО к ЭЛЕКТРОНУ (Е).
Сродство к электрону – энергия, которая выделяется в результате присоединения электрона к атому: Э + е = Эn+ - Е. Экспериментально определить величину Е очень сложно, и надежно измерено сродство к электрону далеко не для всех атомов.: Е (О) = 1,47эВ; Е (Н) = 0,75 эВ. Сродство к электрону у атомов элементов тоже изменяется периодически. Наибольшим сродством к электрону обладают р-элементы VII группы, т.к. они приобретают конфигурацию s2р6 – инертных газов. Наименьшим и даже отрицательным – атомы с конфигурацией s2р6 (инертные газы), т.е. они фактически отталкивают электрон от атома. Водород может не только терять электрон, но и приобретать. Но сродства к электрону водорода в 20 раз меньше, чем потенциал ионизации. Поэтому, в основном атом водорода образует положительно заряженные ионы Н+, а не Н-.
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ (ЭО)
ЭО – это обобщенная характеристика элемента, связанная с внешними электронами; характеризует способность атома, находящегося в соединении, притягивать (удерживать) электроны. Р.Малликен показал, что количественно ЭО характеризуется полусуммой потенциала ионизации и сродства к электрону: ЭО= I +E/2. Но поскольку экспериментально определить сродство к электрону практическфи невозможно, то Л.Полинг (лауреат Нобелевской премии 1932г.) ввел понятие относительной ЭО (ОЭО). По этой шкале ОЭО атома фтора (самого «электороотрицательного» элемента П.С.) была принята за 4,0; ОЭО лития – за 1,0. Из этих значений рассчитаны ОЭО остальных элементов.
Строго говоря,
элементу нельзя приписать постоянную
ЭО, т.к. она зависит от типа химической
связи в соединении и его окружения.
Л.Полинг рассчитывал разность абсолютных
электроотрицательностей элементов,
сравнивая энергии связи в молекуле АВ
с энергиями связи в исходных молекулах
А2 и
В2,
используя формулу: ЭО
= 0,208
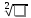 ЕАВ-
(ЕААЕВВ)1/2,
где Е
- энергии связи в молекулах АВ, А2
и В2.
ЕАВ-
(ЕААЕВВ)1/2,
где Е
- энергии связи в молекулах АВ, А2
и В2.
