
- •Лекции по общей химии Введение.
- •Основные законы химии.
- •Стехиометрические законы.
- •Газовые законы.
- •3. Уравнение состояния идеального газа (Клапейрона-Менделеева).
- •Строение атома
- •Квантово-механическая модель строения атома
- •Лекция 3. Периодический закон и электронные конфигурации атомов.
- •Радиусы атомов. Потенциал ионизации. Сродство к электрону. Электроотрицательность.
- •Лекции 2, 3 Химическая связь. Метод молекулярных орбиталей (ммо).
- •Рассмотрим молекулы нf и ВеН2, в которых имеет место образование несвязывающих мо. Сравнение методов мвс и ммо.
- •О валентности.
- •Металлическая связь.
- •Ионная связь.
- •Водородная связь.
- •Межмолекулярные взаимодействия.
- •Взаимосвязь между типом хс и свойствами веществ.
- •Стеклообразное состояние вещества.
- •Применение процессов возбуждения электронов для практических целей.
- •Основы химической термоднамики. Функции состояния.
- •Внутренняя энергия
- •Энтальпия.
- •Энтропия.
- •2 Закон (Начало)т/д: в изолированной системе самопроизвольно протекают только такие процессы, которые ведут к росту энтропии.
- •Энергия Гиббса.
- •Энергия Гельмгольца.
- •Кинетика химических реакций.
- •Зависимость скорости реакции от температуры.
- •Катализ.
- •Цепные реакции.
- •Химическое равновесие.
- •Растворы.
- •Свойства разбавленных растворов неэлектролитов (коллигативные свойства – независящие от природы вещества).
- •Осмос и осмотическое давление.
- •Диссоциация кислот, оснований, солей.
- •Протонная теория кислот и оснований Бренстеда и Лоури.
- •Произведение растворимости.
- •Особенности растворов сильных электролитов.
- •Ионные реакции в растворах электролитов.
- •Комплексные соединения.
- •Количественные характеристики процесса гидролиза.
- •Буферные растворы.
- •Окислительно-восстановительные реакции.
- •Окислительно-восстановительная двойственность.
- •Составление уравнений овр.
- •Окислительно-восстановительный (электродный) потенциал.
- •Окислительно-восстановительная способность двух форм электрохимической системы.
- •Эдс как количественная характеристика возможности протекания окислительно-восстановительного процесса.
- •Окислительно-восстановительная способность двух форм электрохимической системы.
- •Уравнение Нернста.
- •1.Взаимодействие металлов с водой.
- •2.Взаимодействие металлов с растворами щелочей.
- •3.Взаимодействие металлов с кислотами, в которых окислитель – катион водорода.
- •4.Взаимодействие металлов с концентрированной серной кислотой.
- •Взаимодействие концентрированной серной с неметаллами-восстановителями.
- •5.Взаимодействие металлов с азотной кислотой (разб. И конц.).
- •Взаимодействие азотной кислоты с неметаллами
- •Взаимодействие металлов с растворами солей.
- •Окислительно-восстановительные свойства воды.
- •Коррозия металлов
- •Газовая коррозия
- •Образование оксидной пленки на металлах
- •Атмосферная коррозия
- •Электрохимическая коррозия
- •Методы защиты от коррозии.
- •1. Модификация самого металла:
- •2.Отделение (предохранение) металла от окружающей среды с помощью защитных покрытий (неметаллических):
- •3.Металлические защитные покрытия.
- •4.Электорохимические методы защиты (суть – заставить разрушаться болванкам).
- •5.Специальная обработка электролита или среды, в которой находится металл (удаление или уменьшение концентрации веществ, вызывающих коррозию).
- •6.Химическая обработка для повышения коррозионной стойкости (пассивация поверхности металла) - то, что не использовалось в выше приведенных методах, часто в расплавах или при повышенных температурах.
- •Измерение э.Д.С. Химических источников тока.
- •Химические источники электрической энергии (хиээ)
- •Аккумуляторы.
- •Типы аккумуляторов
- •Свинцово-кислотные аккумуляторы.
- •Принцип действия
- •Устройство
- •Литий-ионные аккумуляторы.
- •Литиевые элементы различных электрохимических систем
- •Электролиз.
- •Законы электролиза м. Фарадея.
- •Практическое применение электролиза.
- •Электрофорез и электродиализ.
- •Металлы и сплавы.
- •Классификация металлов.
- •Основные методы получения металлов.
- •Получение металлов высокой чистоты.
- •Металлы и сплавы
6.Химическая обработка для повышения коррозионной стойкости (пассивация поверхности металла) - то, что не использовалось в выше приведенных методах, часто в расплавах или при повышенных температурах.
а) Оксидирование – создание металлических оксидных пленок. Например алюминий погружают в раствор Nа2СrО4 или проводят электролиз в хромовокислом растворе или в растворе щавелевой кислоты, где алюминий – анод. Органические красители могут придать пленке любой цвет (анодированный алюминий).
б) Воронение – получение цветных оксидных пленок на железе и его сплавах (оксиды железа II и III и их смесь); они могут быть окрашены в синий, коричневый и серый цвета. Получают сухим термическим способом, нагревая железный предмет в печи до температуры 300-450оС, или мокрым – обработкой поверхности в кипящем сильно щелочном растворе солей (NaNO2, NaNO3).
в) Образование фосфатных пленок (см выше).
г) Образование защитных поверхностных слоев, причем обладающих значительной механической прочностью, при взаимодействии не с кислородом, а с другими неметаллами (иногда с металлами):
- углеродом (цементация – науглероживание поверхности с последующей термоупрочняющей обработкой);
- бором (осаждение и диффузия бора – бориды железа обладают большой твердостью абразивной износостойкостью);
- кремнием (силицированные покрытия делают на частях насосов, вентелях, лентах транспортеров и др.);
- азотом (азотоуглероживание - нитроцементация в газовых при 600оС (NH3+ H2+CO) или жидкостных средах (расплав в жидких средах цианидов и цианатов натрия NaCN+NaCNO при 750-900оС.);
- алитирование – создание поверхностного слоя алюминия на никелевых и кобальтовых сплавах турбинных лопаток;
- термохромирование - нанесение химическим способом тонких слоев карбидов хрома, обладающих повышенной твердостью;
- диффузное цинкование – для защиты от коррозии низкоуглеродных сталей и чугуна;
- газохимические покрытия CVD (Chemical Vapour Deposition) из легко испаряющихся галогенидов (фторидов, хлоридов, бромидов, иодидов) переходных металлов 4 и 5 групп ПС, а также карбонилов металлов и металлоорганических соединений при 500-15000С: Тil4 + 2H2 = Ti + 4HI
Ni(CO)4 = Ni + 4CO.
Измерение э.Д.С. Химических источников тока.
Для измерения э.д.с. гальванических элементов и аккумуляторов. Используют высокоомные вольтметры (с большим внутренним сопротивлением) для того, чтобы величина тока была минимальной I = U/R. Если пи измерении э.д.с. идет ток, то величина разности потенциалов уменьшается и не соответствует э.д.с.
Химические источники электрической энергии (хиээ)
ХИЭЭ – устройства для прямого превращения химической энергии окислительно-восстановительных реакций в электрическую. Существуют три типа источников тока: ГЭ, топливные элементы и аккумуляторы.
ГЭ относятся к первичным элементам, т.е. устройствам, которые допускают лишь однократное использование активных материалов электродов. В процессе работы регенерация (обновление) реагентов и самих электродов не происходит. Это источники энергии однократного использования (в быту мы их называем «батарейки»). Один из первых ГЭ – это элемент Даниеля –Якоби:
Zn|ZnSO4||CuSO4|Сu.
Анод (окисление): Zn → Zn2+ + 2e
Kатод (восстан-е): Cu2+ + 2e → Cu
При замыкании внешней цепи через систему пойдет электрический ток до тех пор, пока на электродах будут идти процессы обмена с передачей электронов, обусловленные различными электродными потенциалы цинка и меди. Электродный потенциал цинка меньше, чем меди, поэтому в процессах обмена цинк будет окисляться, отдавая два электрона, которые будут использоваться для восстановления катионов меди до металлического состояния. Электрод, на котором протекает процесс окисления называется анодом, а электрод-металл, на котором протекает процесс восстановления – катодом. В схеме электрической цепи металл-анод (более электроотрицательный) записывают слева, а металл-катод (более электроположительный) – справа. ЭДС этого элемента составляет Е = 0, 34 –(-0,76) = 1,1В.
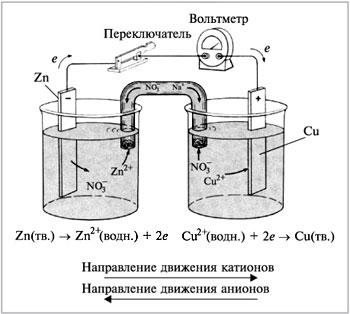
Рис. 3. Электрохимическая цепь или гальванический элемент
Марганцево-цинковый элемент, также известный как элемент Лекланше — это первичный химический источник тока, в котором анодом является цинковый стаканчик (корпус батарейки) с герметичным уплотнением из полимерных материалов. Катодом – графитовый стержень, помещенный в смесь диоксида марганца с измельченным графитом. В качестве электролита (ионного проводника) используется пастообразная смесь хлоридов аммония и цинка. Это один из самых широко распространенных ГЭ (Е = 1,25-1,5В). Используется в переносных устройствах для питания радиоприемников, часов, игрушек и пр. Он очень удобен в эксплуатации, т.к. его составные части твердые или пастообразные. Изначально элементы заполнялись жидким электролитом. В дальнейшем электролит стали загущать с помощью крахмалистых веществ — это позволяло сделать более практичные элементы питания, называемые сухими, в которых сведена к минимуму возможность вытекания электролита.
Схема ГЭ: Zn|NH4Cl, ZnCl2|MnO2(C)
Процессы на электродах:
Анод: Zn → Zn2+ + 2e
Катод: MnO2 + NH4+ + e → MnOOH + NH3 или MnO2 + Н2О+ e → MnOOH + ОН-
или метагидороксид марганца (III)
Суммарный процесс: Zn + 2MnO2 +2Н2О+ e → Zn2+ + 2MnOOH + 2ОН-. Далее образуется гидроксид цинка: Zn2+ + ОН- = Zn(ОН)2. Хлорид аммония вводится для того, чтобы препятствовать процессу образования гидроксида цинка, затрудняющего анодный процесс, образуя растворимую комплексную соль:
2Zn(ОН)2 + 4NH4Cl = Zn(NH3)4Cl2 + 4Н2О + ZnCl2

![]()
Марганцево-цинковый элемент. (1) — металлической колпачок, (2) — графитовыйэлектрод («+»), (3) —цинковыйстакан («—»), (4) — оксид марганца, (5) — электролит, (6) — металлический контакт.
Топливный элемент (ТЭ) – первичный (неперезаряжаемый) химический источник тока (ХИТ), в котором происходит непрерывное возмещение расходуемых реагентов и непрерывное удаление образующихся продуктов.
Появление первых ТЭ – это реализация идеи прыямого превращения энергии сгорания горючих веществ в электрическую. Применение топливных элементов для этой цели позволяет получить К.П.Д., близкий к 100%. В то время как сжигание топлива в современной теплоэлектростанции дает КПД 20%, максимум 40%.
Принцип действия. Топливный элемент (рис. 1) состоит из двух электродов, разделенных электролитом, и систем подвода топлива (водорода и кислодрода) на электроды, а также системы для удаления продуктов реакции. В большинстве случаев для ускорения химической реакции используются катализаторы. Внешней электрической цепью топливный элемент соединен с нагрузкой, которая потребляет электроэнергию.
Есть типы ТЭ щелочные и кислотные, но суммарная ОВР у них одна: 2Н2 + О2 = 2Н2О. Электроды в ТЭ – индефферентные, т.е. не принимающие участие в электродных процессах. Их изготавливают из графита с добавками платины и металлов платиновой группы, также применяют электроды из серебра, никеля, спеченные оксидные электроды.
В изображенном на рисунке топливном элементе с кислым электролитом водород подается через полый анод и поступает в электролит через очень мелкие поры в материале электрода. При этом происходит разложение молекул водорода на атомы, которые в результате хемосорбции, отдавая каждый по одному электрону, превращаются в положительно заряженные ионы. Этот процесс может быть описан следующими уравнениями:
В кислотных ТЭ протекают реакции:
Анод: Н2 2Н+ + 2e Ix2
Катод: О2 + 4Н+ + 4e 2Н2О
2Н2(газ) + О2(газ) 2Н2О(жид)
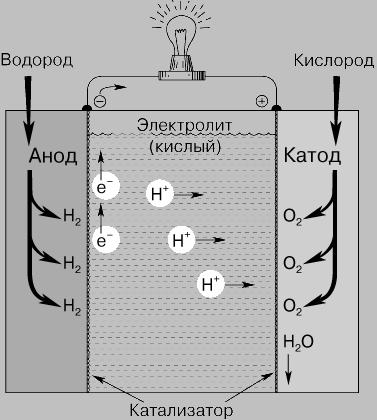 Рис.
1. ВОДОРОДНО-КИСЛОРОДНЫЙ ТОПЛИВНЫЙ
ЭЛЕМЕНТ. Эти элементы непрерывно
снабжаются кислородом и водородом для
получения электрической энергии в
результате постоянно поддерживающейся
химической реакции.
Рис.
1. ВОДОРОДНО-КИСЛОРОДНЫЙ ТОПЛИВНЫЙ
ЭЛЕМЕНТ. Эти элементы непрерывно
снабжаются кислородом и водородом для
получения электрической энергии в
результате постоянно поддерживающейся
химической реакции.
Наиболее распространенным является щелочной ТЭ. Газообразные водород и кислород пропускают через пористые угольные электроды в концентрированном растворе щелочи:
Анод: 2Н2 + 4ОН- → 4Н2О + 4e
Катод: О2 + 2Н2О + 4e 4ОН-
2Н2(газ) + О2(газ) 2Н2О(жид)
Образующаяся в результате реакции вода частично разбавляет электролит. В любом топливном элементе часть энергии химической реакции превращается в тепло. Поток электронов во внешней цепи представляет собой постоянный ток, который используется для совершения работы. Большинство реакций в топливных элементах обеспечивают ЭДС около 1,0 – 1,2 В. Размыкание цепи или прекращение движения ионов останавливает работу топливного элемента. Процесс, происходящий в водородно-кислородном топливном элементе, по своей природе является обратным хорошо известному процессу электролиза, в котором происходит диссоциация воды при прохождении через электролит электрического тока. Действительно, в некоторых типах топливных элементов процесс может быть обращен - приложив к электродам напряжение, можно разложить воду на водород и кислород, которые могут быть собраны на электродах. Если прекратить зарядку элемента и подключить к нему нагрузку, такой регенеративный топливный элемент сразу начнет работать в своем нормальном режиме. Теоретически размеры топливного элемента могут быть сколь угодно большими. Однако на практике несколько элементов объединяются в небольшие модули или батареи, которые соединяются либо последовательно, либо параллельно. Типы топливных элементов. Существуют различные типы топливных элементов. Их можно классифицировать, например, по используемому топливу, рабочему давлению и температуре, по характеру применения. Есть топливные элементы. Где вместо водорода используют гидразин
N2H2 + O2 = N2 + 2Н2О
Применение: Поскольку в процессе работы ТЭ образуется вода, которую можно использовать в качестве питьевой, например, на космических кораблях, где применяют системы из топливных элементов в качестве источника энергии. В недалеком будущем топливные элементы могут стать широко используемым источником энергии на транспорте, в промышленности и домашнем хозяйстве. Пока высокая стоимость топливных элементов ограничивает их применение военными и космическими приложениями. Предполагаемые применения топливных элементов включают их применение в качестве переносных источников энергии для армейских нужд и компактных альтернативных источников энергии для околоземных спутников с солнечными батареями при прохождении ими протяженных теневых участков орбиты. Небольшие размеры и масса топливных элементов позволили использовать их при пилотируемых полетах к Луне. Топливные элементы на борту трехместных кораблей "Аполлон" применялись для питания бортовых компьютеров и систем радиосвязи. Топливные элементы можно использовать в качестве источников питания оборудования в удаленных районах, для внедорожных транспортных средств, например в строительстве. В сочетании с электродвигателем постоянного тока топливный элемент будет эффективным источником движущей силы автомобиля. Для широкого применения топливных элементов необходимы значительный технологический прогресс, снижение их стоимости и возможность эффективного использования дешевого топлива. При выполнении этих условий топливные элементы сделают электрическую и механическую энергию широко доступными во всем мире.
