
- •Глава 1.Предмет термодинамики.Основные понятия и определения.Особенности термодинамического метода исследования.Термодинамическая форма записи закона сохранения и превращения энергии.
- •Термодинамический метод исследования
- •Глава 2. Первый закон термодинамики. Равновесное состояние системы. Равновесные и неравновесные взаимодействия.
- •Глава 3. Уравнение состояния. Теплоемкость идеальных газов.
- •Критерий стабильности
- •Глава 4. Энтальпия. Расчет изменения внутренней энергии, энтальпии и энтропии. Графический метод в термодинамике
- •Глава 6. Исследование свойств реальных веществ. Термические переменные и связь между ними. Характеристические функции. Дифференциальные соотношения термодинамики.
- •Глава 8. Свойства двухфазных систем. P - V и t - s диаграммы двухфазных систем. Таблицы “Состояние насыщения” и “Вода и перегретый пар”.
- •Глава 9. Диаграмма I - s для парожидкостных систем. Особенности расчета процессов с реальными веществами
- •Глава 10. Уравнение Клапейрона-Клаузиса. Р -е диаграмма фазового равновесия. Особенности фазовых переходов первого и второго рода.
- •Глава 11. Особенности химических и фазовых превращений. Фаза. Ингредиент. Компонент. Условие равновесия многофазной многокомпонентной системы
- •Глава 12. Правило фаз Гиббса. Принцип минимальности характеристических функций
- •Глава 13. Возрастание энтропии и потеря работоспособности системы при протекании в ней необратимых процессов. Второй закон термодинамики
- •Глава 14. Тепловая теорема Нернса (постулат Нернста). Абсолютное значение энтропии. Свойства веществ вблизи абсолютного нуля температуры
- •Глава 15. Термодинамика потока. Течение газа по каналам. Процесс течения в p - V и I - s координатах
- •Глава 16. Скорость звука. Энтальпия и температура торможения. Связь скорости потока со скоростью звука. Влияние формы канала и трения на поток.
- •Глава 17. Течение газа через отверстие в стенке сосуда и через сопло Ловаля. Дросселирование. Кривая инверсии
- •Глава 18.Сжатие газов и паров.
- •Глава 19 . Циклы холодильных машин
- •Глава 20. Цикл теплового насоса
Глава 8. Свойства двухфазных систем. P - V и t - s диаграммы двухфазных систем. Таблицы “Состояние насыщения” и “Вода и перегретый пар”.
Равнодействующая этих сил - 2 направлена в глубь жидкости ( при низких давлениях силы сцепления между молекулами в паровой фазе вообще ничтожно малы). При выходе в паровое пространство молекула жидкости должна преодолеть действие молекулярных сил, т.е. совершить работу выхода. Для этого молекула должна обладать необходимым запасом кинетической энергии. При низких температурах кинетическая энергия молекул жидкости мала, поэтому в паровое пространство переходит незначительное их число. С ростом температуры повышается кинетическая энергия каждой молекулы и соответственно увеличивается количество молекул, переходящих в паровую фазу. Это приводит к росту давления пара над жидкостью. При температуре, равной температуре насыщения, паровое пространство насыщается молекулами пара. При этом устанавливается динамическое равновесие между фазами, при котором число молекул , пересекающих границу раздела фаз, со стороны жидкости и пара одинаково.
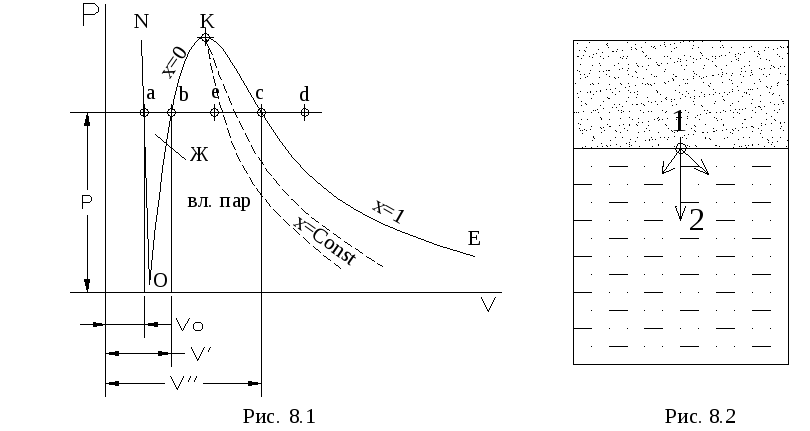
Параметры жидкости при температуре насыщения (в точке “b”на рис. 8.1) отмечаются одним штрихом. При подводе теплоты к насыщенной жидкости последняя испаряется и превращается в сухой насыщенный пар (точка “с”). Сухой насыщенный пар - это пар, который не содержит жидкости и имеет температуру, равную температуре насыщения, так как в процессе испарения ( в процессе “b-с”) температура жидкости не изменяется. Параметры сухого насыщенного пара отмечаются двумя штрихами ( v”,s “,i “ и т.д.). Любая точка на линии b-c (например, точка “е”) характеризует состояние равновесной смеси насыщенной жидкости и сухого насыщенного пара. Такая смесь называется влажным паром.
При подводе теплоты к сухому насыщенному пару его температура повышается. Пар, температура которого больше Тн- температуры насыщения при данном давлении, называется перегретым паром (точка “d” на рис . 8.1).
Процесс парообразования можно провести и при других давлениях. Если соединить точки “а”, “b”, “с”, относящиеся к различным давлениям, то получим пограничные линии. Каждая точка на линииONхарактеризует состояние жидкости при температуре плавления твердого тела. Для воды - это нулевая изотерма. Линия ОК - нижняя пограничная кривая. Каждая точка на этой кривой характеризует состояние жидкости при температуре насыщения, соответствующей данному давлению. С ростом давления температура насыщения повышается . Линия КЕ - верхняя пограничная кривая, каждая точка которой характеризует состояние сухого насыщенного пара при различных давлениях. Точка К - критическая точка, в которой наблюдается особое состояние вещества (критическое). В критической точке нет разницы в свойствах жидкой и паровой фаз. Каждая жидкость имеет одну критическую точку с характерными для нее значениями критических параметров (Ркр, Ткр,vкр).
Между кривыми ONи ОК располагается область жидкости, недогретой до температуры насыщения. Между пограничными кривыми располагается область влажного пара. Правее верхней пограничной кривой располагается область перегретого пара.
Параметры влажного пара определяются степенью сухости пара
x = (8.1)
(8.1)
В соотношении (8.1) М’и М” - масса жидкости и сухого насыщенного пара, находящихся во влажном паре. Если масса влажного пара Мвл.п = 1 кг, то xчисленно равняется массе сухого насыщенного пара, находящегося в одном килограмме влажного пара(x= М”). Количество жидкой фазы, находящейся в одном килограмме влажного пара М’= - x. Значениеxизменяется от нуля на нижней пограничной кривой (жидкость) до единицы на верхней пограничной кривой (сухой насыщенный пар). При каждом давлении можно получить влажный пар с любой степенью сухости. Соединив точки с одинаковой степенью сухости, получим кривыеx = Const ( пунктирные линии на рис. 8.1).
Определение параметров влажного пара.
Объем влажного пара
со степенью сухости x
-(Vx)равен сумме объемов жидкой![]() и
паровой
и
паровой![]() фаз
фаз![]()
Здесь v
’ и
![]() - удельные объемы жидкой и
паровой фаз. Следовательно, удельный
объем влажного пара
- удельные объемы жидкой и
паровой фаз. Следовательно, удельный
объем влажного пара
![]() (8.2)
(8.2)
Аналогичным образом определяются и остальные величины, характеризующие свойства влажного пара, например, энтальпии и энтропии
![]() (8.3)
(8.3)
![]() (8.4)
(8.4)
Если известны значения vx, ix, sx , то из соотношений (8.2) - (8.4) можно рассчитать степень сухости пара
![]() (8.5)
(8.5)
При давлениях, далеких
от критического и при достаточно высоких
степенях сухости , вычисляя величину
х , можно пренебречь объемом жидкости
![]() ,
так как он намного меньше
vx
и, тем более,
,
так как он намного меньше
vx
и, тем более,![]() .При
атмосферном давлении для воды значение
.При
атмосферном давлении для воды значение
![]() ,
примерно в 1700 раз больше.
,
примерно в 1700 раз больше.
![]()
Разность объемов (![]() -
-![]() )
на p
- v диаграмме определяется
отрезкомb-c,
а разность объемов (vx
-
)
на p
- v диаграмме определяется
отрезкомb-c,
а разность объемов (vx
-![]() )
- отрезкомb-e.
Следовательно, графически степень
сухости пара определяется отношением
отрезков
)
- отрезкомb-e.
Следовательно, графически степень
сухости пара определяется отношением
отрезков![]() .Следует отметить, что соотношения (8.5)
служат только для расчета степени
сухости пара, но не раскрывают физический
смысл величины х, который определяется
соотношением (8.1).
.Следует отметить, что соотношения (8.5)
служат только для расчета степени
сухости пара, но не раскрывают физический
смысл величины х, который определяется
соотношением (8.1).
Отметим также
принципиальную разницу в ходе процессов
подогрева жидкости
(a-b)
и при испарении жидкости в процессе
(b-c).
В первом случае вся масса жидкости
равновесным образом подогревается до
температуры насыщения. Во втором случае
при подводеdQ
кДж
теплоты только
![]() кг
жидкости превращается в сухой насыщенный
пар, удельный объем которого
кг
жидкости превращается в сухой насыщенный
пар, удельный объем которого
![]() во
много раз больше удельного объема
во
много раз больше удельного объема![]() .
Свойства этого пара на p
- v диаграмме определяются
точкой “с“. Свойства остальной
массы жидкости в процессе испарения
остаются неизменными и определяются
точкой “b”.
Таким образом, в процессе испарения
наблюдается скачек в свойствах вещества.
С ростом давления разница в
свойствах паровой и жидкой фаз уменьшается
и при критическом давлении полностью
исчезает.
.
Свойства этого пара на p
- v диаграмме определяются
точкой “с“. Свойства остальной
массы жидкости в процессе испарения
остаются неизменными и определяются
точкой “b”.
Таким образом, в процессе испарения
наблюдается скачек в свойствах вещества.
С ростом давления разница в
свойствах паровой и жидкой фаз уменьшается
и при критическом давлении полностью
исчезает.

Некоторые энергетические соотношения
Некоторые, наиболее используемые энергетические соотношения двухфазных систем рассмотрим на примере системы “вода - водяной пар”.
В изобарном процессе
a-b
(рис. 8.1) на подогрев воды от T = 00C
до температуры насыщения Тн
затрачивается теплота, которая
называется теплотой жидкостиqж
= DiСледовательноqж=![]() ,
гдеi0
= u0
+pv0
- энтальпия воды при Т = 00С
. Условно считают , что внутренняя энергия
водыu0
= 0, поэтому энтальпия воды при
Т = 00С равнаi0
= pv0.
Значениеi0
намного меньше
,
гдеi0
= u0
+pv0
- энтальпия воды при Т = 00С
. Условно считают , что внутренняя энергия
водыu0
= 0, поэтому энтальпия воды при
Т = 00С равнаi0
= pv0.
Значениеi0
намного меньше![]() .
Например, при р = 0,1 МПа и Т0= 00С удельный объем водыv0
= 0,001м3/кг и значение удельной энтальпииi0
=
1,0х105х10-3 =100 Дж/кг При
р =0,1 МПа значение Тн= 99,640С,
а средняя теплоемкость воды в интервале
температур от 00С до 1000С
равна
4170 Дж/кг К. Следовательно,qж=
.
Например, при р = 0,1 МПа и Т0= 00С удельный объем водыv0
= 0,001м3/кг и значение удельной энтальпииi0
=
1,0х105х10-3 =100 Дж/кг При
р =0,1 МПа значение Тн= 99,640С,
а средняя теплоемкость воды в интервале
температур от 00С до 1000С
равна
4170 Дж/кг К. Следовательно,qж=![]() -i0
= 415,5 кДж/кг ,т.е. в 4155 раз большеi0,
поэтомуqж»
-i0
= 415,5 кДж/кг ,т.е. в 4155 раз большеi0,
поэтомуqж»![]() .
В процессе при
р
=Constдля любого веществаdq
= di = Tds = CpdT.
Отсюда
.
В процессе при
р
=Constдля любого веществаdq
= di = Tds = CpdT.
Отсюда
ds = Cp![]() или
или![]() (8.6)
(8.6)
При испарении одного
килограмма жидкости в процессе b-c
отводится теплота, называемая
теплотой испарения
-
r =![]() .
.
Изменение энтропии в
процессе испарения
![]()
Изменение внутренней
энергии в процессе испарения
![]() .
В процессе перегрева пара от
температуры насыщения до температуры
перегреваTпер
количество подведенной теплоты
.
В процессе перегрева пара от
температуры насыщения до температуры
перегреваTпер
количество подведенной теплоты
![]() ,
,
где
![]() энтальпия перегретого пара при заданных
Тни Тпер;
энтальпия перегретого пара при заданных
Тни Тпер;![]() - средняя теплоёмкость перегретого пара
в интервале температур от Тндо
Тпер.
Изменение энтропии в процессе
перегрева -
- средняя теплоёмкость перегретого пара
в интервале температур от Тндо
Тпер.
Изменение энтропии в процессе
перегрева -![]() (8.7)
(8.7)
Термодинамические параметры жидкости при Т £Тн, а также сухого насыщенного и перегретого пара можно рассчитывать по уравнению состояния. Однако эти уравнения настолько сложны, что пользоваться ими в обычных инженерных расчетах затруднительно. Поэтому по уравнению состояния были рассчитаны значения всех необходимых величин и результаты расчета, согласованные с многочисленными экспериментальными данными, сведены в таблицы, которыми пользуются в инженерной практике. Параметры, например , воды и пара на линии насыщения сведены в таблицу “Состояние насыщения”. Параметры воды, недогретой до температуры насыщения, и перегретого пара приведены в таблице “Вода и перегретый пар”
T - s диаграмма для парожидкостных системы
Как следует из соотношения (8.6) процесс подогрева воды при p = Constот температуры 00С до температуры насыщения ТнвT - sкоординатах изображается в виде логарифмической линии. При этом конфигурация изобар с ростом давления изменяется, однако эти изменения настолько незначительны, что в тех масштабах, в которых диаграммаT - sобычно изображают, изобары различных давлений практически сливаются в одну общую нижнюю пограничную линию. Для воды, например, отклонение изобар от нижней пограничной кривой становятся заметными при давлениях более 18 МПа. Строго говоря, изобары различных давлений смыкаются с нижней пограничной кривой в точках“b”. В процессе испарения приp= Сonst температура жидкости, равная температуре насыщения, не меняется, поэтому изобары в области влажного пара представляют собой горизонтальные линии. Следовательно, в процессе испарения, т.е. в области влажного пара, критерий стабильности оказывается равным нулю:
![]()
![]()
Изобары в области
перегретого пара, так же, как и в области
жидкости, представляют собой
логарифмические кривые, однако тангенс
угла наклона касательной к изобаре
перегретого пара больше, чем в области
жидкости. Это объясняется тем, что
теплоемкость Срводы примерно
в два раза больше теплоемкости![]() пара (при средних давлениях). Из уравнений
(8.6) и (8.7) следует, что при одном и том же
отношении температур изменение энтропии
для воды больше, чем для пара.
пара (при средних давлениях). Из уравнений
(8.6) и (8.7) следует, что при одном и том же
отношении температур изменение энтропии
для воды больше, чем для пара.
Изохоры на рис. 8.4 изображены пунктирными линиями. В области влажного пара изохоры являются незаконными линиями, которые строятся по точкам. В области влажного пара на Т - sдиаграмме наносятся линииx = Const(штрих пунктирные линии). Здесь наносятся также кривые i = Const(пунктирные линии с двумя штрихами). Как видно, в области перегретого пара, вблизи верхней пограничной кривой линииi = Constизгибаются, а вдали от неё выходят на горизонтальные линии. Это является следствием того, что в правой части диаграммы располагается область низких давлений, в которой перегретый пар ведет себя , как идеальный газ. Как уже известно, для идеального газа энтальпия является функцией только температуры ( при Т= Const , i = Const). Изохоры в области перегретого пара, так же, как и для газов, идут круче изобар.

