- •Глава 1.Предмет термодинамики.Основные понятия и определения.Особенности термодинамического метода исследования.Термодинамическая форма записи закона сохранения и превращения энергии.
- •Термодинамический метод исследования
- •Глава 2. Первый закон термодинамики. Равновесное состояние системы. Равновесные и неравновесные взаимодействия.
- •Глава 3. Уравнение состояния. Теплоемкость идеальных газов.
- •Критерий стабильности
- •Глава 4. Энтальпия. Расчет изменения внутренней энергии, энтальпии и энтропии. Графический метод в термодинамике
- •Глава 6. Исследование свойств реальных веществ. Термические переменные и связь между ними. Характеристические функции. Дифференциальные соотношения термодинамики.
- •Глава 8. Свойства двухфазных систем. P - V и t - s диаграммы двухфазных систем. Таблицы “Состояние насыщения” и “Вода и перегретый пар”.
- •Глава 9. Диаграмма I - s для парожидкостных систем. Особенности расчета процессов с реальными веществами
- •Глава 10. Уравнение Клапейрона-Клаузиса. Р -е диаграмма фазового равновесия. Особенности фазовых переходов первого и второго рода.
- •Глава 11. Особенности химических и фазовых превращений. Фаза. Ингредиент. Компонент. Условие равновесия многофазной многокомпонентной системы
- •Глава 12. Правило фаз Гиббса. Принцип минимальности характеристических функций
- •Глава 13. Возрастание энтропии и потеря работоспособности системы при протекании в ней необратимых процессов. Второй закон термодинамики
- •Глава 14. Тепловая теорема Нернса (постулат Нернста). Абсолютное значение энтропии. Свойства веществ вблизи абсолютного нуля температуры
- •Глава 15. Термодинамика потока. Течение газа по каналам. Процесс течения в p - V и I - s координатах
- •Глава 16. Скорость звука. Энтальпия и температура торможения. Связь скорости потока со скоростью звука. Влияние формы канала и трения на поток.
- •Глава 17. Течение газа через отверстие в стенке сосуда и через сопло Ловаля. Дросселирование. Кривая инверсии
- •Глава 18.Сжатие газов и паров.
- •Глава 19 . Циклы холодильных машин
- •Глава 20. Цикл теплового насоса
Глава 4. Энтальпия. Расчет изменения внутренней энергии, энтальпии и энтропии. Графический метод в термодинамике
Одной из энергетических характеристик термодинамической системы является тепловая функцияили энтальпия. Выражение для энтальпии можно получить из первого закона термодинамики
dQ = dU + pdV (4.1)
Так как d(pV) = pdV + Vdp, то pdV = d(pV) - Vdp. Подставляя это значение pdV в уравнение (4.1) , получим
dQ = dU + d(pV) - Vdp = d(U + pV) - Vdp (4.2)
Сумма (U + pV) = Iи является энальпией. С учетом выражения для энтальпии уравнение (4.2) можно записать в следующем виде
dQ = dI - Vdp (4.3)
свойства энтальпии:
- энтальпия системы является однозначной функцией состояния системы;
- дифференциал dI является полным дифференциалом;
- энтальпия является аддитивной величиной ;
энтальпия тела определяется в термодинамике с точностью до некоторой постоянной слагающей. Для изохорного процесса (C = Cv и dV = 0) на основании уравнения (4.1) имеем dU = CvdT (4.4)
Аналогично из уравнения (4.3) для изобарного процесса получаем
dI = CpdT (4.5)
Первый закон термодинамики справедлив для веществ с любыми свойствами, поэтому по уравнению (4.4) в изохорном процессе, а по уравнению (4.5) в изобарном процессе соответственно dU и dI можно рассчитывать для веществ с любыми свойствами.
Формулы для расчета изменения энтропии идеального газа
1. dQ = dU + pdV или TdS = CvdT + pdV (4.6)
Из последнего уравнения следует
dS = Cv![]() (4.6а)
(4.6а)
После интегрирования уравнения (4.6а) получим
S2- S1=
![]() (4.7)
(4.7)
2. dQ = dI - Vdp или TdS = CpdT - Vdp (4.8)
Из формулы (4.8) следует
dS
= Cp![]() (4.9)
(4.9)
Из формулы (4.9) следует
S2- S1 =![]() (4.10)
(4.10)
Графический метод в термодинамике

Диаграмма p - Vпримечательна тем, что в этих координатах площадь под кривой, характеризующей процесс, определяет работу, совершаемую газа при расширении, или работу, затраченную на сжатие. Действительно, площадка под элементарным процессом (рис. 4.2) есть работа A = pdV. Полная работа в процессе1-2будет равна

![]()
![]() (4.11)
(4.11)
Рис. 4.2 Рис. 4.3
Процесс можно рассматривать и в координатах T - S - V. Проекция пространственной кривой на плоскость T - S даст плоскую кривую. Представление процесса в координатах T - S дает возможность определить количество теплоты, подведенное к системе (dS >0) из внешней среды, или отведенное от нее в окружающую среду (dS<0). Площадь под элементарным процессом равна TdS, т.е. количеству теплоты dQ, рис. 4.3.
Полное
количество теплоты в процессе 1-2 может
быть представлено следующим выражением
Q =
![]() .
.
T - S диаграмма для идеального газа
Из формулы (4.7) следует, что в изохорном процессе
(DS)v
=
![]() (4.12)
(4.12)
Для изобарного процесса из формулы (4.10) имеем
(DS)p
= (Cp)![]() (4.13)
(4.13)

![]() DS)T= R ln V1/V2и (DS)T= - R ln p2/p1.
DS)T= R ln V1/V2и (DS)T= - R ln p2/p1.
Следовательно, изохоры больших объёмов располагаются правее от основной изохоры, а меньших объёмов - левее. Следовательно область низких давлений располагается правее от основной изобары, а область высоких давлений - левее.
Расстояние между основной изохорой и изохорами двойного, тройного и больших объёмов равны R ln2, R ln3 и так далее. Расстояние между изобарами: -R ln2, R ln3 и так далее.

При неравновесном адиабатном расширении (1-4) или сжатии (1-5) вследствие выделения теплоты трения энтропия увеличивается. При этом, в процессе неравновесного адиабатного расширения газ совершает меньшую работу, чем в равновесном, так как часть энергии газа расходуется на преодоление сопротивления трения. При неравновесном сжатии работа затрачивается большая, по сравнению с равновесным процессом.
Действительно, в процессе расширения:
A1-2 = -DU1-2= -![]() и A1-4= -DU1-4= -
и A1-4= -DU1-4= -![]()
Откуда следует, что А1-2>А1-4
При сжатии:
A1-3=-DU1-3=![]() и A1-5= -DU1-
5 = -
и A1-5= -DU1-
5 = -![]()
![]()
Откуда следует, что А1-3<А1-5.
I - S диаграмма для идеального газа

Анализ составляющих уравнения первого закона термодинамики

Внутренняя энергия является функцией состояния, поэтому изменение её не зависит от пути, по которому рабочее тело перешло из одного состояния в другое, рис. 4.7.
DU1-a-2=DU1-b-2=DU1-c-2
следовательно, dU есть полный дифференциал функции U, значение которой однозначно определяется заданием всех координат состояния U=U(x1,x2,...., xm).Для термодеформационной системы = U(S,V). Как видно из рис. 4.7 работа, т. е. А, в указанных процессах (площадь под кривой, описывающей процесс) различная. Аналогично и количество теплоты Q в T-S координатах будет отличаться друг от друга в зависимости от вида процесса. Следовательно, dQ и dA в уравнении первого закона термодинамики не являются полными дифференциалами, а представляют собой элементарные количества теплоты и работы.
Глава 5. Разомкнутые термодинамические процессы. Круговые процессы (циклы). Особенности тепловых и холодильных машин. термический коэффициент полезного действия цикла тепловой и холодильной машин. Цикл и теорема Карно.
Очевидно, что изменение состояния системы возможно только в результате её взаимодействия с окружающей средой. Закон изменения состояния зависит от характера внешних воздействий, т. е. от того в каких формах происходит обмен энергией системы с окружающей средой и в каких соотношениях между собой находятся значения количеств взаимодействий. Для термодеформационного взаимодействия системы, варьируя количеством теплоты и работы, можно осуществить любой закон изменения состояния газа.

![]() (5.1)
(5.1)
Здесь n - показатель политропы, значение которого остается неизменным в данном процессе.
Вывод уравнения политропы, как и других термодинамических соотношений, основан на первом законе термодинамики.
dQ = dU + dA или CdT = CvdT + pdV. Вынося за скобки dT, получим
(С - Сv) dT - pdV = 0 (5.2)
Дифференцируя уравнение состояния идеального газа pV = RT, получим
dT = (pdV + Vdp) / R. Подставим это значение dT в уравнение (5.2)
 (5.3)
(5.3)
Так как R = Cp - Cv, то подставив это значение в уравнение (5.3), получим
![]()
![]() (5.4)
(5.4)
Обозначим
![]() , и поделив (5.4) на произведение pV, получим
, и поделив (5.4) на произведение pV, получим
![]() . После интегрирования полученного
соотношения находим окончательный
результат
. После интегрирования полученного
соотношения находим окончательный
результат![]() или
или![]() (5.5)
(5.5)
Из уравнения (5.5) следует , что для :
- изобарного процесса (p = Const) n = 0
- изотермического процесса (T = Const) n = 1,0.
В адиабатном процессе
- Q = 0, следовательно, С = 0 и показатель
политропы
![]() - показатель адиабаты , значение которого
для двухатомных газов при относительно
невысоких температурах равно 1,4 , а для
трехатомных газов
- показатель адиабаты , значение которого
для двухатомных газов при относительно
невысоких температурах равно 1,4 , а для
трехатомных газов
k = 1,3. k =
![]()
C увеличением температуры теплоёмкость газов увеличивается, поэтому значение k уменьшается, однако очень незначительно.
Извлечением корня n- ой степени (см. уравнение (5.5)) получим
![]() .
Следовательно , в изохорном процессе
(V = Const ) величина n =¥. На рис. 5.2 и 5.3 рассматриваемые процессы
представлены в p-V и T-S координатах.
.
Следовательно , в изохорном процессе
(V = Const ) величина n =¥. На рис. 5.2 и 5.3 рассматриваемые процессы
представлены в p-V и T-S координатах.

Соотношения между параметрами в политропном процессе
На
основании закона Бойля-Мариотта для
политропного процесса можем записать
![]() . Откуда
. Откуда (5.6)
(5.6)
Из
уравнения состояния идеального газа
получим
![]() .
.
Подставляя
это значение
![]() в уравнение (5.6) , получим
в уравнение (5.6) , получим
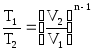 (5.7)
(5.7)
После несложных преобразований из уравнений (5.6) и (5.7) определяем
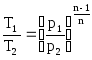 (5.8)
(5.8)
Работа в политропном процессе
 Для
получения уравнения, характеризующего
работу в политропном процессе,
воспользуемся выражениями для полной
работы процесса A=
Для
получения уравнения, характеризующего
работу в политропном процессе,
воспользуемся выражениями для полной
работы процесса A=![]() и уравнением политропы
и уравнением политропы![]() .Из последнего выражения выразим текущее
значение давления
.Из последнего выражения выразим текущее
значение давления![]() .
Подставив это выражение для давления
в формулу для работы ,получим
.
Подставив это выражение для давления
в формулу для работы ,получим
Если ввести ещё одну характеристику политропного процессаa=DU/Q, то, не производя расчета, только на основании значения показателя политропы n можно определить в каком соотношении находятся между собой Q,aиDU.
Используя выражение
для n (![]() )
, произведя несложные преобразования,
получим
)
, произведя несложные преобразования,
получим![]() .
Откуда
.
Откуда![]()
![]() , где k = Cp / Cv . Тогдаa=DU / Q =
, где k = Cp / Cv . Тогдаa=DU / Q =![]()
Пример: рассчитать доли затрат подведенной к системе теплоты на изменение внутренней энергии и на совершение работы для показателя политропы n = 0,8 и двухатомного газа ( k = 1,4). Величина коэффициента aa= -0,2 / -0,6 = 1/3. Таким образом,DU = 1/3 Q , а А = 2/3 Q, т. е. 1/3 подведенной теплоты затрачивается на изменение внутренней энергии , а 2/3 - на совершение работы.
Круговые термодинамические процессы (циклы)

Апол= Арасш- Асж (5.10)

Аналогичные результаты можно получить , используя первый закон термодинамики для процессов расширения (Qпод =DU1-a-2 + Aрасш) и сжатия (- Qотв=DU2-b-1- Aсж ). При отводе теплоты и сжатии газа теплота и работа отрицательные (поставлен знак минус). Суммируя эти уравнения и учитывая, что внутренняя энергия, как функция состояния, не изменяется в цикле, (DU1-а-2=DU2-b-1) запишем
Qпод- Qотв= Арасш- Асж= Апод (5.11)
Эффективность работы теплового двигателя оценивается термическим коэффициентом полезного действия
![]() (5.12)
(5.12)
В уравнение (5.12) значение Qотвподставляется по абсолютной величине, так как знак (минус) при Qотвбыл учтен ранее.
Особенности циклов тепловых машин
1. Линия расширения лежит выше линии сжатия.
Теплота подводится при высокой температуре, а отводится при более низкой температуре. Таким образом, в тепловом двигателе происходит перенос теплоты с верхнего температурного уровня на нижний температурный уровень.
Все процессы в цикле равновесные. Для того, чтобы подвести или отвести от рабочего тела теплоту равновесным образом при переменной его температуре необходимо иметь бесконечно большое количество источников теплоты и холодильников, еак как в каждый данный момент разность температур источника и рабочего тела, а также рабочего тела и холодильника должна быть бесконечно малой.
Цикл Карно
Цикл, дающий максимальное значение термического к.п.д. (при определенных температурах нагревателя и охладителя), предложенный французским ученым-инженером Сади Карно, носит название цикла Карно.

Термический к.п.д. цикла Карно в соответствии с уравнением (5.12) определяется
следующим образом:
![]()
Так
как DS1-2
= êDS3-4
ê,
то
![]() (5.13)
(5.13)
Теорема Карно
Теорема формулируется
следующим образом. Термический КПД
цикла Карно не зависит от физических
свойств рабочего тела и имеет максимальное
значение из всех возможных циклов в
заданном интервале температур. Первая
часть теоремы не требует доказательства,
так как в выражение для
![]() не входят физические константы
рабочего тела. Значение
не входят физические константы
рабочего тела. Значение![]() зависит только от разности температур,
при которых подводится и отводится
теплота в цикле. На рис 5.7 изображен
цикл Карно 1-2-3-4 и вписанный в него
произвольный цикл АBCD .
зависит только от разности температур,
при которых подводится и отводится
теплота в цикле. На рис 5.7 изображен
цикл Карно 1-2-3-4 и вписанный в него
произвольный цикл АBCD .
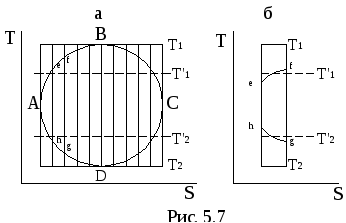
![]() и
и![]() . Тогда термический КПД цикла efgh можно
рассчитать по формуле (5.13)
. Тогда термический КПД цикла efgh можно
рассчитать по формуле (5.13)
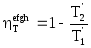 , а
, а![]()
![]()
Так как
![]() >
>![]() , а Т2 <
, а Т2 <![]() , то
, то![]() <
<![]() . Аналогичный вывод можно сделать по
отношению к каждому из элементарных
циклов. Поэтому данный вывод справедлив
и для цикла ABCD , т.е.
. Аналогичный вывод можно сделать по
отношению к каждому из элементарных
циклов. Поэтому данный вывод справедлив
и для цикла ABCD , т.е.![]() <
<![]() .
.
Полученный результат
объясняется тем, что термический КПД
любого цикла зависит не от максимальной
разности температур, достигаемой в
цикле, а зависит от средне интегральных
температур, при которых подводится и
отводится теплота в цикле. В цикле АBCD
теплота подводится от точки А до точки
С при средне интегральной температуре
![]() , а отводится - при средне интегральной
температуре
, а отводится - при средне интегральной
температуре
![]() . Следовательно, эффективная разность
температур в цикле АВСD меньше разности
температур в цикле Карно, поэтому
. Следовательно, эффективная разность
температур в цикле АВСD меньше разности
температур в цикле Карно, поэтому![]() <
<![]() .
.
Несмотря на то, что в цикле Карно теплота наиболее эффективно преобразуется в работу, этот цикл в реальных тепловых двигателях не применяется по следующим причинам:

2. В цилиндре двигателя, работающего по циклу Карно, будут развиваться очень высокие давления. Рассмотрим это на примере двигателя внутреннего сгорания, работающего по адиабатическому процессу:
 или
или
В двигателях внутреннего сгорания подводится при температуре сгорания топлива Т1 @1800 К, а отводится в атмосферу при Т4@300 К и давлении р1= = 0,1 МПа. Приняв величину k = 1,35 , получим значение р4= 120 Мпа.
Несмотря на указанные причины цикл Карно имеет большое значение, так как служит эталоном при проектировании реальных двигателей.
Некоторые общие сведения о циклах холодильных машин
Цикл холодильной машины в p-V и T-S координатах изображен на рис. 5.9 и 5.10.
В холодильной машине теплота подводится к рабочему телу (хладагенту) от охлаждаемого тела, например, от охлаждаемых продуктов, находящихся в холодильной камере. в которой поддерживается минусовая температура. Теплота от рабочего тела отводится при более высокой температуре. Перенос теплоты от нижнего температурного уровня на верхний в холодильной машине оказывается возможным благодаря работе, затрачиваемой на проведение цикла. Эффективность работы холодильной машины оценивается значением холодильного коэффициента
e=Qпод/ Aзатр ,
представляющий собой отношение хладопроизводительности машины хладопроизводительность машины (Qпод) к затраченной работе.