
- •Глава 1.Предмет термодинамики.Основные понятия и определения.Особенности термодинамического метода исследования.Термодинамическая форма записи закона сохранения и превращения энергии.
- •Термодинамический метод исследования
- •Глава 2. Первый закон термодинамики. Равновесное состояние системы. Равновесные и неравновесные взаимодействия.
- •Глава 3. Уравнение состояния. Теплоемкость идеальных газов.
- •Критерий стабильности
- •Глава 4. Энтальпия. Расчет изменения внутренней энергии, энтальпии и энтропии. Графический метод в термодинамике
- •Глава 6. Исследование свойств реальных веществ. Термические переменные и связь между ними. Характеристические функции. Дифференциальные соотношения термодинамики.
- •Глава 8. Свойства двухфазных систем. P - V и t - s диаграммы двухфазных систем. Таблицы “Состояние насыщения” и “Вода и перегретый пар”.
- •Глава 9. Диаграмма I - s для парожидкостных систем. Особенности расчета процессов с реальными веществами
- •Глава 10. Уравнение Клапейрона-Клаузиса. Р -е диаграмма фазового равновесия. Особенности фазовых переходов первого и второго рода.
- •Глава 11. Особенности химических и фазовых превращений. Фаза. Ингредиент. Компонент. Условие равновесия многофазной многокомпонентной системы
- •Глава 12. Правило фаз Гиббса. Принцип минимальности характеристических функций
- •Глава 13. Возрастание энтропии и потеря работоспособности системы при протекании в ней необратимых процессов. Второй закон термодинамики
- •Глава 14. Тепловая теорема Нернса (постулат Нернста). Абсолютное значение энтропии. Свойства веществ вблизи абсолютного нуля температуры
- •Глава 15. Термодинамика потока. Течение газа по каналам. Процесс течения в p - V и I - s координатах
- •Глава 16. Скорость звука. Энтальпия и температура торможения. Связь скорости потока со скоростью звука. Влияние формы канала и трения на поток.
- •Глава 17. Течение газа через отверстие в стенке сосуда и через сопло Ловаля. Дросселирование. Кривая инверсии
- •Глава 18.Сжатие газов и паров.
- •Глава 19 . Циклы холодильных машин
- •Глава 20. Цикл теплового насоса
Глава 14. Тепловая теорема Нернса (постулат Нернста). Абсолютное значение энтропии. Свойства веществ вблизи абсолютного нуля температуры
Особенность энтропии состоит, в частности, в том, что она введена в науку через свой дифференциал, а не по абсолютному значению, как все другие координаты состояния. Определить абсолютное значение энтропии, опираясь только на первый и второй законы термодинамики, не представляется возможным, так как при этом возникают непреодолимые трудности при выборе константы интегрирования, т.е. при определении нуля отсчета энтропии. Между тем, в термодинамике широко используются функции, дифференциал которых содержит абсолютное значение энтропии, например свободная энергия и свободная энтальпия
dF = SdT - pdV и dФ = SdT +Vdp
Трудности в определении абсолютного значения энтропии были преодолены Нернстом (1906 г.). Постулат Нернста по праву называют третьим законом термодинамики, так как он содержит результаты, которые не нашли отражения в первых двух законах. Анализируя многочисленные опытные данные , накопленные при изучении поведения веществ при низких температурах, Нернст пришел к выводу, что при химических реакциях, протекающих в изохорно-изотермических условиях, разность между изменениями свободной энергии DF и внутренней энергиейDU (DF-DU) весьма мала. С понижением температуры тела эта разность уменьшается. Когда температура устремляется к нулю Кельвина значенияDF иDUасимптотически приближаются друг к другу и при Т = 0 К DF = DU. Действительно,
F = U - TS (14.1)
Запишем это уравнение для двух состояний в рассматриваемых условиях
F1 = U1 - TS1 и F2 = U2 - TS2. Вычитая одно из другого, получимDF = DU - TDS
При Т = 0 К DF
= DU.
Из соотношения дляdF
приV
=Constследует![]() . Подставляя это значение
S в (14.1), получим
. Подставляя это значение
S в (14.1), получим
![]() или
или
![]() (14.2)
(14.2)
В изобарно-изотермических условиях характеристической функцией является свободная энтальпия
Ф = U -TS +pV = I -TS (14.3)
и dФ
= - SdT +Vdp. Приp
= Const
![]() .
Подставляя это значениеSв уравнение (14.3), находим Ф =I
+ T
.
Подставляя это значениеSв уравнение (14.3), находим Ф =I
+ T![]() или
или
DФ
=DI
+ T![]() (14.4)
(14.4)
Уравнения (14.2) и (14.4) называются уравнениями Гиббса-Гельмгольца. Эти уравнения можно записать в виде

![]()
![]() (14.5)
(14.5)
Основываясь на большом
опытном материале, накопленном к тому
времени при изучении свойств тел вблизи
абсолютного нуля температуры, Нернст
предположил, что уменьшение значений
разностей (DF
- DU)
и(DФ
-DI)вблизи абсолютного нуля является
следствием понижения не только самой
температуры, но и значений производных![]() и
и
![]() .
.
Следовательно,
![]() =
=
![]() =
0
=
0![]()
Аналогично
![]()
![]() =
=
![]() =
0 (14.6)
=
0 (14.6)
Эти уравнения в математической форме выражают постулат Ненрнста. Таким образом, установлено, что существует некоторый интервал температур, в пределах которого изменение свободной энергии в ходе изохорно-изотермической реакции, а также изменение свободной энтальпии и энтальпии в ходе изобарно-изотермической реакции различаются незначительно.
Абсолютное значение энтропии
Уравнения (18.6) можно представить в другом виде. Учитывая, что
![]() , из (18.6) получим
, из (18.6) получим
lim T® 0(S2 - S1) = lim T® 0DS = 0 (14.7)
Это значит , что вблизи абсолютного нуля температуры в изотермическом процессе энтропия не меняется и принимает некоторое предельное значение S0.
М. Планк развил дальше теорию Нернста. Он показал, что предельное значение энтропии для всех тел одинаково и не может быть ни чем иным, как абсолютным нулем энтропии, т.е. S0 = 0, или
lim T® 0DS = 0 (14.8)
Свойства тел вблизи абсолютного нуля температуры
Термические
коэффициентыИзвестно, что производные![]() и
и![]() называются
термической расширяемостью и термической
упругостью соответственно. Величины
называются
термической расширяемостью и термической
упругостью соответственно. Величины![]() и
и![]() называются коэффициентами термической
расширяемости и термической упругости.
При приближении к абсолютному нулюdF
= - SdT - pdV иdФ
= -SdT + Vdp.
Из этих выражений для дифференциала
свободной энергии и свободной энтальпии
мы получили два дифференциальных
соотношения -
называются коэффициентами термической
расширяемости и термической упругости.
При приближении к абсолютному нулюdF
= - SdT - pdV иdФ
= -SdT + Vdp.
Из этих выражений для дифференциала
свободной энергии и свободной энтальпии
мы получили два дифференциальных
соотношения -
![]() и
и![]() .
Следовательно,
.
Следовательно,![]()
![]() .
По теореме Нернста, при Т®0 энтропия не меняется (dS
= 0), поэтому при Т®0
.
По теореме Нернста, при Т®0 энтропия не меняется (dS
= 0), поэтому при Т®0
bV ® 0 иbр®0 (14.9)
Энтропия и теплоемкости Сp и СV
Воспользуемся
полученными ранее соотношениями
![]() и
и![]() .
.
Интегрируя, получим
![]() и
и
![]() (14.10)
(14.10)
Из уравнения (14.10) следует, что при Т ®0 теплоёмкости СV и Срдолжны устремляться к нулю. Другой результат противоречил бы теореме Нернста.. Действительно, если принять, что вблизи абсолютного нуля теплоёмкость будет иметь конечное значение, например, при её зависимости от температуры вида СV = a + bT + ... ,то подставив это значение СV в (14.10)
получим
![]() =
=![]() (14.11)
(14.11)
Из уравнения (14.11) следует, что при любой температуре, отличной от нуля
S ® - ¥ . Это противоречит теореме Нернста, в соответствии с которой энтропия должна иметь конечное значение.
Из уравнения (14.10) следует , что для расчета абсолютного значения энтропии нужно только знать зависимость теплоемкостей СV и Срот температуры и термическое уравнение состояния.
Недостижимость абсолютного нуля температуры
На рис. 14.2 изображен цикл Карно, в котором теплота подводится при тнмператауре Т1, а отводится при температуре Т2= 0 К. Очевидно , что в цикле SDS= 0, т.е.
DS1-2 + DS2-3 + DS3-4+ DS4-1 = 0 (14.12)
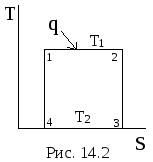
Отвод теплоты от рабочего тела при температуре Т ®0 К невозможен и потому, что теплоёмкость вещества устремляется к нулю быстрее, чем сама температура. При некоторой температуре, большей абсолютного нуля, теплоемкость может оказаться равной нулю.
