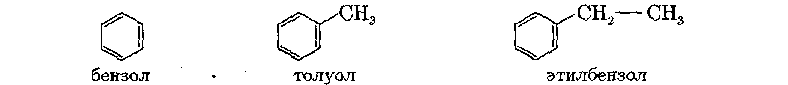- •Содержание
- •Введение
- •1 Основные понятия и законы химии
- •1.1 Основные понятия химии
- •1.2 Основные законы химии
- •2 Основные классы неорганических соединений
- •2.1 Простые вещества
- •2.2 Сложные вещества
- •3 Растворы
- •3.1 Общие свойства растворов
- •3.1.2 Способы выражения состава растворов
- •3.1.3 Физико-химические процессы образования растворов
- •3.1.4 Экстракция
- •3.2 Растворы неэлектролитов
- •3.2.1 Законы Рауля
- •3.2.2 Осмос
- •3.3 Растворы электролитов
- •3.3.1 Электролитическая диссоциация
- •3.3.2 Сильные и слабые электролиты
- •3.4 PH водных растворов
- •4 Ионно-обменные реакции
- •4.1 Необратимые ионно-обменные реакции
- •4.2 Обратимые ионно-обменные реакции
- •5 Гидролиз солей
- •5.1 Различные случаи гидролиза
- •2) Гидролиз соли образованной сильным основанием и слабой кислотой
- •3) Гидролиз соли образованной слабым основанием и слабой кислотой
- •5.2 Константа гидролиза
- •5.3 Смещение равновесия при гидролизе
- •6. Окислительно-восстановительные реакции
- •6.1 Составление уравнений окислительно-восстановительных реакций
- •6.2 Прогнозирование окислительно-восстановительных свойств веществ по степеням окисления элементов
- •6.3 Основные типы окислительно-восстановительных реакций
- •6.4 Взаимодействие металлов с водой, кислотами и щелочами
- •7 Гальванические элементы
- •7.1 Принцип работы гальванического элемента
- •7.2 Водородный электрод сравнения. Электрохимический ряд
- •8 Электролиз
- •8.1 Электролиз расплавов
- •8.2 Электролиз водных растворов
- •8.3 Количественные расчёты в электролизе
- •8.4 Химические источники электрической энергии
- •9 Коррозия металлов
- •9.1 Виды и типы коррозии
- •9.2 Способы защиты металлов от коррозии
- •9.2.1 Изолирование металлов от внешней среды
- •9.2.2 Изменение состава коррозионной среды
- •9.2.3 Рациональное конструирование
- •9.2.4 Электрохимические способы защиты от коррозии
- •10 Термодинамика
- •10.1 Внутренняя энергия и энтальпия. Закон Гесса
- •Или через промежуточный продукт (со) в две реакции:
- •10.2 Энтропия
- •10.3 Энергия Гиббса
- •11 Химическая кинетика Химическая кинетика – учение о скоростях и механизмах протекания химических реакций.
- •11.1 Скорость реакции
- •Основные факторы, влияющие на скорость реакции:
- •Число частиц с энергией большей, чем Еа равно заштрихованной площади.
- •12.1.2 Модель атома по Бору
- •12.2 Современные представления о строении атома
- •13 Периодический закон и периодическая таблица д.И. Менделеева
- •14 Химическая связь и строение молекул
- •14.1 Химическая связь
- •14.1.1 Квантово-механическое описание модели молекулы водорода
- •14.1.2 Основные характеристики химической связи
- •Валентный угол–это угол между двумя химическими связями.Он отражает геометрию молекулы.
- •14.1.3 Типы химических связей Ковалентная связь –это связь между двумя атомами за счет образования общей электронной пары.
- •14.2 Состав и строение молекул
- •15 Типы кристаллических решеток
- •16.1 Общая характеристика s-элементов первой и второй групп
- •16.2 Свойства воды
- •16.2.1 Строение молекулы воды
- •16.2.2 Физические свойства воды
- •16.2.3 Химические свойства воды
- •16.3 Жесткость воды
- •18 Комплексные соединения
- •18.1 Состав комплексных соединений
- •18.2 Реакции с участием комплексных соединений
- •19.8.1 Элементы триады железа
- •19.8.2 Платиновые металлы
- •20 Органические соединения
- •20.1 Углеводороды
- •20.2 Кислородсодержащие соединения
- •20.3 Амины и аминокислоты
- •21 Полимеры
- •21.1 Классификации полимеров
- •21.2 Полимеризационные полимеры
- •21.3 Поликонденсационные полимеры
- •21.4 Структура и состояние полимеров
- •22 Рабочие вещества низкотемпературной техники
- •22.2 Хладагенты органического происхождения
- •Список использованных источников
19.8.2 Платиновые металлы
К платиновым металлам относятся: рутений (Ru), родий (Rh), палладий (Рd), осмий (Оs), иридий (Ir) и платина (Рt). Они являются электронными аналогами cоответствующих элементов триады железа, но значительно уступают им в химической активности. Стандартные электродные потенциалы находятся в интервале +0,45 ÷ +1,2 В. Наименее активны из этих металлов иридий и платина. Проявляют валентности от 1 до 6. Наиболее устойчивые валентности: рутений – 4, родий – 3, палладий – 2, осмий – 6, иридий – 3 и платина – 4. Эти металлы относятся к редким металлам, встречаются в природе преимущественно в самородном состоянии. Окисляются кислородом, хлором и другими окислителями только при высокой температуре. Являются хорошими комплексообразователями.
Платина благодаря тугоплавкости и исключительной коррозионной стойкости используется для изготовления химической аппаратуры. Хорошо растворяет водород, особенно в мелкораздробленном состоянии.
Палладий способен поглощать огромное количество водорода (до 900 объемов на 1 объем металла).
Иридий отличается от платины очень высокой температурой плавления (2450 оС) и большей химической стойкостью. Из сплава (90 % платины и 10 % иридия) изготовлены международные эталоны метра и килограмма.
Часть третья. ОРГАНИЧЕСКАЯ ХИМИЯ
20 Органические соединения
Это соединения, основным элементом которых является углерод и сопутствующие ему элементы – водород, кислород, азот, сера, галогены. Органические соединения, в состав которых входят другие элементы периодической таблицы, называются элементоорганическими. Образование химических связей между атомами углерода и такое явление, как изомерия приводят к практически бесконечному многообразию данных соединений.
Классификация органических соединений, основанная на строении и составе углеводородных цепей, включает три ряда:
1) Ациклические – не содержат циклические структуры. В зависимости от числа связей между атомами углерода делятся на предельные и непредельные (этиленовые и ацетиленовые) углеводороды.
2) Карбоциклические – содержат циклические структуры из атомов углерода.
3) Гетероциклические – циклические структуры образованы не только углеродом, но и атомами других элементов.
По виду атомов, входящих в состав органических соединений, различают галогенпроизводные, кислородсодержащие, азотсодержащие, содержащие серу и другие производные углеводородов. Существуют соединения со смешанными функциональными группами: оксикислоты, аминокислоты и т.д.
Согласно теории химического строения, разработанной Бутлеровым в
1861 г., свойства соединений определяются качественным и количественным
составом, химическим строением и взаимным влиянием атомов в молекуле.
20.1 Углеводороды
Углеводороды – это соединения углерода с водородом. Составляют основу органических соединений. По количеству и характеру химических связей между атомами углерода они делятся на предельные и непредельные, алициклические и ароматические. По систематической номенклатуре (ИЮПАК) предельные углеводороды называются алканами. В таблице 20.1 приведены формулы первых пяти представителей предельных углеводородов.
Таблица 20.1 – Формулы и температуры фазовых переходы (при р = 1 атм) первых пяти представителей предельных углеводородов
|
Формула |
СН4 |
С2Н6 |
С3Н8 |
С4Н10 |
С4Н10 |
С5Н12 |
|
Название |
метан |
этан |
пропан |
бутан |
изобутан |
н-пентан |
|
T плавл., оС |
–182,5 |
–182,8 |
–187,6 |
–138,4 |
–159,6 |
–129,8 |
|
T кип., оС |
–161,5 |
–88,6 |
–42,1 |
–0,5 |
–11,7 |
+36,07 |
Формулы и названия следующих представителей класса предельных углеводородов: С6Н14 – гексан, С7Н16 – гептан, С8Н18 – октан, С9Н20 – нонан, С10Н22 – декан и т.д. Наиболее распространенным углеводородом является метан. Он составляет основу природного газа (до 97 %) и в значительном количестве содержится в попутном нефтяном газе.
Для органических соединений характерно такое явление, как изомерия. Изомеры – вещества, имеющие одинаковый состав, но различное строение. Первые три предельных углеводорода не имеют изомеров. Бутан существует в виде двух изомеров. С увеличением числа углеродных атомов в молекуле резко возрастает число изомеров. Изомерных пентанов – три, гексанов – пять, гептанов – девять, деканов – семьдесят пять и далее количество их нарастает в геометрической прогрессии. Изомеры отличаются по физическим и химическим свойствам. В частности, углеводороды нормального строения менее устойчивы к детонации, чем соответствующие им изомеры. Количественной характеристикой устойчивости к детонации горючих материалов является «октановое» число. В основе соответствующей шкалы октановое число н-гептана приняли равным 0, а изооктана – 100. Например, если горючий материал детонирует как смесь 70 % изооктана и 30 % н-гептана, то его октановое число равно 70.
Все предельные углеводороды химически относительно неактивны. Это связано с тем, что для реакций с их участием необходим разрыв химических связей С–Н или С–С, которые характеризуются высокой прочностью.
Наиболее важные реакции для них: окисление кислородом и крекинг. Предельные углеводороды горят с выделением большого количества тепла и могут быть использованы в качестве топлива. Например:
СН4 + 2О2 = СО2 + 2Н2О, Q = +879 кДж.
Смесь метана с воздухом взрывоопасна (особенно в соотношении 1:10). При последовательном окислении кислород алканов образуются следующие классы кислородсодержащих органических соединений:
спирты → альдегиды → карбоновые кислоты → углекислый газ.
Например, для метана:
метанол(СН3ОН) → метаналь(СН2О) → муравьиная кислота(НСООН) → СО2.
Из
других реакций следует отметить
хлорирование, заключающееся в
последовательном замещении
атомов водорода
на атомы хлора с образованием
галогенпроизводных. Например,
хлорирование метана:
СН4 + С12 → СН3С1 + НС1,
СН3С1 + С12 → СН2С12 + HCI и т. д. до СС14.
Крекинг – процесс расщепления углеводородов с длинными цепями на молекулы меньшей длины, происходящий в присутствии катализаторов (каталитический крекинг) или при нагревании предельных углеводородов до 500÷700 °С под давлением (термический крекинг). В качестве примера запишем возможную реакцию разложения бутана:
СН3–СН2–СН2–СН3 → СН3–СН3 + СН2=СН2.
Если между атомами углерода имеется двойная или тройная связь, то такие углеводороды называются непредельными.
Простейший непредельный углеводород с двойной связью – этилен С2Н4 или СН2 = СН2 – является родоначальником гомологического ряда этиленовых углеводородов:
С3Н6 – пропилен, С4Н8 – бутилен, С5Н10 – амилен и т.д.
Из углеводородов с двумя двойными связями отметим:
С4Н6 – бутадиен (дивинил) и C5H8 – изопрен, имеющие следующее строение:
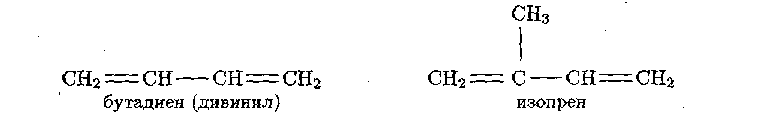
Простейший непредельный углеводород с тройной связью – ацетилен С2Н2 или СН≡СН – является родоначальником гомологического ряда ацетиленовых углеводородов.
По систематической номенклатуре углеводороды ряда этилена называют алкенами, с двумя двойными связями – алкадиенами, а ацетиленовые – алкинами.
Непредельные углеводороды в отличие от предельных содержат слабые π-связи, поэтому для них характерны реакции присоединения по двойным или тройным связям. Например,
СН2=СН2 +Вr2 → СН2 Вr–СН2Вr.
Этилен – бесцветный газ со слабым приятным запахом, довольно хорошо растворимый в воде. Его температура кипения –103,8 °С. Применяется для
производства полиэтилена.
Ацетилен – бесцветный газ с характерным слабым запахом; температура кипения –83,8 °С. При его сгорании выделяется большое количество теплоты. Температура пламени достигает 3150 °С, поэтому ацетилен в смеси с кислородом широко используют для сварки и резки металлов (автогенная сварка).
Циклические углеводороды
Примеры
предельных
циклических углеводородов:

По систематической номенклатуре предельные циклические углеводороды называются циклоалканами.
Представителями ароматических углеводородов являются бензол C6H6 и его гомологи: толуол (метилбензол) и этилбензол, имеющие следующие структурные формулы:

По систематической номенклатуре данные углеводороды называют аренами.
Для простоты написания бензольное ядро изображают упрощенно в виде шестиугольника, в котором символы С и Н, относящиеся к кольцу, не пишут: