
- •Содержание
- •Введение
- •1 Основные понятия и законы химии
- •1.1 Основные понятия химии
- •1.2 Основные законы химии
- •2 Основные классы неорганических соединений
- •2.1 Простые вещества
- •2.2 Сложные вещества
- •3 Растворы
- •3.1 Общие свойства растворов
- •3.1.2 Способы выражения состава растворов
- •3.1.3 Физико-химические процессы образования растворов
- •3.1.4 Экстракция
- •3.2 Растворы неэлектролитов
- •3.2.1 Законы Рауля
- •3.2.2 Осмос
- •3.3 Растворы электролитов
- •3.3.1 Электролитическая диссоциация
- •3.3.2 Сильные и слабые электролиты
- •3.4 PH водных растворов
- •4 Ионно-обменные реакции
- •4.1 Необратимые ионно-обменные реакции
- •4.2 Обратимые ионно-обменные реакции
- •5 Гидролиз солей
- •5.1 Различные случаи гидролиза
- •2) Гидролиз соли образованной сильным основанием и слабой кислотой
- •3) Гидролиз соли образованной слабым основанием и слабой кислотой
- •5.2 Константа гидролиза
- •5.3 Смещение равновесия при гидролизе
- •6. Окислительно-восстановительные реакции
- •6.1 Составление уравнений окислительно-восстановительных реакций
- •6.2 Прогнозирование окислительно-восстановительных свойств веществ по степеням окисления элементов
- •6.3 Основные типы окислительно-восстановительных реакций
- •6.4 Взаимодействие металлов с водой, кислотами и щелочами
- •7 Гальванические элементы
- •7.1 Принцип работы гальванического элемента
- •7.2 Водородный электрод сравнения. Электрохимический ряд
- •8 Электролиз
- •8.1 Электролиз расплавов
- •8.2 Электролиз водных растворов
- •8.3 Количественные расчёты в электролизе
- •8.4 Химические источники электрической энергии
- •9 Коррозия металлов
- •9.1 Виды и типы коррозии
- •9.2 Способы защиты металлов от коррозии
- •9.2.1 Изолирование металлов от внешней среды
- •9.2.2 Изменение состава коррозионной среды
- •9.2.3 Рациональное конструирование
- •9.2.4 Электрохимические способы защиты от коррозии
- •10 Термодинамика
- •10.1 Внутренняя энергия и энтальпия. Закон Гесса
- •Или через промежуточный продукт (со) в две реакции:
- •10.2 Энтропия
- •10.3 Энергия Гиббса
- •11 Химическая кинетика Химическая кинетика – учение о скоростях и механизмах протекания химических реакций.
- •11.1 Скорость реакции
- •Основные факторы, влияющие на скорость реакции:
- •Число частиц с энергией большей, чем Еа равно заштрихованной площади.
- •12.1.2 Модель атома по Бору
- •12.2 Современные представления о строении атома
- •13 Периодический закон и периодическая таблица д.И. Менделеева
- •14 Химическая связь и строение молекул
- •14.1 Химическая связь
- •14.1.1 Квантово-механическое описание модели молекулы водорода
- •14.1.2 Основные характеристики химической связи
- •Валентный угол–это угол между двумя химическими связями.Он отражает геометрию молекулы.
- •14.1.3 Типы химических связей Ковалентная связь –это связь между двумя атомами за счет образования общей электронной пары.
- •14.2 Состав и строение молекул
- •15 Типы кристаллических решеток
- •16.1 Общая характеристика s-элементов первой и второй групп
- •16.2 Свойства воды
- •16.2.1 Строение молекулы воды
- •16.2.2 Физические свойства воды
- •16.2.3 Химические свойства воды
- •16.3 Жесткость воды
- •18 Комплексные соединения
- •18.1 Состав комплексных соединений
- •18.2 Реакции с участием комплексных соединений
- •19.8.1 Элементы триады железа
- •19.8.2 Платиновые металлы
- •20 Органические соединения
- •20.1 Углеводороды
- •20.2 Кислородсодержащие соединения
- •20.3 Амины и аминокислоты
- •21 Полимеры
- •21.1 Классификации полимеров
- •21.2 Полимеризационные полимеры
- •21.3 Поликонденсационные полимеры
- •21.4 Структура и состояние полимеров
- •22 Рабочие вещества низкотемпературной техники
- •22.2 Хладагенты органического происхождения
- •Список использованных источников
16.2.3 Химические свойства воды
Вода является слабым электролитом
Н–ОН ↔ Н+ + ОН–, Кд1 = 1,8·10–16.
Образующийся ион водорода взаимодействует с молекулой воды с образованием иона гидроксония
Н+ + Н2О = Н3О+,
но для простоты записывают только ион водорода (Н+).
При растворении в воде основных классов неорганических соединений (кислот, оснований, солей) происходит их взаимодействие (гидратация) с образованием иногда относительно устойчивых соединений (кристаллогидратов), которые можно выделить из водного раствора.
Например: CuSО4·5Н2О, Nа2SО4·10Н2О, АlСl3·6Н2О, и др.
При растворении солей, образованных слабой кислотой или слабым основанием, протекает гидролиз. Например, гидролиз ацетата натрия:
СН3СООNа → Nа+ + СН3СОО–,
СН3СОО– + Н+ОН– ↔ СН3СООН + ОН–, рН > 7 (среда щелочная).
Если кислота и основание, образующие эти соли, не только слабые электролиты, но и малорастворимые или разлагающиеся с образованием
летучих продуктов, то гидролиз часто протекает необратимо. Например, совместный гидролиз хлорида алюминия и сульфида натрия:
2АlСІ3 + 3Na2S + 6НОН ↔ 2А1(ОН)3 + 3H2S + 6NaCl,
2Al3++ 6СІ– + 6Na+ + 3S2– + 6НОН ↔ 2А1(ОН)3 + 3H2S + 6Na+ + 6СІ–,
2Al3+ + 3S2– + 6НОН ↔ 2А1(ОН)3 + 3H2S.
Многие соединения не могут существовать в водном растворе вследствие полного разложения. Например,
(NH4) 2СО3 = 2NH3↑+ СO2↑ + Н2О.
Степени окисления элементов в молекуле воды имеют значения – Н+12О–2. Таким образом, за счет Н+ вода может проявлять окислительные свойства, а за счет О–2 – восстановительные. Окислительные и восстановительные свойства воды определяются значениями соответствующих окислительно-восстановительных потенциалов:
2Н2О + 2е = Н2 + 2ОН–, φ0 = –0,83 В,
2Н2О – 4е = О2 + 4Н+, φ0 = +1,23 В.
Вода может окислять только очень активные металлы. Например,
К + 2Н2О = Н2↑+ 2КОН.
Восстановительные свойства вода может проявлять только в реакции с фтором, как более электроотрицательным элементом, чем кислород.
Окисление и восстановление воды с образованием водорода и кислорода легко достигается при электролизе воды с инертным анодом.
Вода – термодинамически крайне устойчивое соединение. Однако при температуре выше 1000 оС начинает разлагаться по реакции 2Н2О = 2Н2 + О2, но даже при температуре 2000 оС степень термической диссоциации не превышает 2 %.
В заключение следует отметить, что ассоциаты жидкой воды содержат пустоты, которые могут заполняться молекулами таких газов, как Хе, Cl2, С2Н6 и др. Такие соединения называются соединениями включения, или клатратами. Клатраты при пониженных температурах от 0 до 24 оС выпадают в осадок в виде соединений состава: Хе·6Н2О, Cl2·8Н2О, С2Н6·6Н2О и др. Клатраты – малоустойчивые соединения, существующие только при низкой температуре. На практике они применяются для разделения смесей благородных газов, углеводородов и опреснения морской воды.
16.3 Жесткость воды
Вследствие высокой полярности вода является хорошим растворителем соединений с ионными и полярными химическими связями (кислот, оснований, солей). При прохождении через почву вода обогащается этими соединениями. Так как в почве преобладают соли кальция и магния, они составляют основу растворимых примесей природной воды.
Вода, содержащая ионы кальция и магния, называется жесткой. При продолжительном питании жесткой водой паровых котлов, теплообменников их стенки покрываются «накипью». Теплопроводность накипи значительно ниже теплопроводности металла, поэтому для поддержания постоянной теплопередачи необходимо повышать температуру нагрева, что соответственно приводит к увеличению расхода топлива. В производстве соков, напитков, сахара и других пищевых продуктов используется значительные количества воды, которая для улучшения качества готовой продукции в случае необходимости подвергается водоподготовке.
Общая жесткость воды характеризует суммарное содержание солей кальция, магния и других многовалентных тяжелых металлов.Общая жесткость включает постоянную и временную жесткости.
Постоянная жесткостьобусловлена наличием в воде солей кальция и магния с серной, хлороводородной и другими сильными кислотами.
Временная или карбонатная жесткость связана с содержанием в воде гидрокарбонатов кальция и магния. Она образуется при взаимодействии известняка с растворенным в воде углекислым газом:
СаСО3+ СО2 + Н2О = Са(НСО3)2.
Временной её называют потому, что она устраняется в процессе кипячения. Гидрокарбонаты термически нестойки и разлагаются с выделением
СО2 и образованием осадка (накипи):
Са(НСО3)2= СаСО3↓ + СО2↑ + Н2О,
Образующаяся при кипячении жесткой воды накипь растворяется, если в воде содержится растворенный углекислый газ. Таким образом, реакции разрушения и образования временной жесткости являются взаимно обратимыми и могут быть записаны в виде:
Са(НСО3)2 ↔ СаСО3↓+ СО2↑ + Н2О.
В основе количественной характеристики жесткости воды (Ж) лежит широко применяемая в аналитической химии молярная концентрация эквивалентов (нормальная концентрация), но количество солей кальция и магния выражают не в молях, а в миллимоль эквивалентах:
|
Ж =
|
(16.1) |
где n – число ммоль эквивалентов ионов кальция и магния,
V – объем воды в литрах.
Жесткость равна числу ммоль эквивалентов ионов кальция и магния, содержащихся в 1л воды.
Жесткость природной воды изменяется в широких пределах. Она различна для разных водоемов и изменяется в течение года (минимальна во время паводка). По величине жесткости воду условно делят на мягкую (до 4 ммоль экв./л), средней жесткости (4 ÷ 8 ммоль экв./л), жесткую (8 ÷ 12 ммоль экв./л) и очень жесткую (более 12 ммоль экв./л).
Водоподготовка зависит от качества исходной воды и назначения – для технических или пищевых целей. Для технических целей водоподготовка, как правило, включает операцию водоумягчения – удаления из воды ионов кальция и магния. При этом могут применяться различные способы обработки воды. Водоподготовка для пищевой промышленности включает операции освобождения от грубодисперсных и коллоидных примесей, ряда растворенных веществ и обеззараживания воды.
Наиболее распространенным способом обеззараживания питьевой воды
является хлорирование. Причина состоит в том, что хлорирование – наиболее экономичный и эффективный метод обеззараживания питьевой воды в сравнении с любыми другими известными методами. Все остальные методы обеззараживания воды, не исключая озонирование и действие ультрафиолета, не обеспечивают обеззараживающего последействия и, следовательно, требуют хлорирования на одной из стадий водоподготовки. Это правило не является исключением и для Беларуси, где имеющаяся система озонирования питьевой воды работает совместно с оборудованием для хлорирования.
Одним из основных нежелательных примесей природной воды является двухвалентное железо. Обезжелезивание воды проводят следующим образом. Вначале проводится аэрирование воды кислородом воздуха, что переводит двухвалентное железо в нерастворимый гидроксид трехвалентного железа по реакции
4Fe+2 + O2 + 8HCO3– + 2H2O = 4Fe(OH)3↓+ 8CO2,
а затем образующийся осадок гидроксида железа(III) удаляют.
Для водоумягчения применяют химические методы: осаждения и ионного обмена.
Методом осаждения катионы Са2+ и Mg2+ переводят в малорастворимые соединения, выпадающие в осадок. Это достигается применением в качестве осадителя соды или гашеной извести:
СаСІ2 + Nа2СО3 = СаСО3↓ + 2NаСІ,
Са(НСО3)2 + Са(ОН)2 = 2СаСО3↓ + 2Н2О.
При добавке Са(ОН)2 устраняется только карбонатная жесткость. Из уравнения реакции видно, что Са(ОН)2 необходимо добавлять в стехиометрическом количестве. При недостатке Са(ОН)2 будет остаточная жесткость за счет непрореагировавшего Са(НСО3)2, а при избытке – за счет непрореагировавшего Са(ОН)2.
Методом ионного обмена воду пропускают через слой катионита. При этом катионы Са2+ и Mg2+, находящиеся в воде, обмениваются на катионы Na+, содержащиеся в катионите. При последовательном пропускании воды через катионит, содержащий в обменной форме катионы водорода (Н-катионит), и анионит, содержащий в обменной форме гидроксид-ионы (ОН-анионит), вода освобождается как от катионов металлов, так и от анионов солей, что приводит к полному удалению солей из воды. Такая вода является деионизированной. Не следует путать с дистиллированной водой, которую получают методом перегонки.
Когда обменная емкость ионита заканчивается, он утрачивает способность умягчать воду. Для регенерации катионита через него пропускают концентрированный раствор NaCl, Na2SO4, HCl или H2SO4, при этом ионы Са2+ и Mg2+ замещаются на ионы Nа+ или H+ . Для регенерации анионита через него пропускают раствор щелочи или соды (при гидролизе имеет щелочную среду), что приводит к замещению анионов на группы ОН–.
Для умягчения воды применяются также физические методы: электродиализ, магнитно-ионизационный метод, магнитную и ультразвуковую обработку воды.
Метод электродиализа основан на движении катионов и анионов к противоположно заряженным электродам, подключенным к сети постоянного тока. Катионы и анионы задерживаются у электродов и отделяются от воды, выходящей из аппарата водоочистки.
Магнитно-ионизационный метод так же, как и метод электродиализа, использует явление направленного движения ионов, но уже под действием магнитного поля.
Магнитная обработка воды заключается в пропускании воды через систему магнитных полей противоположной направленности. В результате этого происходит уменьшение степени гидратации растворенных веществ и объединение их в более крупные частицы, которые выпадают в осадок.
Ультразвуковая обработка воды также приводит к укрупнению частиц
осадка.
17 р-Элементы
17.1 р-Элементы III группы
В III главную подгруппу входят элементы: бор (В), алюминий (Аl), галлий (Gа), индий (In) и таллий (Тl). Электронная формула валентной зоны данных атомов в невозбуждённом состоянии – ns2nр1, то есть они содержат в наружном электронном слое три электрона. Данные элементы в своих соединениях проявляют валентность III, и только таллий в своих соединениях может быть одно- или трёхвалентен. Для таллия более устойчива валентность 1, поэтому соединения трехвалентного таллия обладают сильными окислительными свойствами (φ0 = +1,25 В).
Бор неметалл, а остальные элементы являются металлами, при этом в ряду Al–Ga–In–Т1 металлические свойства простых веществ усиливаются. Оксид бора проявляет кислотные свойства, оксиды алюминия, галлия и индия – амфотерные, а оксиды таллия – основные.
Бор представляет собой кристаллическое вещество чёрного цвета, по
твёрдости уступающее лишь алмазу.
Бор применяется в металлургии как добавка к стали и некоторым цветным сплавам. Применяется также насыщение поверхности стальных изделий бором (борирование), значительно повышающее твердость и коррозионную стойкость поверхностного слоя. Борирование проводится при повышенной температуре бором или его соединениями в атмосфере водорода. При высокой температуре бор взаимодействует со многими металлами с образованием боридов, являющихся твердыми и коррозионно-стойкими соединениями и сохраняющими эти свойства при высоких температурах, что позволяет их использовать в ракетной технике
При нагревании бора до температуры 700 оС он сгорает с образованием оксида бора и выделением большого количества тепла:
2В(к)
+ 3∕2О2(г)
=
В2О3(г),
 H0298
= –1270,43 кДж/моль.
H0298
= –1270,43 кДж/моль.
Оксид бора растворяется в воде с образованием ортоборной кислоты:
В2О3 + 3Н2О = 2Н3ВО3.
Особенностью борной кислоты является то, что при её нейтрализации раствором щёлочи образуется соль не ортоборной, а тетраборной кислоты (Н2В4О7):
4Н3ВО3 + 2NаОН = Nа2В4О7 + 7Н2О.
Соли тетраборной кислоты называются тетрабораты. Десятиводный кристаллогидрат тетрабората натрия Nа2В4О7·10Н2О называется бура. Применяется при сварке, резании и паянии металлов, в производстве легкоплавкой глазури, для эмалирования различных изделий.
При накаливании смеси бора с углем образуется очень тугоплавкое и твердое вещество – карбид бора (В4С).
С азотом бор образует нитрид, существующий в алмазоподобной или графитоподобной модификациях. Алмазоподобная кристаллическая модификация по твердости немного уступает алмазу, но значительно превосходит его по термостойкости. Выдерживает нагревание на воздухе до 2000 оС, в то время как алмаз сгорает уже при температуре 800 оС. Графитоподобная кристаллическая модификация, как и графит, является высококачественным смазочным материалом, но в отличие от графита бесцветна и неэлектропроводна.
При действии соляной кислоты на борид магния образуются бороводороды (бораны), летучие жидкости с неприятным запахом и легко воспламеняющиеся на воздухе.
Алюминий – самый распространенный на земле металл. В природе встречается преимущественно в виде алюмосиликатов.
В свободном состоянии это серебристо-белый металл, покрытый прочной оксидной плёнкой, которая защищает его от дальнейшего окисления.
В кислотах и щелочах оксидная плёнка растворяется:
Аl2О3 + 6НСl = 2А1Сl3 + 3Н2О,
Аl2О3 + 2КОН + 3Н2О = 2К[А1(ОН)4] (в растворе).
Лишённый оксидной пленки алюминий вытесняет водород даже из воды:
2А10 + 6Н+12О = 2 А1+3(ОН)3 + 3Н02
Аl0 – 3е = Аl+3 –3 · 2 = –6е,
2Н+1 + 2е = Н2 +2 · 3 = +6е.
В исходном состоянии толщина оксидной пленки составляет примерно
25 мкм, что не обеспечивает необходимой коррозионной стойкости, поэтому на практике посредством оксидирования доводят толщину оксидной пленки до 250 мкм.
Алюминий в порошкообразном состоянии или в виде металлической
фольги сгорает на воздухе с выделением большого количества тепла:
2А1 + 3∕2О2 = А12О3, ΔН0298 = –1676 кДж ∕моль.
Высокая теплота образования оксида алюминия применяется на практике (алюмотермия) для сварки железных изделий по реакции
2А1 + Fе2О3 = А12О3 + 2Fе, ΔН0298 = –841,7 кДж.
Данного количества теплоты достаточно для плавления образовавшегося железа и поверхностных слоев свариваемых железных изделий.
В виде чистого металла благодаря легкости и относительно высокой электропроводности алюминий применяется для изготовления проводов. В пищевой промышленности в виде фольги используется как упаковка.
Сплавы на основе алюминия по широте применения занимают второе место после стали и чугуна. Данные сплавы (дюралюмин, силумин и др.) характеризуются легкостью, прочностью, коррозионной стойкостью, простотой получения и обработки и относительной дешевизной.
Из соединений алюминия следует отметить:
Аl2(SО4)3 сульфат алюминия – применяется для очистки воды,
К[А1 (SО4)2]·12Н2О алюмокалиевые квасцы – применяются для дубления кож и в красильном деле.
Индий, галлий и таллий в свободном состоянии представляют собой серебристо-белые металлы с низкими температурами плавления, устойчивые к окислению кислородом воздуха. Воду не разлагают. По химическим свойствам галлий и индий близки к алюминию.
Галлий применяется в высокотемпературных термометрах благодаря большому температурному диапазону жидкого состояния (от +29,8 до 2205 оС) и в сплавах с золотом в ювелирном и зубоврачебном деле.
Индий применяется вместо серебра для покрытия рефлекторов, для покрытия вкладышей подшипников и в легкоплавких предохранителях.
Таллий находит небольшое по объёму, но разнообразное применение. Он компонент многих свинцовых сплавов.
17.2 р-Элементы IV группы
В главную подгруппу IV группы входят: углерод (С), кремний (Si), германий (Gе), олово (Sn) и свинец (Рb).
Общая электронная формула валентной зоны данных элементов имеет вид ns2nр2, а при переходе одного электрона с s- на р-подуровень – ns1nр3 (возбуждённое состояние). Таким образом, элементы рассматриваемой подгруппы могут проявлять валентности 2 и 4.
При переходе от углерода к свинцу радиусы атомов увеличиваются, что приводит к усилению металлических свойств, которые проявляются уже у германия.
На примере р-элементов IV группы в таблицах 17.1 и 17.2 приведены формулы основных классов неорганических соединений для данных элементов.
Из таблиц видно, что данные элементы являются аналогами и соответственно образуют основные классы неорганических соединений (оксиды, кислоты, основания и соли) одинакового состава. При увеличении порядкового номера и повышении валентности элемента основные свойства ослабевают, а кислотные
нарастают. В двухвалентном состоянии элементы обладают окислительно-восстановительной двойственностью, а в четырехвалентном состоянии – только
окислительными свойствами. На примере свинца приведены названия соответствующих соединений.
Таблица 17.1– Формулы оксидов и гидроксидов р-элементов IV группы
|
Оксиды |
Гидроксиды |
| |||||||||||||
|
Степени окисления |
Степени окисления | ||||||||||||||
|
+2 |
+4 |
+2 |
+4 |
| |||||||||||
|
Кислота |
Основание |
Кислота |
Основание |
|
основание | ||||||||||
|
СО |
СО2 |
нет |
нет |
Н2СО3 |
нет |
нет | |||||||||
|
SiО |
SiО2 |
нет |
нет |
Н2SiО3 |
нет |
нет | |||||||||
|
GеО |
GеО2 |
Н2GеО2 |
Gе(ОН)2 |
Н2GеО3 |
Gе(ОН)4 |
Gе(ОН)4 | |||||||||
|
SnО |
SnО2 |
Н2SnО2 |
Sn(ОН)2 |
Н2SnО3 |
Sn(ОН)4 |
Sn(ОН)4 | |||||||||
|
РbО оксид свинца(II) |
РbО2 оксид свинца(IV) |
Н2РbО2 свинцовистая кислота |
Рb(ОН)2 гидроксид свинца(II) |
Н2РbО3 свинцовая кислота |
Рb(ОН)4 гидроксид свинца(IV) |
Рb(ОН)4 | |||||||||
|
|
|
|
| ||||||||||||
|
|
| ||||||||||||||
|
Таблица 17.2 – Формулы солей р-элементов IV группы |
| ||||||||||||||
|
Степени окисления | |||
|
+2 |
+4 | ||
|
нет |
нет |
К 2СО3 |
нет |
|
нет |
нет |
К 2SiО3 |
нет |
|
К2GеО2 |
GеSО4 |
К 2GеО3 |
Gе(SО4)2 |
|
К 2SnО2 |
Sn SО4 |
К 2SnО3 |
Sn(SО4)2 |
|
К2РbО2 плюмбит калия |
РbSО4 сульфат свинца(II) |
К 2РbО3 плюмбат калия |
Рb(SО4)2 сульфат свинца(IV) |
Углерод образует ряд аллотропных модификаций, из которых наиболее известны алмаз и графит.
Алмаз – самое твердое вещество, встречающееся в природе. Причина прочности алмаза заключается в атомной кристаллической решетке. В кристалле алмаза каждый атом углерода связан с четырьмя соседними атомами углерода посредством прочных химических связей. Несмотря на твердость, алмаз является хрупким веществом. Не проводит электрический ток. При сильном нагреве без доступа воздуха превращается в графит. Искусственный алмаз получают из графита при давлении примерно 105 атмосфер и температуре около 3000 оС.
Графит – материал темно-серого цвета с металлическим блеском. Имеет слоистую структуру. Связи между отдельными слоями сравнительно слабые и легко перемещаются друг относительно друга, что делает его хорошим смазочным материалом (графитовая смазка). Проводит электрический ток.
«Аморфный» углерод (уголь), представляющий собой мелкокристаллический графит. Благодаря большой активной поверхности обладает высокой адсорбционной способностью.
Углерод химически довольно инертен и проявляет химическую активность лишь при высоких температурах. При прокаливании в кислороде сгорает с образованием углекислого газа (СО2). Используется в металлургии для восстановления металлов из руд:
Fе2О3 + 3С = 2Fе + 3СO.
При недостатке кислорода углерод сгорает до оксида углерода(II) – угарный газ. Это бесцветный ядовитый газ, при попадании в организм человека замещает кислород в молекуле гемоглобина.
При ультрафиолетовом облучении или в присутствии катализатора (активированный уголь) оксид углерода (II) соединяется с хлором, образуя чрезвычайно ядовитый газ фосген:
СО + С12 = СОС12.
Оксид углерода (II) может соединяться со многими металлами с образованием карбонилов металлов:
Fe + 5СО = Fe(CO)5 – пентакарбонил железа,
Ni + 4СО = Ni(CO)4 – тетракарбонил никеля.
Карбонилы металлов ядовиты. При высокой температуре они разлагаются с выделением высокочистых металлов.
Оксид углерода(IV) – легко сжижающийся под давлением бесцветный газ. Твёрдая углекислота при атмосферном давлении и температуре –78,5 оС без плавления переходит в газообразное состояние (сублимация). СО2 – ангидрид угольной кислоты.
Н2СО3 – слабая, неустойчивая кислота:
Н2СО3 ↔ Н2О + СО2↑.
Диссоциирует по типу слабого электролита:
Н2СО3 ↔ Н+ + НСО3–, К1 = 4,5·10–7 ,
НСО3– ↔ Н+ + СО32–, К2 = 4,7·10–11.
Угольная кислота образует: средние соли (карбонаты) и кислые (гидрокарбонаты). Например: Nа2СО3 и NаНСО3.
Карбонаты и гидрокарбонаты термически нестойки:
СаСОз = СаО + СО2↑,
Са(НСО3)2 = СаСО3↓ +СО2↑+ Н2О.
Карбонат натрия (кальцинированная сода) – является одним из главных продуктов химической промышленности. В водном растворе он гидролизуется по реакции
Nа2СО3 → 2Nа+ + СО32–,
СО32– + Н+–ОН– ↔ НСО3– + ОН–.
Гидрокарбонат натрия (питьевая сода) – широко используется в пищевой промышленности. Вследствие гидролиза раствор также имеет щелочную среду
NаНСО3 → Nа+ + НСО3–,
НСО3– + Н+–ОН– ↔ Н2СО3 + ОН–.
Кальцинированная и питьевая сода разлагаются под действием кислот:
Nа2СО3 + 2НСl → 2NаСl + СО2↑ + Н2О,
2Nа+ + СО32– + 2Н+ + 2Сl– → 2Nа+ + 2Сl– + СО2↑ + Н2О,
СО32– + 2Н+ → СО2↑ + Н2О;
NаНСО3 + СН3СООН ↔ СН3СООNа + СО2↑ + Н2О,
Nа+ + НСО3– + СН3СООН ↔ СН3СОО– + Nа+ + СО2↑ + Н2О,
НСО3– + СН3СООН ↔ СН3СОО– + СО2↑ + Н2О.
Соединения углерода с металлами или другими менее электроотрицательными элементами называются карбидами. Карбид кальция при взаимодействии с водой разлагается с образованием ацетилена:
СаС2 + 2НОН = Са(ОН)2 + С2Н2.
Синильная кислота (НСN) и её соли чрезвычайно ядовиты.
Карбамид (СО(NН2)2) мочевина – используется в сельском хозяйстве как азотное удобрение и добавка к корму животных.
Кремний – один из наиболее распространённых в земной коре элементов. В природе кремний встречается в виде SiО2 – диоксида кремния (кремнезём, песок, кварц) или в виде различных алюмосиликатов, например, каолина (А12О3·2SiО2·2Н2О), составляющего основу различных глин.
Чистый кремний – кристаллическое вещество со стальным блеском. Область применения – радиоэлектроника (полупроводниковая техника).
Кремний энергично взаимодействует с растворами щелочей с образованием силикатов и выделением водорода:
Si + 2КОН + Н2О = К2SiО3 + 2Н2↑.
Оксид кремния(IV) – кислотный оксид, непосредственно с водой не взаимодействует. Ему соответствуют слабые малорастворимые в воде кремниевые кислоты. Из солей кремниевых кислот (силикатов) растворимы лишь силикаты калия и натрия (жидкое стекло). Диоксид кремния растворяется в плавиковой кислоте:
SiО2 + 4НF = SiF4↑+ 2Н2О.
В ряду Gе–Sn–Рb наблюдается усиление металлических свойств. Данные элементы проявляют в своих соединениях степени окисления +2 и +4.
При движении в главных подгруппах сверху вниз возрастает устойчивость более низкой степени окисления. Для свинца более устойчива степень окисления +2, поэтому соединения в степени окисления +4 обладают сильными окислительными свойствами:
РbО2 + 4НСl = РbСl4 + 2Н2О,
РbСl4 = РbСl2 + Сl2↑.
Как отмечено ранее, данные металлы являются амфотерными, т.е. взаимодействуют с кислотами и щелочами:
Sn + 4Н2SО4 + 2Н2О = Sn(SО4) 2 + 2SО2↑ + 6H2О,
Sn + 2КОН + 2Н2О = К2[Sn(ОН)4] + H2↑.
Взаимодействие свинца с разбавленными Н2SО4 и НС1 затруднено из-за образования на его поверхности малорастворимых РbSО4 и РbС12.
Германий обладает полупроводниковыми свойствами и на этом основано его основное применение.
Олово очень пластично и легко прокатывается в тонкие листы, называемые оловянной фольгой или станиолем. В пищевой промышленности применяют луженое железо (покрытое оловом).
Применение свинца разнообразно: пластины аккумуляторов, аппаратура на сернокислотных заводах, боеприпасы и дробь, припой, сплав для подшипников и типографский сплав (гарт).
17.3 р-Элементы V группы
В главную подгруппу V группы входят элементы: азот (N), фосфор (Р), мышьяк (Аs), сурьма (Sb) и висмут (Вi). На внешнем энергетическом уровне атомов этих элементов находятся по пять электронов. Общая электронная формула валентной зоны атомов имеет вид ns2np3. В отличие от остальных элементов максимальная валентность азота равна четырем (три связи могут быть образованы по обменному механизму и одна – по донорно-акцепторному).
Основные степени окисления данных элементов –3, 0, +3 и +5. При этом для азота возможны все степени окисления: –3, –2, –1, 0, +1, +2, +3, +4, +5. Для висмута наиболее устойчивая степень окисления +3, поэтому соединения Вi+5 обладают сильными окислительными свойствами.
Азот – газ без цвета и запаха, плохо растворимый в воде. Молекула азота двухатомна (N2). Азот – главная составная часть воздуха (78 % по объёму). В промышленности азот получают ректификацией жидкого воздуха. Молекула азота (N≡N) является практически инертным веществом, так как атомы азота связаны посредством трех прочных химических связей. Молекула азота распадается на атомы при температуре 3000 оС примерно на 0,1 %.
Азот при обычной температуре реагирует только с литием. С кислородом начинает реагировать при температуре 3000÷4000 оС. Вследствие превращения в природе соединений азота преимущественно в молекулярный азот, происходит обеднение почвы соединениями азота. Эта проблема «связанного азота» была решена посредством синтеза аммиака:
N2 + 3Н2 = 2NН3.
Аммиак – бесцветный газ с резким запахом. Температура кипения при атмосферном давлении составляет –33,4 °С. Благодаря хорошим теплофизическим свойствам широко используется в холодильной технике.
Аммиак хорошо растворяется в воде (34 % при температуре 20 оС). Водный раствор аммиака называют нашатырным спиртом. Высокая растворимость аммиака является следствием его взаимодействия с водой с образованием гидроксида аммония NH3 + НОН ↔ NH4OH.
Гидроксид аммония - слабое основание
NH4OH ↔ NH4+ + OH– , К = 1,8∙10–5.
Аммиак взаимодействует с кислотами с образованием солей аммония:
NH3 + HCl → NH4CI,
2NH3 + H2SO4 → (NH4)2SO4.
Аммиак образует ряд комплексных соединений – аммиакатов. Например,
СuSО4 + 4NН3 = [Сu(NН3)4]SО4.
Соли аммония термически неустойчивы и при нагревании разлагаются, при этом возможны 2 типа разложения:
1) Без изменения степеней окисления
NH4CI → NH3 + HCl.
2) С изменением степеней окисления, как внутримолекулярная окислительно-восстановительная реакция
NH4NO2 → N2↑ + 2Н2O (способ получения N2 в лаборатории).
В атмосфере кислорода аммиак горит:
4NH3 + 3О2 → 2N2 + 6Н2O.
Для получения азотной кислоты аммиак окисляют в присутствии катализатора до NO по реакции
4NH3 + 5O2 → 4NO + 6Н2O.
Из NO окислением получают NО2, а затем азотную кислоту:
4NО2 + O2 + 2H2O → 4НNO3.
Азот образует следующие оксиды:
1) N2О и NO – несолеобразующие оксиды;
2) N2О3 и N2О5– кислотные оксиды соответственно азотистой и азотной кислот;
3) NО2(N2О4) – смешанный оксид азотистой и азотной кислот.
Азотистая кислота НNО2 – слабая кислота
НNО2 ↔ H+ + NO2–, К = 4·10–4.
Азотистая кислота и её соли (нитриты) проявляют окислительно-восстановительную двойственность, так как азот находится в промежуточной
степени окисления +3.
Азотная кислота НNО3 – сильная кислота
НNО3 → H+ + NO3–.
Проявляет высокие окислительные свойства. Не реагирует только с Аu и металлами платиновой группы (за исключением Оs). Более сильными окислительными свойствами обладает смесь НNО3 и НС1 (1:3). Данную смесь называют «царской водкой», так как она способна растворять золото:
Аu + НNО3 + 4НС1 = Н[АuСl4] + NО + 2Н2О.
Концентрированная НNО3 пассивирует Аl, Fе, Со, Ni, Сr и нержавеющие стали.
Степень восстановления азотной кислоты при взаимодействии её с металлами зависит от активности металла и концентрации кислоты:
Сu + 4НNО3 (конц.) = Сu(NО3)2 + 2NO2 + 2Н2О,
3Сu + 8НNО3 (разб.) = 3Сu(NО3)2 + 2NО + 4Н2О,
4Мg + 10НNО3 (очень разб.) = 4Мg(NО3)2 + NН4NО3 + 3Н2О.
Из приведенных реакций следует, чем активней металл и более разбавлена азотная кислота, тем в большей степени она восстанавливается. При этом водород практически не выделяется.
Соли азотной кислоты (нитраты) хорошо растворимы в воде. Наиболее важное практическое значение имеют нитраты натрия, калия, аммония и кальция, которые называют селитрами. Важна биологическая роль азота, так как он входит в состав белковых молекул.
Фосфор вследствие лёгкой окисляемости не встречается в природе в свободном состоянии. Наиболее важным природным соединением фосфора является минерал фосфорит Са3(РО4)2.
Фосфор образует несколько аллотропных модификаций: белый, красный, черный и др.
Белый фосфор – очень сильный яд, даже малые дозы его смертельны.
Красный фосфор не ядовит, так как имеет полимерную структуру. При нагревании красный фосфор сублимируется, а при охлаждении паров получается белый фосфор.
Чёрный фосфор образуется при нагревании белого фосфора без доступа воздуха при очень высоком давлении. Внешне чёрный фосфор похож на гра–
фит и обладает полупроводниковыми свойствами.
Фосфор непосредственно взаимодействует с многими веществами: кислородом, галогенами, активными металлами.
При сгорании фосфора в кислороде или на воздухе 4Р + 5О2 ↔ 2Р2О5
образуется оксид фосфора(V) – белое твёрдое вещество, обладающее сильными водоотнимающими свойствами. Р2О5 соответствует Н3РО4 – слабая трёхосновная кислота.
Известны также следующие слабые кислоты фосфора:
1) фосфористая(Н3РО3) – двухосновная,
2) фосфорноватистая(Н3РО2) – одноосновная.
Соли фосфорной кислоты применяются в сельском хозяйстве в качестве минеральных удобрений.
Мышьяк и все его соединения – сильные яды! Применяется в сельском хозяйстве в качестве инсектицида.
Сурьма – серебристо-белое вещество с металлическим блеском. От металлов сурьма отличается хрупкостью и низкой электропроводностью. Сурьму вводят в некоторые сплавы (гарт) для придания им твердости. Соединения сурьмы сходны с соединениями мышьяка.
Висмут в свободном состоянии – розово-белый металл. В электрохимическом ряду располагается после водорода. В концентрированной азотной кислоте пассивируется. Соединения висмута (+5) обладают сильными окислительными свойствами.
Металлический висмут используется, главным образом, в ядерной энергетике в качестве теплоносителя. Соединения висмута (+3) применяются в медицине и ветеринарии.
17.4 р-Элементы VI группы
К р-элементам VI группы относятся кислород (О), сера (S), селен (Sе), теллур (Тe), полоний (Ро).
Общая электронная формула валентной зоны атомов имеет вид ns2np4, из которой следует, что на внешнем электронном слое атомов рассматриваемых элементов находится шесть электронов и они могут проявлять четные валентности 2, 4, 6. Так как у атома кислорода отсутствует d-подуровень, поэтому возбужденные состояния невозможны и валентность кислорода равна только 2.
Все элементы данной подгруппы, за исключением полония, неметаллы.
Кислород является самым распространённым элементом земной коры. Молекула кислорода двухатомна (О2). При обычных условиях представляет собой газ без цвета и запаха, плохо растворимый в воде. В атмосфере Земли содержится 21 % (по объёму) кислорода. В природных соединениях кислород встречается в виде оксидов (Н2О, SiО2) и солей кислородных кислот. Промышленный способ получения кислорода – ректификация жидкого воздуха. Воздух, азот и кислород хранят в жидком состоянии в сосудах Дьюара.
Кислород играет важную роль в природе. Он участвует в жизненно важном процессе – дыхании. Применение его разнообразно: производство серной и азотной кислот, выплавка металлов и др.
Аллотропной модификацией кислорода является озон (O3). Озон – один из сильнейших окислителей; по окислительной активности он уступает только фтору. Он окисляет все металлы, кроме золота и платиновых металлов, а также большинство неметаллов. В стратосфере Земли находится озоновый слой, поглощающий основную часть ультрафиолетового излучения.
Для обнаружения озона применяют следующую реакцию:
2КI + О3 + Н2О = I2 + 2КОН + О2.
Важным соединением кислорода является Н2О2 (Н–О–О–Н) – пероксид водорода.
Атомы кислорода в Н2О2 находятся в промежуточной степени окисления –1 и поэтому могут проявлять как окислительные, так и восстановительные
свойства. Например:
1) Н2О2 + 2КI = I2 + 2КОН
2О–1 + 2 е = 2О–2, 2I– – 2е = I2;
2) 5Н2О2 + 2КМnО4 + 3Н2SО4 = 5О2 + 2МnSО4 + К2SО4 + 8Н2О
2О–1 – 2е = О2, Мn+7 + 5е = Мn+2.
Сера существует в нескольких аллотропных модификациях: ромбическая, моноклинная, пластическая. При нормальных условиях сера – твёрдое жёлтое вещество, нерастворимое в воде, но хорошо растворимое в органических растворителях.
Сера со многими металлами (Zn, Al, Fe, Сu, щелочные и щелочноземельные металлы) взаимодействует непосредственно. Например,
2Аl + 3S → Al2S3.
При высокой температуре сера взаимодействует с водородом с образованием сероводорода (H2S) – бесцветный газ с характерным запахом (тухлых яиц)
Н2 + S → Н2S.
Сероводород очень ядовит и способен вызвать тяжёлые отравления.
Сероводородная кислота является слабой двухосновной кислотой:
Н2S ↔ H+ + НS–, К1 = 6∙10–8;
НS– ↔ H+ + S2–, К2 = 1∙10–14 .
Сероводородная кислота образует соли – сульфиды, многие из которых характеризуются низкой растворимостью. Например:
CuSO4 + H2S ↔ CuS↓ + H2SO4,
Cu2+ + SO42– + H2S ↔ CuS↓ + 2H+ + SO42–,
Cu2+ + H2S ↔ CuS↓ + 2H+.
При поджигании на воздухе сероводород горит голубоватым пламенем
2H2S + 3O2 → 2SO2 + 2Н2O (в избытке кислорода).
Оксид серы (IV) образуется при горении серы на воздухе. Он хорошо растворяется в воде с образованием сернистой кислоты:
SO2 + Н2O ↔ H2SO3.
Сернистая кислота – слабая двухосновная кислота. Она являются хорошими восстановителем и окисляется до серной кислоты:
2H2SO3 + O2 → 2H2SO4.
При высокой температуре в присутствии катализатора (V2O5, сплавы на основе платины) диоксид серы окисляется кислородом до триоксида, который
в свою очередь используется для получения серной кислоты
SO3 + Н2O → Н2SО4.
Н2SO4 – сильная двухосновная кислота. В разбавленных водных растворах она диссоциирует практически полностью Н2SO4 → 2Н+ + SO42–. При растворении концентрированной серной кислоты в воде выделяется большое количество тепла.
Концентрированная серная кислота, особенно горячая, – энергичный окислитель. Она восстанавливается металлами до SO2, S или Н2S. Чем активней металл, тем более глубоко восстанавливается кислота:
Сu + 2Н2SO4 (конц.) → СuSO4 + SO2↑ + 2Н2O,
3Zn + 4Н2SO4(конц.) → 3ZnSО4 + S↓ + 4Н2O,
Соли серной кислоты, сульфаты, как правило, хорошо растворимы. Из водных растворов выделяются в виде кристаллогидратов, называемых купоросами: СuSO4·5Н2O, FeSO4·7Н2O и др. Серная кислота образует также двойные соли – квасцы, существующие в кристаллическом состоянии:
К2SO4·Аl2(SO4)3·24Н2O или КАl(SO4)2·12Н2O и др.
В ряду Н2O – Н2S − Н2Sе − Н2Те с увеличением молекулярных масс должно наблюдаться повышение температур кипения. Как видно из рисунка 17.1, данная зависимость соблюдается, за исключением Н2О.
Ткип.
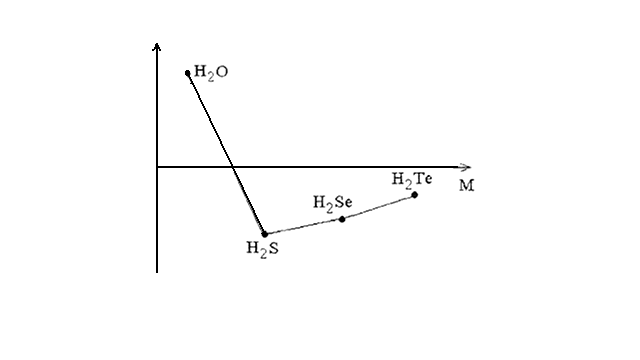
Рисунок 17.1 – Зависимость температур кипения водородных соединений р-элементов VI группы от молекулярной массы соединения
Ранее было показано, что аномально высокая температура кипения Н2О является следствием образования водородных связей между отдельными молекулами воды.
Селен по свойствам близок к сере. Селеновая кислота (Н2SеO4) также является сильной кислотой. Селен является важным биологическим микроэлементом.
Теллур образует очень слабую ортотеллуровою кислоту Н6ТеO6. Селен и теллур – полупроводники. Теллур служит легирующей добавкой к свинцу, улучшая его механические свойства. Все соединения селена и теллура ядовиты.
17.5 р-Элементы VII группы
К p-элементам VII группы относятся – фтор (F), хлор (Сl), бром (Вr), йод (I) и астат (Аt). Данные элементы называют галогенами (рождающие соли). Все элементы данной подгруппы – неметаллы.
Общая электронная формула валентной зоны атомов имеет вид ns2np5, из которой следует, что на внешнем электронном слое атомов рассматриваемых элементов находится семь электронов и они могут проявлять нечетные валентности 1, 3, 5, 7. У атома фтора отсутствует d-подуровень, поэтому возбужденные состояния отсутствуют и валентность фтора равна только 1.
Фтор – самый электроотрицательный элемент в периодической таблице и соответственно в соединениях с другими элементами проявляет только отрицательную степень окисления –1. Остальные галогены могут иметь степени окисления –1, 0, +1, +3, +5, +7. Каждый галоген в своем периоде является наиболее сильным окислителем. С повышением порядкового номера элементов в ряду F, С1, Br, Iи At увеличиваются радиусы атомов и уменьшается окислительная активность элементов.
Молекулы простых веществ двухатомны: F2, С12, Br2, I2. При нормальных условиях фтор – газ бледно-жёлтого цвета, хлор – газ жёлто-зелёного цвета, бром – красно-бурая жидкость, йод – кристаллическое вещество темно-фиолетового цвета. Все галогены обладают очень резким запахом. Вдыхание их приводит к тяжелым отравлениям. При нагревании йод сублимируется (возгоняется), превращаясь в пар фиолетового цвета; при охлаждении пары йода кристаллизуются, минуя жидкое состояние.
Галогены слабо растворимы в воде, но значительно лучше в органических растворителях. Фтор нельзя растворить в воде, так как он разлагает её:
2F2 + 2Н2O = 4НF + О2.
При растворении хлора в воде происходит его частичное самоокисление-самовосстановление по реакции
С12 + Н2O ↔ НС1+ НС1О.
Полученный раствор называется хлорной водой. Он обладает сильными кислотными и окислительными свойствами и применяется для обеззараживания питьевой воды.
Галогены вступают во взаимодействие с многими простыми веществами, проявляя свойства окислителей. Фтор с многими неметаллами реагирует со взрывом:
Н2 + F2 → 2HF,
Si + 2F2 → SiF4,
S + 3F2 → SF6.
В атмосфере фтора горят такие устойчивые вещества, как стекло в виде ваты и вода:
SiО2 + 2F2 → SiF4 + О2,
2Н2О + 2F2 → 4HF + О2.
Фтор непосредственно не взаимодействует только с кислородом, азотом, гелием, неоном и аргоном.
В атмосфере хлора сгорают многие металлы, образуя хлориды:
2Na + С12 → 2NaCl (яркая вспышка);
Сu + С12 → СuС12,
2Fe + 3Сl2 → 2FeCl3.
Хлор непосредственно не взаимодействует с N2, О2 и инертными газами.
Окислительная активность галогенов уменьшается от фтора к астату, а восстановительная активность галогенид-ионов в этом направлении увеличивается. Из этого следует, что более активный галоген вытесняет менее активный из растворов его солей:
F2 + 2NaCl → Cl2 + 2NaF,
Cl2 + 2NaBr → Br2 + 2NaCl,
Вг2 + 2NaI → I2 + 2NaBr.
Водородные соединения галогенов хорошо растворимы в воде. Их водные растворы представляют собой кислоты:
HF– фтороводородная (плавиковая) кислота,
НС1 – хлороводородная кислота (водный раствор – соляная),
НВг – бромоводородная кислота,
HI – йодоводородная кислота.
НF должна быть одной из самых сильных кислот, но вследствие образования водородной связи (Н–F···Н–F) является слабой кислотой. Подтверждением наличия водородной связи между молекулами Н–F, как и в случае воды, является аномально высокая температура кипения Н–F.
Плавиковая кислота реагирует с SiО2, поэтому HF нельзя получать и хранить в стеклянной посуде
SiО2 + 4HF = SiF4↑ + 2Н2О.
Остальные галогенводороды являются сильными кислотами.
Хлор, бром и йод образуют кислородсодержащие кислоты и соответствующие им соли. Ниже, на примере хлора, приведены формулы
кислот и соответствующих им солей:
+1 +3 +5 +7
НСlО, НСlО2, НСlО3, НСlО4;
хлорноватистая хлористая хлорноватая хлорная
усиление кислотных свойств
———————————→
КСlО, КСlО2, КСlО3, КСlО4.
гипохлорит калия хлорит калия хлорат калия перхлорат калия
Хлорная и хлорноватая кислоты являются сильными, а хлористая и хлорноватистая – слабыми. Из солей можно отметить:
СаОС12 – «хлорная известь» представляет собой смешанную соль соляной и хлорноватистой кислот.
КСlO3 – хлорат калия, техническое название – бертолетова соль.
Фтор и его соединения применяются для получения термоустойчивых пластмасс (тефлон), хладагентов (фреоны) для холодильных машин.
Хлор используется в больших количествах для производства соляной кислоты синтетическим методом, хлорорганических инсектицидов, пластмасс, синтетических волокон, хлорной извести, отбеливания тканей и бумаги, хлорирования воды в целях обеззараживания, для хлорирования руд при получении металлов.
Соединения брома и йода используются для производства лекарственных препаратов, фотоматериалов.
17.6 р-Элементы VIII группы
Данные элементы: гелий (Не), неон (Nе), аргон (Аr), криптон (Кr), ксенон
(Хе) и радон (Rn) называют инертными газами, так как они обладают очень низкой химической активностью. На внешнем энергетическом уровне гелия находится два электрона, а у остальных элементов по восемь электронов, что соответствует энергетически выгодной электронной конфигурации.
Неоном и аргоном заполняют лампы накаливания. Сварка в среде аргона нержавеющих сталей, титана, алюминия и алюминиевых сплавов обеспечивает исключительно чистый и прочный сварной шов.
Криптон, ксенон и радон способны вступать в соединение с другими элементами и прежде всего с фтором. Данные соединения (ХеF2, ХеF6, ХеО3 и др.) обладают сильными окислительными свойствами. Радон является радиоактивным элементом с периодом полураспада 3,8 суток. Однако в природе он постоянно образуется. По мольной массе он в 7,65 раза тяжелее воздуха, поэтому скапливается в подвальных, непроветриваемых помещениях. За сутки концентрация радона в непроветриваемом помещении возрастает в 6 раз, а при пользовании душем в ванной комнате в 40 раз. Большую часть облучения человек получает от радиоактивного распада радона.

 ,
,