
- •Содержание
- •Введение
- •1 Основные понятия и законы химии
- •1.1 Основные понятия химии
- •1.2 Основные законы химии
- •2 Основные классы неорганических соединений
- •2.1 Простые вещества
- •2.2 Сложные вещества
- •3 Растворы
- •3.1 Общие свойства растворов
- •3.1.2 Способы выражения состава растворов
- •3.1.3 Физико-химические процессы образования растворов
- •3.1.4 Экстракция
- •3.2 Растворы неэлектролитов
- •3.2.1 Законы Рауля
- •3.2.2 Осмос
- •3.3 Растворы электролитов
- •3.3.1 Электролитическая диссоциация
- •3.3.2 Сильные и слабые электролиты
- •3.4 PH водных растворов
- •4 Ионно-обменные реакции
- •4.1 Необратимые ионно-обменные реакции
- •4.2 Обратимые ионно-обменные реакции
- •5 Гидролиз солей
- •5.1 Различные случаи гидролиза
- •2) Гидролиз соли образованной сильным основанием и слабой кислотой
- •3) Гидролиз соли образованной слабым основанием и слабой кислотой
- •5.2 Константа гидролиза
- •5.3 Смещение равновесия при гидролизе
- •6. Окислительно-восстановительные реакции
- •6.1 Составление уравнений окислительно-восстановительных реакций
- •6.2 Прогнозирование окислительно-восстановительных свойств веществ по степеням окисления элементов
- •6.3 Основные типы окислительно-восстановительных реакций
- •6.4 Взаимодействие металлов с водой, кислотами и щелочами
- •7 Гальванические элементы
- •7.1 Принцип работы гальванического элемента
- •7.2 Водородный электрод сравнения. Электрохимический ряд
- •8 Электролиз
- •8.1 Электролиз расплавов
- •8.2 Электролиз водных растворов
- •8.3 Количественные расчёты в электролизе
- •8.4 Химические источники электрической энергии
- •9 Коррозия металлов
- •9.1 Виды и типы коррозии
- •9.2 Способы защиты металлов от коррозии
- •9.2.1 Изолирование металлов от внешней среды
- •9.2.2 Изменение состава коррозионной среды
- •9.2.3 Рациональное конструирование
- •9.2.4 Электрохимические способы защиты от коррозии
- •10 Термодинамика
- •10.1 Внутренняя энергия и энтальпия. Закон Гесса
- •Или через промежуточный продукт (со) в две реакции:
- •10.2 Энтропия
- •10.3 Энергия Гиббса
- •11 Химическая кинетика Химическая кинетика – учение о скоростях и механизмах протекания химических реакций.
- •11.1 Скорость реакции
- •Основные факторы, влияющие на скорость реакции:
- •Число частиц с энергией большей, чем Еа равно заштрихованной площади.
- •12.1.2 Модель атома по Бору
- •12.2 Современные представления о строении атома
- •13 Периодический закон и периодическая таблица д.И. Менделеева
- •14 Химическая связь и строение молекул
- •14.1 Химическая связь
- •14.1.1 Квантово-механическое описание модели молекулы водорода
- •14.1.2 Основные характеристики химической связи
- •Валентный угол–это угол между двумя химическими связями.Он отражает геометрию молекулы.
- •14.1.3 Типы химических связей Ковалентная связь –это связь между двумя атомами за счет образования общей электронной пары.
- •14.2 Состав и строение молекул
- •15 Типы кристаллических решеток
- •16.1 Общая характеристика s-элементов первой и второй групп
- •16.2 Свойства воды
- •16.2.1 Строение молекулы воды
- •16.2.2 Физические свойства воды
- •16.2.3 Химические свойства воды
- •16.3 Жесткость воды
- •18 Комплексные соединения
- •18.1 Состав комплексных соединений
- •18.2 Реакции с участием комплексных соединений
- •19.8.1 Элементы триады железа
- •19.8.2 Платиновые металлы
- •20 Органические соединения
- •20.1 Углеводороды
- •20.2 Кислородсодержащие соединения
- •20.3 Амины и аминокислоты
- •21 Полимеры
- •21.1 Классификации полимеров
- •21.2 Полимеризационные полимеры
- •21.3 Поликонденсационные полимеры
- •21.4 Структура и состояние полимеров
- •22 Рабочие вещества низкотемпературной техники
- •22.2 Хладагенты органического происхождения
- •Список использованных источников
8.1 Электролиз расплавов
Разберем данный вопрос на следующих примерах.
1 Электролиз расплава NaCl с инертными (не принимающими участие в электролизе) электродами.

К)
Na + e
= Na
+ e
= Na ,
А) 2Сl
,
А) 2Сl – 2e
= Сl
– 2e
= Сl .
.
На катоде идет процесс восстановления, а на аноде – окисления.
При электролизе данного соединения получается металлический натрий и свободный хлор.
2 Электролиз расплава оксида алюминия, анод – инертный.

К)
Аl3+
+ 3e
= Аl ,
А) 2О2–
– 4e
= О2.
,
А) 2О2–
– 4e
= О2.
Температура плавления оксида алюминия около 2050 0С. При промышленном получении алюминия, для снижения температуры плавления электролита до 960 оС электролизу подвергают смесь оксида алюминия (10 %) с криолитом (Nа3[АlF6]). Алюминий, имеющий большую плотность, чем электролит, собирается на дне электролизера, а кислород окисляет угольный анод до СО и СО2.
8.2 Электролиз водных растворов
В случае водных растворов наблюдается конкуренция между ионами растворенного вещества и воды за процесс окисления и восстановления. При этом следует учитывать, что металл анода тоже может окисляться – растворимый анод. К нерастворимым анодам относятся: углерод, золото, платина, свинец в растворе серной кислоты и др.
Последовательность разрядки водных растворов ионов в ходе электролиза в большинстве случаев согласуется со следующей схемой:
1) катионы:
– от лития до Аl не восстанавливаются, так как идет восстановление воды;
– от Мn до водорода – наряду с восстановлением металла идет восстановление воды;
– металлы после водорода – идет восстановление металла.
2) анионы:
– если анод растворимый – вначале происходит окисление анода;
– если анод нерастворимый – вначале окисляются анионы бескислородных кислот (I–, Вr–, Cl–) за исключением F–;
– далее идет окисление ОН– и Н2О;
– затем окисляются анионы кислородсодержащих кислот и F–.
Разберем различные случаи электролиза водных растворов.
1 Электролиз водного раствора NaCl с инертными электродами.

К)
2Н2О
+ 2e
= Н2 +
2ОН ,
А) 2Сl
,
А) 2Сl - 2e
= Сl2.
- 2e
= Сl2.
Вторичная реакция в ходе электролиза
Na ОН–=
NaОН.
ОН–=
NaОН.
Таким образом, в ходе электролиза: Н2, Сl2 и NaОН.
2 Электролиз водного раствора сульфата натрия с инертными электродами.

К) 2Н2О + 2e = Н2 + 2ОН–, А) 2Н2О – 4e = О2 + 4Н+.
Вторичная реакция – Н+ + ОН– = Н2О.
В ходе электролиза идет разложение воды с образованием О2 и Н2. Сульфат натрия не расходуется в ходе электролиза, но он обеспечивает высокую электропроводность электролита.
3 Электролиз сульфата меди с медным анодом.

К) Сu2+ + 2e = Сu0, А) Сu0 – 2e = Сu2+.
Из приведенной схемы видно, что в данном случае происходит перенос меди с анода на катод, что приводит к очистке меди. Примеси, входящие в состав черновой меди, включают в себя неактивные металлы (Аg, Аu, Рt) и активные металлы (Fe, Мn и др.). Неактивные металлы будут образовывать осадок в электролизёре, а в растворе будут накапливаться катионы активных металлов. Поэтому периодически производится замена электролита.
8.3 Количественные расчёты в электролизе
Так как образование продуктов в ходе электролиза является следствием протекающих реакций, в основе расчетов лежат стехиометрические законы, в частности, закон эквивалентов. Применительно к электролизу его можно сформулировать следующим образом: количества моль эквивалентов веществ, образующихся на катоде и аноде, равны числу моль эквивалентов электронов прошедших через раствор электролита. Применяемые в расчетах законы Фарадея – это частный случай применения закона эквивалентов к электрохимическим реакциям.
Объединенный закон Фарадея имеет вид:
|
|
(8.2) |
где m(х) – масса окисленного или восстановленного вещества при электролизе, в граммах;
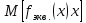 –молярная
масса эквивалента вещества;
–молярная
масса эквивалента вещества;
I – сила тока (в амперах);
τ – время электролиза (в секундах);
96500 – число Фарадея (F), выраженное в кулонах.
Если в реакции окисляются или восстанавливаются газообразные вещества, то в полученное уравнение вместо масс подставляются соответствующие значения объемов.
Пример
Рассчитать массу меди, которая выделится на катоде при электролизе раствора сульфата меди в течение 2 часов при силе тока в 100 А.
Решение:
К) Сu2++ 2e®Cu,fэкв.(Cu) = ½, М(½Cu) = 31,773 г/моль.
Подставляя в уравнение закона Фарадея соответствующие значения получаем:
m(Cu)
=
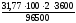 = 237,04 г.
= 237,04 г.

