
- •Содержание
- •Введение
- •1 Основные понятия и законы химии
- •1.1 Основные понятия химии
- •1.2 Основные законы химии
- •2 Основные классы неорганических соединений
- •2.1 Простые вещества
- •2.2 Сложные вещества
- •3 Растворы
- •3.1 Общие свойства растворов
- •3.1.2 Способы выражения состава растворов
- •3.1.3 Физико-химические процессы образования растворов
- •3.1.4 Экстракция
- •3.2 Растворы неэлектролитов
- •3.2.1 Законы Рауля
- •3.2.2 Осмос
- •3.3 Растворы электролитов
- •3.3.1 Электролитическая диссоциация
- •3.3.2 Сильные и слабые электролиты
- •3.4 PH водных растворов
- •4 Ионно-обменные реакции
- •4.1 Необратимые ионно-обменные реакции
- •4.2 Обратимые ионно-обменные реакции
- •5 Гидролиз солей
- •5.1 Различные случаи гидролиза
- •2) Гидролиз соли образованной сильным основанием и слабой кислотой
- •3) Гидролиз соли образованной слабым основанием и слабой кислотой
- •5.2 Константа гидролиза
- •5.3 Смещение равновесия при гидролизе
- •6. Окислительно-восстановительные реакции
- •6.1 Составление уравнений окислительно-восстановительных реакций
- •6.2 Прогнозирование окислительно-восстановительных свойств веществ по степеням окисления элементов
- •6.3 Основные типы окислительно-восстановительных реакций
- •6.4 Взаимодействие металлов с водой, кислотами и щелочами
- •7 Гальванические элементы
- •7.1 Принцип работы гальванического элемента
- •7.2 Водородный электрод сравнения. Электрохимический ряд
- •8 Электролиз
- •8.1 Электролиз расплавов
- •8.2 Электролиз водных растворов
- •8.3 Количественные расчёты в электролизе
- •8.4 Химические источники электрической энергии
- •9 Коррозия металлов
- •9.1 Виды и типы коррозии
- •9.2 Способы защиты металлов от коррозии
- •9.2.1 Изолирование металлов от внешней среды
- •9.2.2 Изменение состава коррозионной среды
- •9.2.3 Рациональное конструирование
- •9.2.4 Электрохимические способы защиты от коррозии
- •10 Термодинамика
- •10.1 Внутренняя энергия и энтальпия. Закон Гесса
- •Или через промежуточный продукт (со) в две реакции:
- •10.2 Энтропия
- •10.3 Энергия Гиббса
- •11 Химическая кинетика Химическая кинетика – учение о скоростях и механизмах протекания химических реакций.
- •11.1 Скорость реакции
- •Основные факторы, влияющие на скорость реакции:
- •Число частиц с энергией большей, чем Еа равно заштрихованной площади.
- •12.1.2 Модель атома по Бору
- •12.2 Современные представления о строении атома
- •13 Периодический закон и периодическая таблица д.И. Менделеева
- •14 Химическая связь и строение молекул
- •14.1 Химическая связь
- •14.1.1 Квантово-механическое описание модели молекулы водорода
- •14.1.2 Основные характеристики химической связи
- •Валентный угол–это угол между двумя химическими связями.Он отражает геометрию молекулы.
- •14.1.3 Типы химических связей Ковалентная связь –это связь между двумя атомами за счет образования общей электронной пары.
- •14.2 Состав и строение молекул
- •15 Типы кристаллических решеток
- •16.1 Общая характеристика s-элементов первой и второй групп
- •16.2 Свойства воды
- •16.2.1 Строение молекулы воды
- •16.2.2 Физические свойства воды
- •16.2.3 Химические свойства воды
- •16.3 Жесткость воды
- •18 Комплексные соединения
- •18.1 Состав комплексных соединений
- •18.2 Реакции с участием комплексных соединений
- •19.8.1 Элементы триады железа
- •19.8.2 Платиновые металлы
- •20 Органические соединения
- •20.1 Углеводороды
- •20.2 Кислородсодержащие соединения
- •20.3 Амины и аминокислоты
- •21 Полимеры
- •21.1 Классификации полимеров
- •21.2 Полимеризационные полимеры
- •21.3 Поликонденсационные полимеры
- •21.4 Структура и состояние полимеров
- •22 Рабочие вещества низкотемпературной техники
- •22.2 Хладагенты органического происхождения
- •Список использованных источников
3 Растворы
3.1 Общие свойства растворов
3.1.1 Классификация систем, состоящих из двух и более веществ Системы, состоящие из двух и более веществ, в зависимости от размеров частиц можно разделить на дисперсные системы(10–3 ÷ 10–5 см), коллоидные растворы(10–5 ÷ 10–7 см) и истинные растворы(менее 10–7 см).
Дисперсная система – это система из двух или более веществ, в
которой одно или несколько веществ измельчено и равномерно распределено в другом. Дисперсная система состоит из совокупности мелких частиц –дисперсная фаза и окружающего их вещества – дисперсионная среда. Классификация дисперсных систем по агрегатному состоянию приведена в таблице 3.1.
Таблица 3.1 – Классификация дисперсных систем
|
Дисперсионная среда |
Дисперсная фаза | ||
|
Г |
Ж |
Т | |
|
Г |
– |
аэрозоли туман, облака |
аэрозоли дым, пыль |
|
Ж |
пены мыльная пена, пивная пена |
эмульсии молоко, масло сливочное |
взвеси (суспензии) краски, лаки |
|
Т |
твердые пены пенопласт, пемза и т.д. |
твердые эмульсии желеорабразные студни |
твердые суспензии, сплавы |
Обозначения: Г – газ, Ж – жидкость, Т – твердое вещество.
Важной характеристикой дисперсных систем является степень дисперсности (D) или степень раздробленности. С увеличением степени раздробленности резко возрастает площадь поверхности дисперсной фазы, что приводит к увеличению поверхностных явлений на границе раздела фаз.
Дисперсные системы термодинамически неустойчивы и с течением времени разделяются. Различают кинетическую (за счет действия силы тяжести) и агрегативную (за счет укрупнения размеров частиц) устойчивости.
Коллоидный раствор – это система, характеризующаяся такой степенью раздробленности компонентов, при которой броуновское движение препятствует осаждению частиц.
Коллоиды по внешнему виду напоминают истинные растворы. Однако при прохождении светового луча через прозрачный коллоидный раствор луч становится видимым сбоку на темном фоне. Этот оптический эффект называется конусом Тиндаля.
Коллоиды находятся в метастабильном состоянии и достаточно небольшого внешнего воздействия, чтобы началось разделение компонентов коллоидного раствора.
Истинный раствор – это система, в которой растворённое вещество и растворитель измельчены до атомного или молекулярного уровня и равномерно распределены по всему объему раствора. Истинные растворы – термодинамически устойчивые системы. В последующем вместо названия истинный раствор будет применяться термин «раствор».
Раствор – это гомогенная однородная система, состоящая из двух или более компонентов.
Растворы имеют большое практическое значение, в них протекают многие химические реакции. В большинстве пищевых технологий применяются растворы. Последующий материал посвящен изучению свойств водных растворов.
3.1.2 Способы выражения состава растворов
Приведем наиболее часто применяемые на практике концентрации растворов.
Массовая доля (ω) – отношение массы растворенного вещества к массе раствора:
|
ω(x)
= |
(3.1) |
Массовая доля выражается в долях от единицы или в процентах (в долях от ста). Процентная концентрация показывает, сколько граммов растворённого вещества содержится в 100 г раствора. Например: ω(Н2SО4) = 0,3 или 30 % Н2SО4, т.е. в 100 г раствора содержится 30 г Н2SО4.
Мольная доля (N) – отношение количества молей растворенного вещества к общему числу молей раствора. В случае двухкомпонентного раствора формула имеет вид:
|
N(х) |
(3.2) |
Мольная доля показывает, сколько молей растворенного вещества приходится на один моль раствора. Например,
N(Н2SО4) = 0,2, т.е. на один моль раствора приходится 0,2 моль Н2SО4.
Массовая и мольная доли являются безразмерными величинами.
Молярная концентрация (С) – отношение количества молей растворенного вещества к объему раствора:
|
С(х) |
(3.3) |
Сокращенное обозначение молярной концентрации – М. На практике молярную концентрацию выражают обычно в моль/л. Например:
С(Н2SО3) = 0,2 моль/л или 0,2 М Н2SО3, т.е. в одном литре раствора содержится 0,2 моль Н2SО3. В случае равновесной молярной концентрации будет применяться следующая запись: [Н2SО3].
|
С(fэкв.(х)х) |
(3.4) |
Молярная концентрация эквивалента С(fэкв.(х)х) или нормальная концентрация (н) – отношение количества моль эквивалентов растворенного вещества к объему раствора:
Например, С(1/2 Н2SО4 ) = 0,4 моль экв./л или 0,4 н Н2SО4, т.е. в одном литре раствора содержится 0,4 моль эквивалента Н2SО4.
Моляльная концентрация (Сm) – отношение количества молей растворенного вещества к 1 кг растворителя:
|
Cm(х) |
(3.5) |
Например, Сm(Н2SО4) = 0,3 моль/кг, т.е. на 1 кг растворителя приходится 0,3 моль Н2SО4.
Массовые концентрации (массовая доля, моляльная) не зависят от температуры. В случае применения в формуле объема концентрация раствора будет зависеть от температуры, поэтому её относят к определенной температуре.

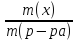 .
.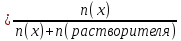 .
.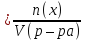 .
.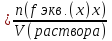 .
.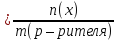 .
.