- •Содержание
- •Введение
- •1 Основные понятия и законы химии
- •1.1 Основные понятия химии
- •1.2 Основные законы химии
- •2 Основные классы неорганических соединений
- •2.1 Простые вещества
- •2.2 Сложные вещества
- •3 Растворы
- •3.1 Общие свойства растворов
- •3.1.2 Способы выражения состава растворов
- •3.1.3 Физико-химические процессы образования растворов
- •3.1.4 Экстракция
- •3.2 Растворы неэлектролитов
- •3.2.1 Законы Рауля
- •3.2.2 Осмос
- •3.3 Растворы электролитов
- •3.3.1 Электролитическая диссоциация
- •3.3.2 Сильные и слабые электролиты
- •3.4 PH водных растворов
- •4 Ионно-обменные реакции
- •4.1 Необратимые ионно-обменные реакции
- •4.2 Обратимые ионно-обменные реакции
- •5 Гидролиз солей
- •5.1 Различные случаи гидролиза
- •2) Гидролиз соли образованной сильным основанием и слабой кислотой
- •3) Гидролиз соли образованной слабым основанием и слабой кислотой
- •5.2 Константа гидролиза
- •5.3 Смещение равновесия при гидролизе
- •6. Окислительно-восстановительные реакции
- •6.1 Составление уравнений окислительно-восстановительных реакций
- •6.2 Прогнозирование окислительно-восстановительных свойств веществ по степеням окисления элементов
- •6.3 Основные типы окислительно-восстановительных реакций
- •6.4 Взаимодействие металлов с водой, кислотами и щелочами
- •7 Гальванические элементы
- •7.1 Принцип работы гальванического элемента
- •7.2 Водородный электрод сравнения. Электрохимический ряд
- •8 Электролиз
- •8.1 Электролиз расплавов
- •8.2 Электролиз водных растворов
- •8.3 Количественные расчёты в электролизе
- •8.4 Химические источники электрической энергии
- •9 Коррозия металлов
- •9.1 Виды и типы коррозии
- •9.2 Способы защиты металлов от коррозии
- •9.2.1 Изолирование металлов от внешней среды
- •9.2.2 Изменение состава коррозионной среды
- •9.2.3 Рациональное конструирование
- •9.2.4 Электрохимические способы защиты от коррозии
- •10 Термодинамика
- •10.1 Внутренняя энергия и энтальпия. Закон Гесса
- •Или через промежуточный продукт (со) в две реакции:
- •10.2 Энтропия
- •10.3 Энергия Гиббса
- •11 Химическая кинетика Химическая кинетика – учение о скоростях и механизмах протекания химических реакций.
- •11.1 Скорость реакции
- •Основные факторы, влияющие на скорость реакции:
- •Число частиц с энергией большей, чем Еа равно заштрихованной площади.
- •12.1.2 Модель атома по Бору
- •12.2 Современные представления о строении атома
- •13 Периодический закон и периодическая таблица д.И. Менделеева
- •14 Химическая связь и строение молекул
- •14.1 Химическая связь
- •14.1.1 Квантово-механическое описание модели молекулы водорода
- •14.1.2 Основные характеристики химической связи
- •Валентный угол–это угол между двумя химическими связями.Он отражает геометрию молекулы.
- •14.1.3 Типы химических связей Ковалентная связь –это связь между двумя атомами за счет образования общей электронной пары.
- •14.2 Состав и строение молекул
- •15 Типы кристаллических решеток
- •16.1 Общая характеристика s-элементов первой и второй групп
- •16.2 Свойства воды
- •16.2.1 Строение молекулы воды
- •16.2.2 Физические свойства воды
- •16.2.3 Химические свойства воды
- •16.3 Жесткость воды
- •18 Комплексные соединения
- •18.1 Состав комплексных соединений
- •18.2 Реакции с участием комплексных соединений
- •19.8.1 Элементы триады железа
- •19.8.2 Платиновые металлы
- •20 Органические соединения
- •20.1 Углеводороды
- •20.2 Кислородсодержащие соединения
- •20.3 Амины и аминокислоты
- •21 Полимеры
- •21.1 Классификации полимеров
- •21.2 Полимеризационные полимеры
- •21.3 Поликонденсационные полимеры
- •21.4 Структура и состояние полимеров
- •22 Рабочие вещества низкотемпературной техники
- •22.2 Хладагенты органического происхождения
- •Список использованных источников
Министерство образования Республики Беларусь
Учреждение образования
«Могилевский государственный университет продовольствия»
Кафедра химии
А.Н. Жогальский
ХИМИЯ
Конспект лекций
Могилёв 2012
УДК 546
ББК 24
Ж78
Рецензенты: кандидат химических наук, доцент кафедры химии УО «МГУП» Н.И. Сухарева; старший преподаватель кафедры технологии металлов ГУВПО «Белорусско-Российский университет» В.Ф. Пацей
Рекомендовано кафедрой химии УО «МГУП»
Утверждено научно-методическим советом УО «МГУП»
Жогальский, А. Н.
Ж78 Химия: конспект лекций / А.Н. Жогальский. – Могилев: УО «МГУП», 2012. – 168 с.
ISBN 978-985-6979-38-8.
В данном конспекте лекций изложен материал по основам общей химии, химии элементов и органической химии. Конспект содержит рисунки, таблицы, примеры задач с решениями.
Материал предназначен для подготовки студентов механического профиля дневной и заочной форм обучения.
УДК 546
ББК 24
|
ISBN 978-985-6979-38-8
|
© Жогальский А.Н., 2012 © Учреждение образования «Могилевский государственный университет продовольствия», 2012 |
Содержание
|
Введение |
4 |
|
Часть первая. Основы общей химии |
4 |
|
1 Основные понятия и законы химии |
4 |
|
2 Основные классы неорганических соединений |
7 |
|
3 Растворы |
13 |
|
4 Ионно-обменные реакции |
30 |
|
5 Гидролиз |
33 |
|
6 Окислительно-восстановительные реакции |
38 |
|
7 Гальванические элементы |
44 |
|
8 Электролиз |
48 |
|
9 Коррозия металлов |
54 |
|
10 Термодинамика |
61 |
|
11 Химическая кинетика |
68 |
|
12 Строение атома |
76 |
|
13 Периодический закон и периодическая таблица Д.И. Менделеева |
83 |
|
14 Химическая связь и строение молекул |
85 |
|
15 Типы кристаллических решеток |
92 |
|
Часть вторая. Химия элементов |
94 |
|
16 s-Элементы |
94 |
|
17 р-Элементы |
106 |
|
18 Комплексные соединения |
127 |
|
19 d-и f-Элементы |
131 |
|
Часть третья. Органическая химия |
147 |
|
20 Органические соединения |
147 |
|
21 Полимеры |
156 |
|
22 Рабочие вещества низкотемпературной техники |
163 |
|
Список использованных источников |
167 |
Введение
Химия является фундаментальной естественнонаучной дисциплиной. Знание химии необходимо для плодотворной творческой деятельности инженера любой специальности. Изучение химии позволяет получить современное научное представление о строении вещества, физических и химических превращениях неорганических и органических веществ, о свойствах технических материалов и применении химических процессов в современной технике. Знание химии необходимо для успешного последующего изучения общенаучных и специальных дисциплин.
Часть первая. ОСНОВЫ ОБЩЕЙ ХИМИИ
1 Основные понятия и законы химии
1.1 Основные понятия химии
Окружающий нас мир материален. Материя существует в виде вещества и поля. Поле – вид материи, не имеющий массы покоя.
Вещество – вид материи, обладающий при данных условиях определёнными физическими свойствами. Например, вода при стандартных условиях
(25 °С, 1 атм или 101 кПа) бесцветная жидкость со следующими константами: мольная масса 18 г/моль, плотность 1 г/мл (при 4 °С), температуры фазовых переходов: замерзания и кипения соответственно 0 °С и 100 °С, теплоемкость жидкой воды 4,18 Дж/(г·К) и др. константы.
Вещества состоят из атомов или молекул. Основы атомно-молекулярного учения впервые были изложены М.В. Ломоносовым в 1741 году и развиты в работах других ученых.
Атом – электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Главной характеристикой атома является заряд ядра, равный числу протонов в атоме. В состав ядра любого атома, за исключением изотопа
водорода 1Н, входят также нейтральные частицы нейтроны.
Элемент – разновидность атомов, имеющих одинаковый заряд ядра.
Изотоп – вид атомов, имеющих одинаковый заряд ядра, но разную массу. Наличие изотопов связано с различным содержанием нейтронов в атоме одного элемента. Изотопы по физическим константам и химическим свойствам отличаются незначительно. Исключение составляют изотопы водорода: протий (Н) – 1Н, дейтерий (D) – 2Н и тритий (Т) – 3Н. При переходе от протия к дейтерию и тритию атомная масса возрастает соответственно в два и три раза, что приводит к значительному различию в физических и химических свойствах данных изотопов.
Молекула – это наименьшая частица вещества, обладающая его химическими свойствами.
Моль – это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12С.
Один моль атомов углерода 12С содержат 6,02·1023 (число Авогадро) атомов углерода.
Например, один моль Н2SО4 содержит 6,02·1023 молекул Н2SО4.
Мольная масса – это масса одного моля вещества.
Например, М(Н2SО4) = 98 г/моль.
|
Количество молей вещества обозначается n(x) и вычисляется по формуле
|
(1.1) |
где
m(x)
– масса
вещества
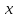 ,
,
М(х)
–
мольная масса вещества
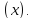
Например: если m(Н2SО4) = 9,8 г, то n(Н2SО4) = 9,8 ∕ 98 = 0,1 моль.
|
Мольная масса эквивалента вещества – это произведение массы вещества на его фактор эквивалентности М[fэкв. (х)х] = М(х) · fэкв. (х), где М(х) – мольная масса вещества х, fэкв.(х) – фактор эквивалентности вещества х. |
мольной
(1.2) |
Например:М(½Н2SО4) = 98 · ½ = 49 г/моль.
Фактор
эквивалентности вещества
– это число
показывающее, какая доля атома или
молекулы вещества эквивалентна в
кислотно-основной реакции одному иону
Н+
или в окислительно-восстановительной
реакции одному электрону. Например:
fэкв.(Н2SО4)
= ½ ,fэкв.(А1)
= 1∕3.
,fэкв.(А1)
= 1∕3.
Количество моль эквивалентов вещества обозначается n[fэкв.(х)х]. Например: n(½Н2SО4) = 0,6 моль эквивалента Н2SО4, что соответствуют n(Н2SО4) = 0,3 моль.