
- •Содержание
- •Введение
- •1 Основные понятия и законы химии
- •1.1 Основные понятия химии
- •1.2 Основные законы химии
- •2 Основные классы неорганических соединений
- •2.1 Простые вещества
- •2.2 Сложные вещества
- •3 Растворы
- •3.1 Общие свойства растворов
- •3.1.2 Способы выражения состава растворов
- •3.1.3 Физико-химические процессы образования растворов
- •3.1.4 Экстракция
- •3.2 Растворы неэлектролитов
- •3.2.1 Законы Рауля
- •3.2.2 Осмос
- •3.3 Растворы электролитов
- •3.3.1 Электролитическая диссоциация
- •3.3.2 Сильные и слабые электролиты
- •3.4 PH водных растворов
- •4 Ионно-обменные реакции
- •4.1 Необратимые ионно-обменные реакции
- •4.2 Обратимые ионно-обменные реакции
- •5 Гидролиз солей
- •5.1 Различные случаи гидролиза
- •2) Гидролиз соли образованной сильным основанием и слабой кислотой
- •3) Гидролиз соли образованной слабым основанием и слабой кислотой
- •5.2 Константа гидролиза
- •5.3 Смещение равновесия при гидролизе
- •6. Окислительно-восстановительные реакции
- •6.1 Составление уравнений окислительно-восстановительных реакций
- •6.2 Прогнозирование окислительно-восстановительных свойств веществ по степеням окисления элементов
- •6.3 Основные типы окислительно-восстановительных реакций
- •6.4 Взаимодействие металлов с водой, кислотами и щелочами
- •7 Гальванические элементы
- •7.1 Принцип работы гальванического элемента
- •7.2 Водородный электрод сравнения. Электрохимический ряд
- •8 Электролиз
- •8.1 Электролиз расплавов
- •8.2 Электролиз водных растворов
- •8.3 Количественные расчёты в электролизе
- •8.4 Химические источники электрической энергии
- •9 Коррозия металлов
- •9.1 Виды и типы коррозии
- •9.2 Способы защиты металлов от коррозии
- •9.2.1 Изолирование металлов от внешней среды
- •9.2.2 Изменение состава коррозионной среды
- •9.2.3 Рациональное конструирование
- •9.2.4 Электрохимические способы защиты от коррозии
- •10 Термодинамика
- •10.1 Внутренняя энергия и энтальпия. Закон Гесса
- •Или через промежуточный продукт (со) в две реакции:
- •10.2 Энтропия
- •10.3 Энергия Гиббса
- •11 Химическая кинетика Химическая кинетика – учение о скоростях и механизмах протекания химических реакций.
- •11.1 Скорость реакции
- •Основные факторы, влияющие на скорость реакции:
- •Число частиц с энергией большей, чем Еа равно заштрихованной площади.
- •12.1.2 Модель атома по Бору
- •12.2 Современные представления о строении атома
- •13 Периодический закон и периодическая таблица д.И. Менделеева
- •14 Химическая связь и строение молекул
- •14.1 Химическая связь
- •14.1.1 Квантово-механическое описание модели молекулы водорода
- •14.1.2 Основные характеристики химической связи
- •Валентный угол–это угол между двумя химическими связями.Он отражает геометрию молекулы.
- •14.1.3 Типы химических связей Ковалентная связь –это связь между двумя атомами за счет образования общей электронной пары.
- •14.2 Состав и строение молекул
- •15 Типы кристаллических решеток
- •16.1 Общая характеристика s-элементов первой и второй групп
- •16.2 Свойства воды
- •16.2.1 Строение молекулы воды
- •16.2.2 Физические свойства воды
- •16.2.3 Химические свойства воды
- •16.3 Жесткость воды
- •18 Комплексные соединения
- •18.1 Состав комплексных соединений
- •18.2 Реакции с участием комплексных соединений
- •19.8.1 Элементы триады железа
- •19.8.2 Платиновые металлы
- •20 Органические соединения
- •20.1 Углеводороды
- •20.2 Кислородсодержащие соединения
- •20.3 Амины и аминокислоты
- •21 Полимеры
- •21.1 Классификации полимеров
- •21.2 Полимеризационные полимеры
- •21.3 Поликонденсационные полимеры
- •21.4 Структура и состояние полимеров
- •22 Рабочие вещества низкотемпературной техники
- •22.2 Хладагенты органического происхождения
- •Список использованных источников
6.4 Взаимодействие металлов с водой, кислотами и щелочами
Важным практическим вопросом является устойчивость металлов в воде и в водных растворах кислот и оснований. Возможность протекания данных окислительно-восстановительных реакций в большинстве случаев согласуется с положением металлов в электрохимическом ряду.
С водой взаимодействуют металлы от лития до железа включительно. Щелочные и щелочноземельные металлы энергично вытесняют водород из воды. Железо реагирует при температуре красного каления (500 оС) с образованием Fе3О4. Например:
1) 2К + 2Н2О = Н2 + 2КОН,
2) 6Fe + 8Н2О = 8Н2 + 2Fe3О4.
Ряд активных металлов Аl, Zn, Ве и др. непосредственно с водой не реагируют из-за наличия на их поверхности защитной оксидной пленки.
С соляной и серной (разбавленной) кислотами реагируют все металлы, расположенные в электрохимическом ряду до водорода. Например:
1) Fe +2НСl = Н2 + FeСl2,
2) 2Аl + 3Н2SO4 = 3Н2 + Аl2(SO4)3.
В случае образования на поверхности металлов нерастворимых в воде соединений (PbSО4 и др.) реакции практически не протекают.
С серной концентрированной и азотной кислотами реагируют все металлы за исключением золота и большинства металлов платиновой группы. Например:
1) 2Fe + 6Н2SO4(конц.) = Fe2(SO4)3+ 3SO2 +6Н2О,
2) 3Сu + 8НNO3(разб.) = 3Сu(NO3)2 + 2NO + 4Н2О,
3) Сu + 4НNO3(конц.) = Сu(NO3)2 + 2NO2 + 2Н2О.
Наиболее вероятные продукты восстановления серной и азотной кислот металлами приведены в таблице 6.1.
Таблице 6.1 – Продукты взаимодействия металлов с HNO3 и H2SO4
|
Кислоты |
Положение металла в электрохимическом ряду | ||
|
от Li до Zn |
от Zn до H |
от Н до Ag | |
|
HNO3разб. |
NH4NO3 |
NO, (N2, N2O) |
NO |
|
HNO3конц. |
N2O |
NO2, (NO) |
NO2 |
|
H2SO4разб. |
H2, H2S |
H2 |
не реагирует |
|
H2SO4конц. |
S, (H2S) |
SO2, S |
SO2 |
Из приведенной схемы видно, что в случае азотной кислоты, чем активней металл и более разбавлена кислота, тем в большей степени происходит восстановление азота.
В очень концентрированных кислотах многие металлы «пассивируются» из-за образования на их поверхности нерастворимых соединений.
В водных растворах щелочей растворятся алюминий, цинк и другие амфотерные металлы. Например:
2Аl + 2NаOН + 6Н2О = 2Nа[Аl(ОН)4] + 3Н2.
7 Гальванические элементы
Гальванические элементы – это устройства для превращения энергии химической окислительно-восстановительной реакции непосредственно в электрическую энергию.
В ходе окислительно-восстановительных реакций происходит переход электронов непосредственно от восстановителя к окислителю. В случае гальванического элемента процессы окисления и восстановления разделены и переход электронов осуществляется по проводнику первого рода, что позволяет энергию химической реакции превратить непосредственно в электрическую энергию.
7.1 Принцип работы гальванического элемента
В основе работы гальванического элемента лежит явление возникновения электродного потенциала на границе металл –раствор.
Металлы – это вещества, в узлах кристаллической решетки которых находятся катионы, а в межатомном пространстве свободные электроны (электронный газ). При контакте металлов с водой в результате взаимодействия катионов металла (Men+) с полярными молекулами воды часть ионов металла перейдет в раствор в виде гидратов (Men+·nH2O), а электроны останутся на металле, т.е. раствор будет иметь положительный заряд, а металл – отрицательный. Таким образом, на границе металл–раствор образуется двойной электрический слой. В результате образования двойного электрического слоя на границе металл–раствор возникает скачок потенциала, который называют электродным потенциалом и обозначают φ.
Принцип работы гальванического элемента разберем на примере работы элемента, составленного из цинкового и медного электродов, опущенных в 1М растворы своих солей, схема которого приведена на рисунке 7.1.
Цинковый и медный электроды соединены проводником первого рода (металл), а растворы электролитов – электролитическим мостиком. В гальваническом элементе различают внешнюю цепь – проводник первого рода и внутреннюю цепь – проводник второго рода (раствор электролита). Во внешнюю цепь включен гальванометр.
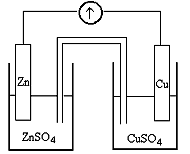
Рисунок 7.1 – Схема гальванического элемента Дениеля-Якоби
Цинковый электрод в сравнении с медным имеет более низкое значение электродного потенциала. После соединения данных электродов возникает электродвижущая сила (ЭДС), которая приводит к переходу электронов с цинкового электрода на медный. Таким образом, цинковый электрод является анодом, а медный – катодом. Переход электронов приводит к изменению электродных потенциалов на электродах и для восстановления их значений будет происходить частичное окисление Zn и восстановление Cu+2. Накапливающиеся в анодном участке Zn+2, а в катодном нескомпенсированные SО4–2 через электролитический мостик будут взаимодействовать с образованием ZnSО4. Электрическая цепь замкнута, поэтому гальванический элемент будет работать до полного окисления цинкового электрода или восстановления всех ионов меди.
На примере данного элемента покажем схематическую форму записи гальванического элемента и напишем реакции, протекающие на электродах и
во внутренней цепи.
Схема гальванического элемента: (А) Zn | ZnSО4 || CuSО4 | Cu (К).
Реакции на аноде и катоде:
А) Zn – 2е = Zn2+,
К) Cu2+ + 2е = Cu.
Реакция, обеспечивающая проводимость во внутренней цепи:
Zn2+ + SО42– = ZnSО4.
Суммарная реакция, протекающая в ходе работы гальванического элемента, имеет вид
Zn + CuSО4 = Cu + ZnSО4.
Электродвижущая сила гальванического элемента (ЭДС) равна разности электродных потенциалов двух полуэлементов:
E = φ0(Cu2+/Cu) – φ0(Zn2+/Zn) = +0,34 – (–0,76) = 1,1 В.
В общем виде – это разность потенциалов катодного и анодного процессов:
|
Eгальван. эл-та = φ катода – φ анода. |
(7.1) |
