
- •Л.Е. Салова, а.Т. Чанышева, м.А. Молявко
- •Химического анализа неорганических веществ Введение
- •Поэтому качественный анализ неорганических веществ подразделяется на анализ катионов и анализ анионов сложного вещества.
- •Способы выполнения аналитических реакций
- •Классификация методов по количеству вещества
- •Техника выполнения реакций
- •Условия выполнения реакций
- •Дробный и систематический анализ
- •Классификация катионов в качественном кислотно-основном химическом анализе
- •Методика выполнения основных операций полумикроанализа
- •Требования к правилам и умениям
- •Деление катионов на аналитические группы по кислотно- основной классификации
- •Первая группа катионов
- •1. Общая характеристика катионов первой группы
- •1.1. Степень окисления
- •1.2. Свойства гидроксидов
- •1.3. Гидролиз солей
- •1.4. Комплексообразование
- •1.5. Техника безопасности
- •Лабораторная работа №1 «Изучение свойств катионов I аналитической группы и анализ их смеси»
- •1.6. Общие реакции катионов I группы
- •2. Реакции обнаружения катионов первой группы
- •2.1. Серебро
- •2.2. Свинец
- •2.3. Ртуть
- •3. Анализ смеси катионов I аналитической группы
- •Вопросы для повторения
- •Вторая группа катионов
- •4. Общая характеристика катионов второй группы
- •5.2. Кальций
- •5.3. Стронций
- •6. Анализ смеси катионов II аналитической группы
- •7. Анализ смеси катионов II группы с сульфатами
- •Вопросы для повторения
- •8. Анализ раствора смеси I и II аналитических групп (без сульфатов)
- •8.1. Внешний вид смеси:
- •8.2. Отделение катионов I аналитической группы от II
- •8.6. Обнаружение иона бария
- •8.7. Обнаружение иона кальция
- •8.8. Отделение иона бария
- •8.9. Обнаружение иона стронция
- •Третья группа катионов
- •(Без сульфатов)
- •9. Общая характеристика катионов третьей группы
- •9.1. Степень окисления
- •9.2. Свойства гидроксидов
- •9.3. Гидролиз солей
- •10. Реакции обнаружения катионов третьей группы
- •10.1. Алюминий
- •10.2. Цинк
- •10.3. Хром
- •11. Анализ смеси катионов III группы
- •11.1. Обнаружение хрома
- •11.3. Обнаружение цинка
- •Вопросы для повторения
- •12. Анализ смеси катионов I, II и III групп
- •Четвёртая группа катионов
- •13. Общая характеристика катионов четвёртой группы
- •13.1. Степень окисления
- •13.2. Свойства гидроксидов
- •13.3. Гидролиз солей
- •13.4. Комплексообразование
- •14. Реакции обнаружения катионов четвёртой группы
- •14.1. Магний
- •14.2. Марганец
- •14.3. Железо (II)
- •14.4. Железо (III)
- •14.5. Висмут
- •15. Анализ смеси катионов IV группы
- •Вопросы для повторения
- •16.2. РН смеси
- •16.13. Анализ осадка 3
- •Пятая группа катионов
- •17. Общая характеристика катионов пятой группы
- •17.1. Степень окисления
- •17.2. Свойства гидроксидов
- •17.3. Гидролиз солей
- •18. Реакции обнаружения катионов V группы
- •18.1. Медь
- •18.2. Кобальт
- •18.3. Никель
- •19. Анализ смеси катионов V группы
- •Вопросы для повторения
- •Шестая группа катионов
- •21.2. Аммоний
- •22. Анализ раствора смеси катионов
- •V и VI аналитических групп
- •22.1. Внешний вид
- •22.3. Открытие иона калия
- •22.4. Открытие иона никеля
- •22.5. Открытие иона меди
- •22.6. Открытие иона кобальта
- •23. Анализ смеси катионов IV, V и VI аналитических групп
- •24. Анализ смеси катионов шести групп
- •Вопросы для повторения
- •Лабораторная работа № 7
- •25.3 Фосфат-ион ро43-
- •Общие и аналитические реакции анионов
- •26. Анализ смеси анионов I, II, III групп
- •Вопросы для повторения
- •27. Анализ индивидуальной соли
- •28. Контрольные задачи
- •Произведение растворимости некоторых малорастворимых электролитов при 25 0с
- •Общие константы нестойкости некоторых комплексных ионов
- •Криоскопические и эбуллиоскопические константы
- •Степень гидролиза и рН 0,1м раствора некоторых солей (при 18-250с)
- •Растворимость солей и оснований в воде (18-25 0с)
- •Константы диссоциации некоторых кислот и оснований при 25 0с
- •Библиографический список
- •Аналитическая химия Качественный кислотно-основной полумикроанализ
- •450062, Республика Башкортостан, г.Уфа, ул. Космонавтов,1
21.2. Аммоний
Реакция со щёлочью NaOH. Взаимодействие солей аммония с NaOH или КОН приводит к выделению аммиака при нагревании:
t
NH4Cl + NaOH NH3 + H2O + NaCl
Выполнение реакции рассмотрено ниже.
Реакция с реактивом Несслера. Реактив Несслера - щелочной раствор комплексной соли тетраиодомеркурата (II) калия K2[HgI4]+KOH. При взаимодействии реагента с солями аммония образуется красно-бурый осадок по реакции:
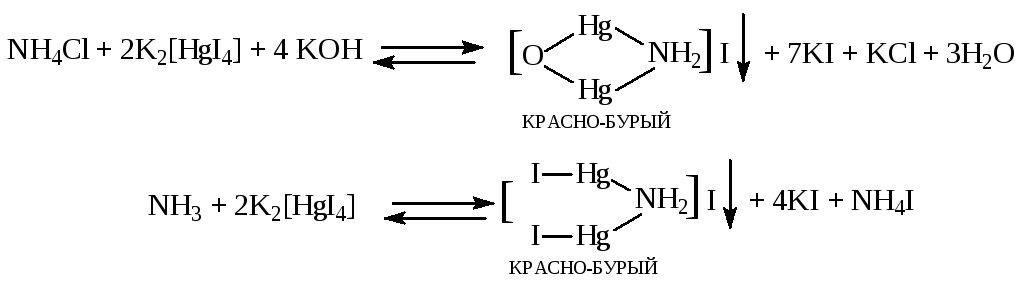
Реактив Несслера содержит щёлочь, которая с большинством катионов даёт осадок труднорастворимых гидроксидов, многие из которых окрашены.
Их образование мешает наблюдению осадка, образующегося в присутствии иона NH4+. Для устранения этого недостатка реакцию проводят в газовой камере.
Выполнение реакции:

На одно часовое стекло нанести 2 капли соли аммония и 2 капли 2н раствора NaOH; на другое стекло поместить универсальный индикатор, смоченный водой, и фильтровальную бумагу, смоченную реактивом Несслера. Бумажки не должны соприкасаться. Накрыть вторым стеклом первое, камеру поместить на ладонь. Через некоторое время фильтровальная бумага, смоченная реактивом Несслера, окрашивается в бурый цвет, а универсальный индикатор синеет вследствие образования гидроксид - ионов по реакции
NH3 + H2O NH4OH NH4+ + OH-
22. Анализ раствора смеси катионов
V и VI аналитических групп
22.1. Внешний вид
Так как соли катионов пятой группы окрашены, то по окраске раствора смеси можно предположить о наличии тех или иных ионов пятой группы. Катионы шестой группы бесцветны.
Анализ смеси производится дробным методом.
22.2. Открытие и отделение иона NH4+
В отдельной пробе (2-3 капли задачи) открыть катион аммония в газовой камере реакциями со щёлочью и реактивом Несслера. Сделать вывод.
Если открыт ион NH4+ , то его необходимо удалить, так как он мешает открытию иона К+. Для удаления иона аммония пользуются летучестью солей аммония при нагревании в щелочной среде.
22.3. Открытие иона калия
Обнаружить ион калия мешают катионы тяжёлых металлов: Cu2+, Co2+, Ni2+. Поэтому их нужно сначала отделить.
Для этого к 5-6 каплям анализируемой смеси добавить один шпатель сухой соды Na2CO3, смесь, перемешивая, нагревать 6-10 минут. При этой операции катионы пятой группы переходят в осадок (1) в виде гидроксокарбонатов, а ион NH4+ удаляется в виде NH3. В растворе (1), после центрифугирования, открывают ион калия реакцией с гексанитрокобальтатом (III) натрия (после доведения рН раствора до 4 или 5 путём добавления СН3СООН). Для ускорения выпадения осадка реакционную смесь нужно нагреть. Образование жёлтого осадка K2Na[Co(NO2)6] свидетельствует о присутствии иона К+.
22.4. Открытие иона никеля
Капельной реакцией с диметилглиоксимом открыть катион никеля. Ярко-розовое окрашивание свидетельствует о наличии иона никеля.
22.5. Открытие иона меди
В отдельной пробе открыть ион меди (II) реакцией с гексацианоферратом (II) калия. Образование красно-коричневого осадка (напоминающего шоколад) говорит о присутствии катиона меди.
