Полезные материалы за все 6 курсов / Ответы к занятиям, экзаменам / Биохимия в рисунках и схемах
.pdf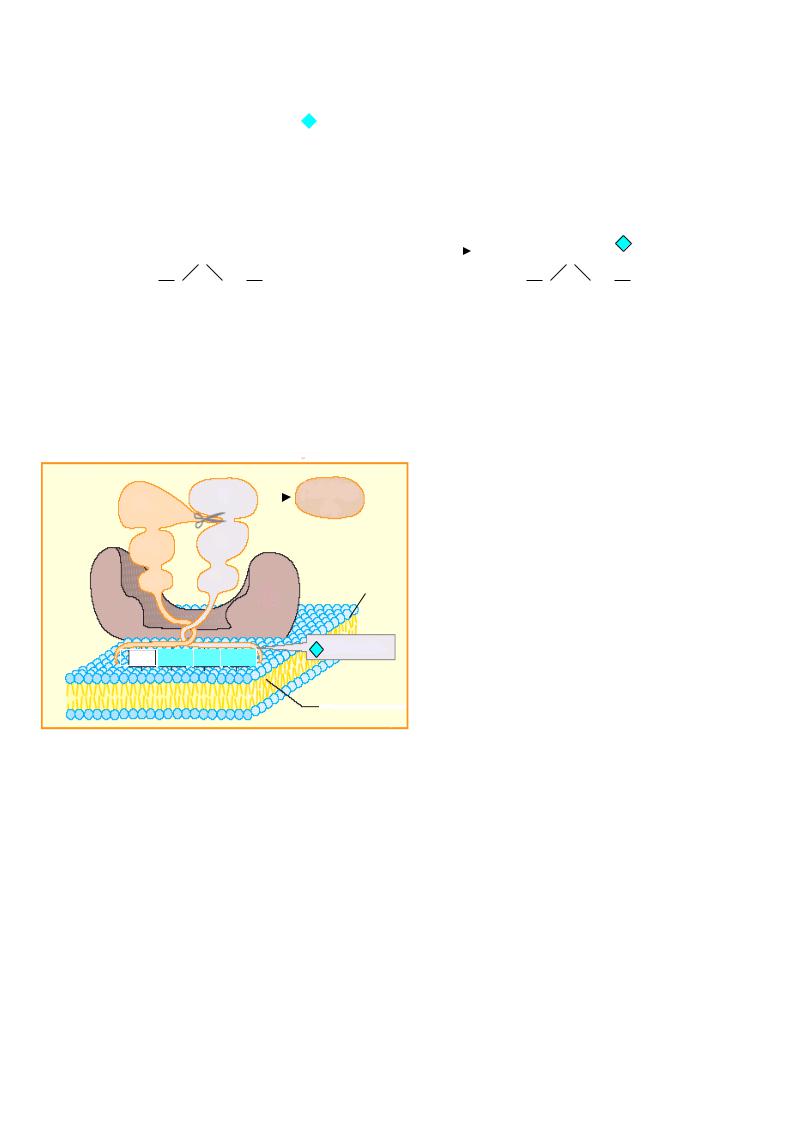
Белковые факторы свертывания II, VII, IX и X синтезируются в печени и содержат необычную аминокислоту,  γ-карбоксиглутаминовую (гла). Она образуется путем карбоксилирования глутаминовой кислоты в процессе посттрансляционной модификации (созревания) этих белковых факторов с участием витамина К:
γ-карбоксиглутаминовую (гла). Она образуется путем карбоксилирования глутаминовой кислоты в процессе посттрансляционной модификации (созревания) этих белковых факторов с участием витамина К:
γ |
|
СОО- |
|
γ |
|
СОО- |
||
|
|
|
||||||
|
СН2 |
витамин К |
|
СН |
СОО- |
|||
|
|
СН2 |
|
|
СН2 |
|
|
|
|
|
|||||||
|
|
СН |
|
|
|
СН |
||
|
|
|
||||||
белок СO NH белок белок СO NH белок
Авитаминоз К сопровождается повышенной кровоточивостью. Это наблюдается при нарушении всасывания жиров (например, при желчно-каменной болезни), что препятствует усвоению жирорастворимого витамина К.
Антагонисты витамина К , например, препараты группы кумарина ( дикумарин, неодикумарин, пелентан, синкумар), подавляют синтез активных факторов коагуляции и поэтому действуют как ингибиторы свертывания крови.
|
|
|
|
|
|
|
|
Остатки |
γ-карбоксиглутаминовой |
|||||
|
|
|
|
|
|
|
|
кислоты в белковых факторах |
(на |
|
рис. |
|||
|
Ха |
II |
|
|
IIа |
ф.Х, ф. II) |
группируются в особых |
|||||||
|
|
|
белковых доменах |
( |
гла-домены). |
|||||||||
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
Благодаря своим отрицательным зарядам |
||||||
|
|
|
|
|
|
|
|
они присоединяют ионы |
Са2+ |
, которые |
||||
|
|
|
|
|
|
|
фосфолипиды |
необходимы для связывания |
|
|
|
|||
|
|
|
|
|
|
|
соответствующих регуляторных |
|
|
|||||
|
|
|
|
|
Vа |
|
на |
|||||||
|
|
|
|
|
|
|
|
факторов |
с |
фосфолипидами |
||||
|
|
|
|
2+ 2+ 2+ |
|
|
гла-домен |
поверхности плазматической мембраны |
||||||
|
Са |
2+ |
Са |
|||||||||||
|
|
Са Са |
|
|
|
тромбоцитов. Вещества, способные |
|
|||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
мембрана |
связывать свободные ионы Са |
2+ |
в |
виде |
|||
|
|
|
|
|
|
|
комплекса, например |
|
цитрат, |
|||||
|
|
|
|
|
|
|
тромбоцитов |
|
||||||
|
|
|
|
|
|
|
предотвращают это взаимодействие с |
|
||||||
Протромбиназный комплекс |
|
|||||||||||||
|
|
|
|
|
|
|
|
фосфолипидами и тормозят свертывание. |
||||||
Внесосудистый (внешний) путь активации начинается с освобождения |
ф.III |
|||||||||||||
(тканевого тромбопластина) из поврежденных клеток ткани. В течение нескольких |
|
|||||||||||||
секунд этот фактор приводит к свертыванию крови в области раны.
Ф .III представляет собой интегральный мембранный белок, содержащий рецептор фактора VII.
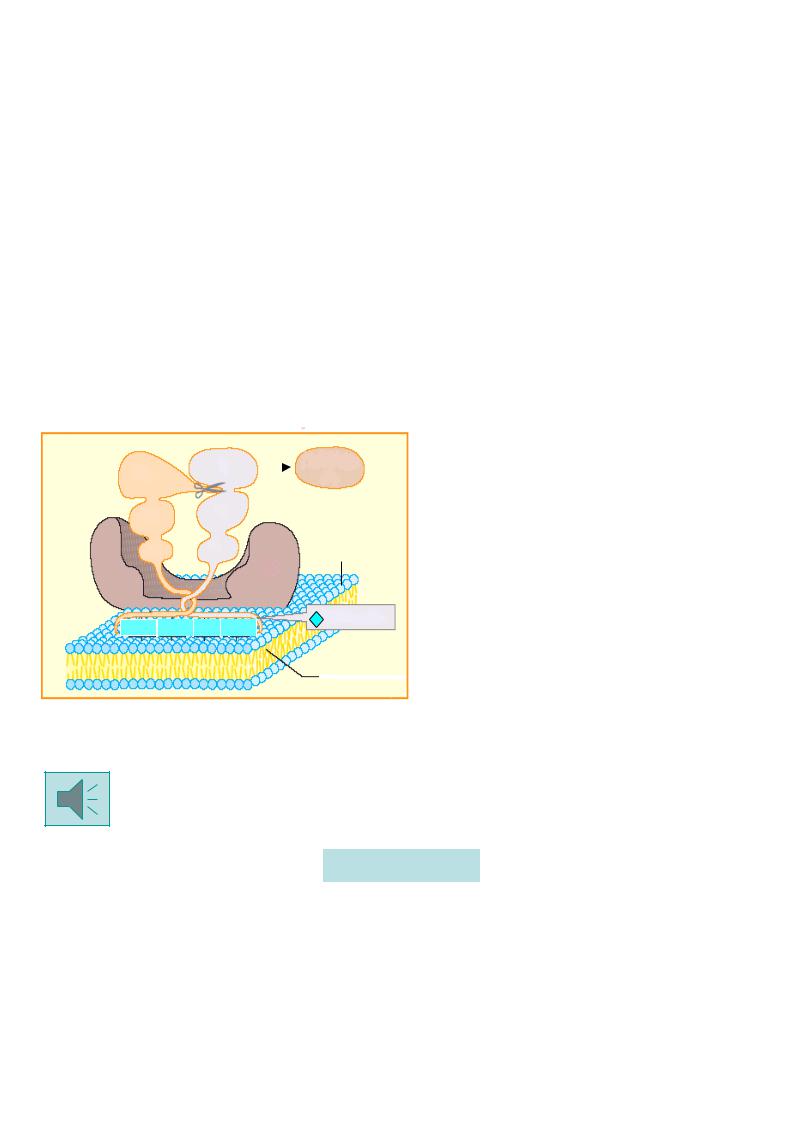
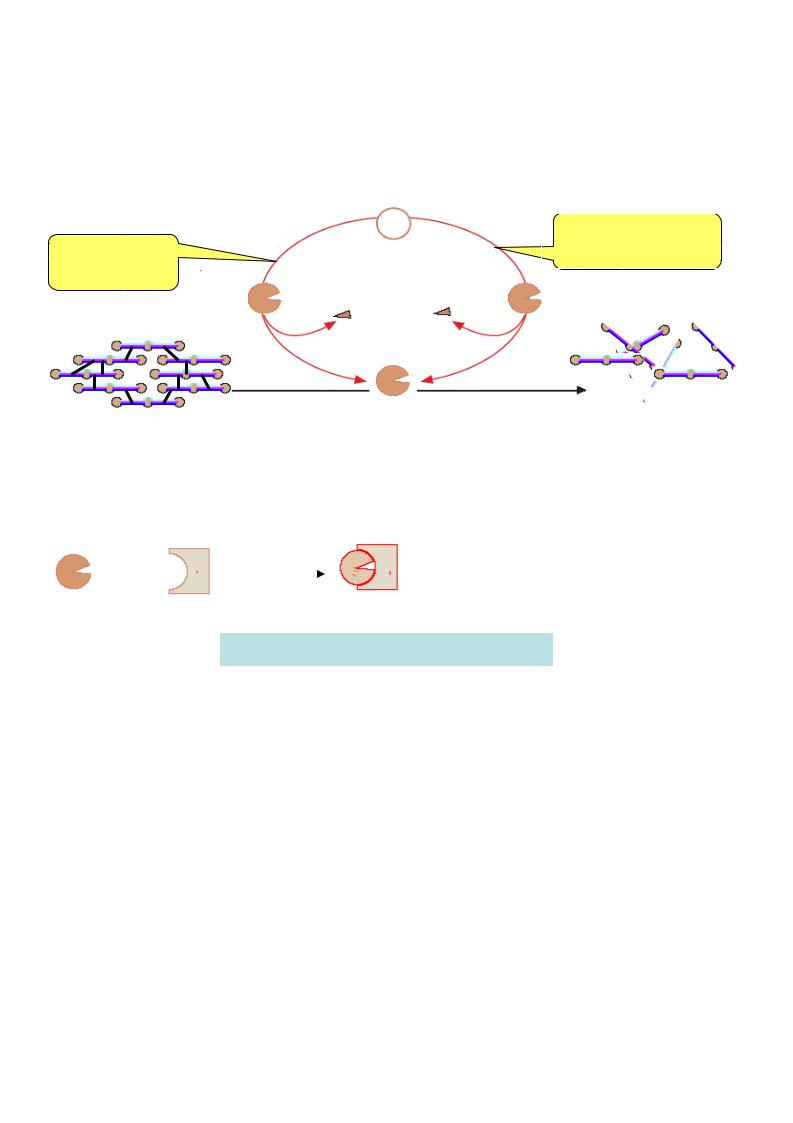
Ф.VII – гла-содержащий гликопротеин, функционирующий только во внешнем пути, быстро включается после повреждения ткани в активацию, превращаясь в VIIа (по принципу обратной положительной связи этому способствуют тромбин и ф.Ха). При этом образуется комплекс, аналогичный протромбиназному (см. рис. ), в который входят ф.VIIа, тканевой фактор III, Са2+ и ФЛ (фосфолипиды мембран).
Причем, активность ф.VIIа в комплексе с тканевым фактором и ионами кальция 200 возрастает в 10000 раз.
VIII. Обмен хромопротеинов
Хромопротеины – сложные белки, небелковой часть которых является окрашенный компонент (от греч. chroma – краска). Наиболее распространенные хромопротеины – это гемопротеины, содержащие в качестве небелковой части гем. К гемопротеинам относятся:
гемоглобин и его производные; миоглобин;
ферменты: цитохромы, каталаза, пероксидаза.
|
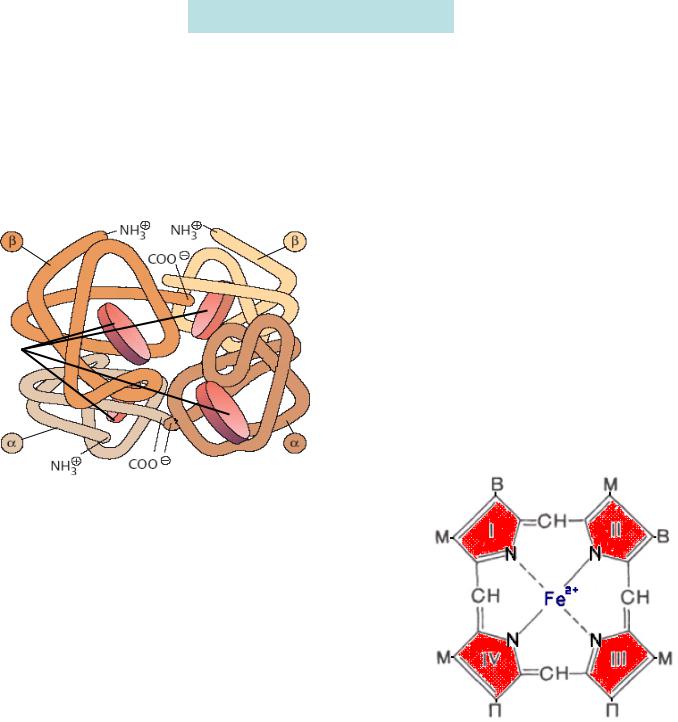
Гемоглобин (Hb) состоит из гема |
|
(небелковая часть) и белка глобина, |
|
который представлен четырьмя |
|
полипептидными цепями, каждая из |
|
которых пространственно окружает |
гем |
молекулу гема. В зависимости от |
комбинации типов полипептидных цепей |
|
|
различают виды гемоглобина: |
|
HbА1 – состоит из 2α- и 2β-цепей; |
|
HbА2 - состоит из 2α- и 2σ-цепей (2,5%); |
|
Hb F - состоит из 2α- и 2γ-цепей. |
Гем состоит из 4 пиррольных колец, содержащих метильные (М) и винильные (В) заместители. Азотсодержащие кольца связанны метиновыми мостиками, образуя порфириновое кольцо, а атомы азота связаны с железом: два азота – ковалентными связями, другие два азота – координационными связями. Кроме того, атом железа связан с аминокислотой гистидином белка глобина, а также имеет возможность для связывания лигандов:
кислорода или углекислого газа. |
Железо в |
гемоглобине двухвалентно (Fе2+). |
|
Болезни гемоглобинов называются гемоглобинозы (описано более 200):
гемоглобинопатии – наследственное изменение структуры одной из цепей глобина, например, серповидно-клеточная анемия , при которой в β-цепях гемоглобина глутаминовая аминокислота заменена на валин с образованием патологического Hb S; талассемии – генетически обусловлены нарушением синтеза какой-либо нормальной цепи гемоглобина, например, при β-талассемии в крови возрастает до 15% концентрация HbА2 и резко повышается Hb F .
Производные гемоглобина:
HbО2 –оксигемоглобин, HbСО2 – карбгемоглобин; |
|
HbСО – карбоксигемоглобин; HbОН – метгемоглобин. |
203 |

РАЗДЕЛ 11. БИОХИМИЯ ПЕЧЕНИ
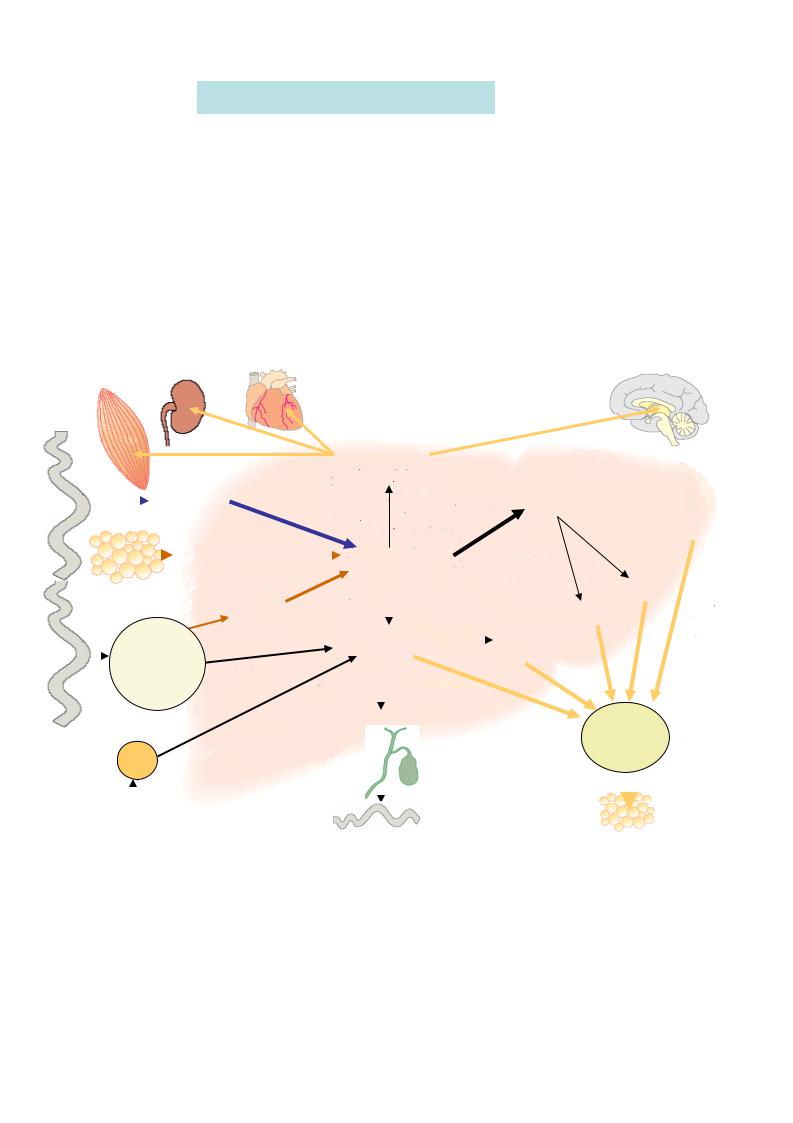
Печень играет жизненно важную, центральную роль в промежуточном обмене веществ. Особенности ферментативного аппарата печени и ее анатомических связей с другими органами дает возможность печени участвовать в регуляции практически всех видов обмена веществ и поддерживать постоянство концентрации в крови многих жизненно важных соединений.
Печень - большая промежуточная станция между портальным кругом и общим кровообращением организма, поэтому все вещества, всасывающиеся из кишечника, должны пройти через печень. Основные клетки печени – гепатоциты – занимают центральное место в реакциях промежуточного метаболизма, и в биохимическом отношении являются как бы прототипом всех остальных клеток организма.
Печень – самый крупный орган в |
вода |
- 70-75%; |
|
белки |
- 12-24%; |
||
организме человека (около 1,5 кг). Величина |
|||
и состав печени подвержены значительным |
липиды |
- 2-6%; |
|
колебаниям, зависящим от состава пищи, |
углеводы - 2-85; |
||
физиологического состояния организма и |
витамины |
|
|
других факторов. |
микроэлементы |
||
Функции печени обуславливают ее своеобразный “биохимический альтруизм”: происходящие в ней процессы настроены на производство различных веществ для других органов (биосинтез веществ “на экспорт”);
защиту этих органов от образующихся в них (или поступающих извне) токсических соединений.
Функции печени:
Регуляторно-гомеостатическая функция. Печень обеспечивает постоянство состава крови (гомеостаз) путем синтеза, депонирования и выделения в кровь различных метаболитов.
Депонирующая функция . Печень является важным депо углеводов (в виде гликогена), в ней накапливаются также белки, жиры, гормоны, витамины, минеральные вещества, составляющие метаболические резервы организма.
Обезвреживающая функция. В печени осуществляется биохимическая трансформация (обезвреживание) токсических веществ эндо- и экзогенного происхождения.
Экскреторная функция. Из печени ряд продуктов метаболизма либо выводится с желчью в кишечник (холестерин, желчные кислоты, желчные пигменты), либо попадают в кровь и оттуда выводятся почками. Нарушение этой функции неблагоприятно сказывается на переваривании и всасывании липидов, а также вызывает накопление токсических продуктов.
Метаболическая функция. В печени протекают основные биохимические процессы обмена углеводов, липидов и белков, а также микроэлементов, 207 биологически активных веществ (витаминов, гормонов, биогенных аминов и др.).
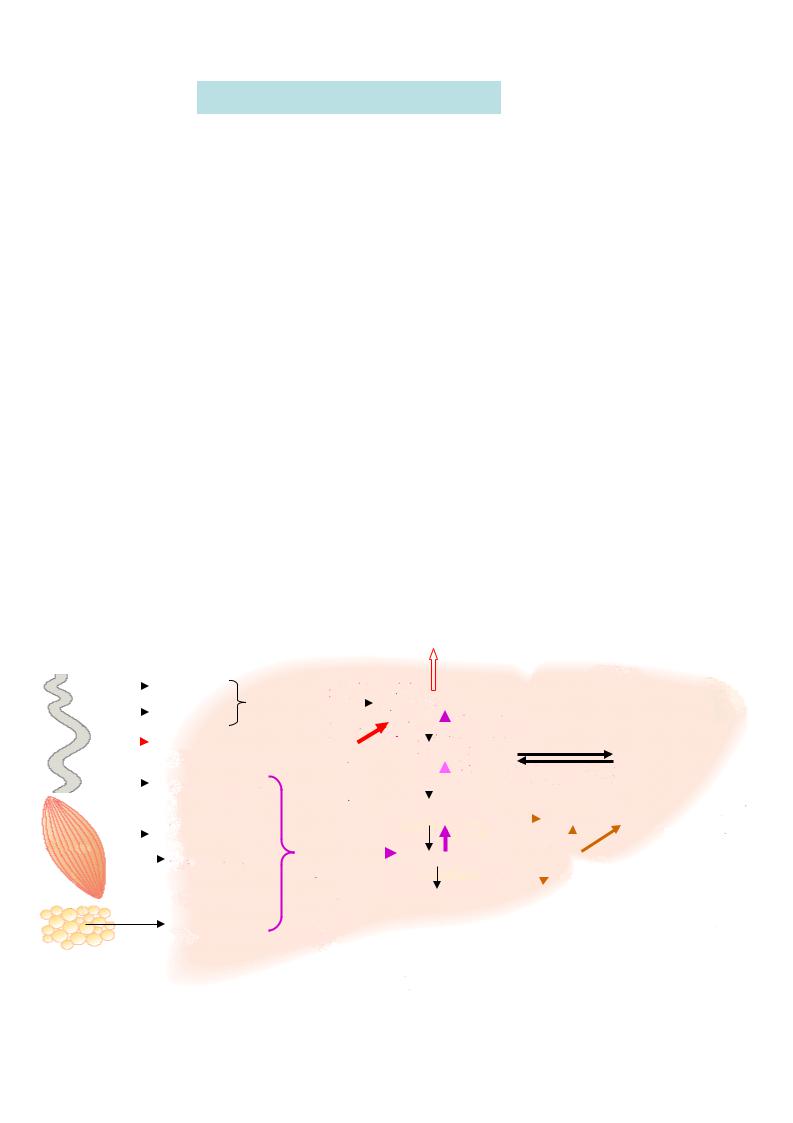
I. Регуляция углеводного обмена
Печень - практически единственный орган, поддерживающий постоянный уровень глюкозы даже в условиях голодания. Это достигается регуляцией скорости синтеза гликогенолиза и глюконеогенеза - с одной стороны, и синтеза гликогена - с другой стороны.
Пусковая реакция превращения глюкозы – фосфорилирование с образованием глюкозо-6-фосфата – в печени катализируется двуми ферментами: гексокиназай (активна при физиологических концентрациях глюкозы в крови) и специфической глюкокиназой (активируется при поступлении с пищей большого количества углеводов). Активность глюкокиназы в печени в 10 раз больше, чем гексокиназы, и она не ингибируется продуктом реакции, в отличие от гексокиназы.
Процессы синтеза и распада гликогена регулируются благодаря включению механизмов фосфорилирования главных ферментов обмена гликогена -
гликогенсинтазы и гликогенфосфорилазы. Активация аденилатциклазы гормонами запускает “каскадный “ механизм фосфорилирования этих ферментов, что приводит к образованию активной фосфорилазы и неактивной гликогенсинтетазы. Таким образом, усиливается распад гликогена. Включение механизма дефосфорилирования, наоборот, ведет к усилению синтеза гликогена. В печени также активен гликогенветвящий фермент - гликозил -(4-6)-трансфераза, образующий 1,6-гликозидные связи, т.е. точки ветвления в процессе синтеза гликогена.
В печени активны ферменты |
глюконеогенеза (ФЕП-карбоксикиназа, |
|
пируваткарбоксилаза, глюкозо-6-фосфататза |
), позволяющие превращать |
|
аминокислоты, лактат и глицерин в глюкозу в условиях уменьшения ее концентрации в |
||||||||||||||||||||||||
крови. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
глюкоза |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
галактоза |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
глюкоза |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
фруктоза |
конверсия |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
глюкоза |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гликоген |
||||
|
|
|
|
|
|
|
глюкозо |
-6 |
-фосфат |
|
|
|
|
|
||||||||||
|
|
|
|
аминокислоты |
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
3-фосфоглицериновый |
|
|
ТАГ |
|
ФЛ |
|
||||||||
|
|
|
|
аминокислоты |
|
|
|
|
|
альдегид |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
пируват |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ВЖК |
|
|
|
|
||||||
|
|
|
|
|
лактат |
глюконеогенез |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
ацетил-КоА 
глицерин
При расщеплении глюкозы в печени основное значение имеет не окисление ее до конечных продуктов – углекислого газа и воды, а запасание метаболитов, необходимых
для синтеза высших жирных кислот и глицерина, а следовательно, синтеза |
ТАГ, |
которые в составе ЛП транспортируются в жировую ткань. |
208 |