
Полезные материалы за все 6 курсов / Ответы к занятиям, экзаменам / Биохимия в рисунках и схемах
.pdf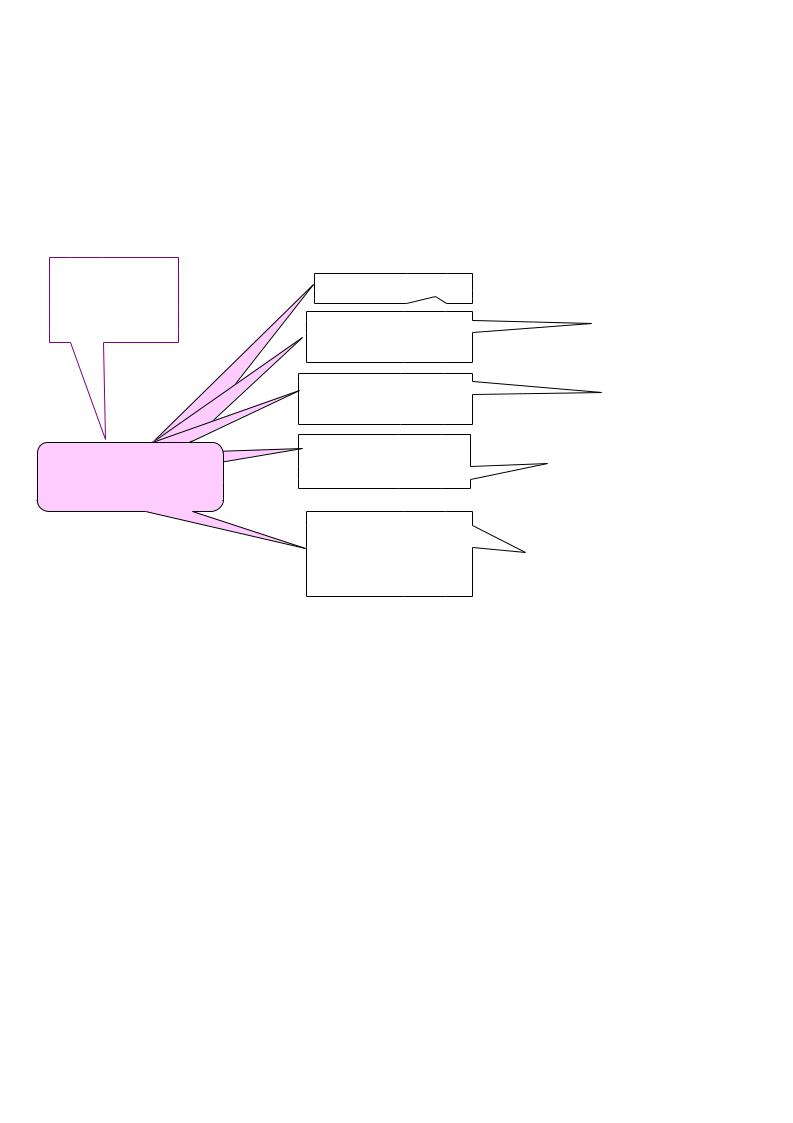
В организме человека в сутки распадается на аминокислоты около 400г белка , и столько же белка синтезируется. Причем необратимо распадается 1/4 часть аминокислот, которая должна восполняться за счет пищевых белков. В сутки взрослый человек должен получать 0,7г белка на 1 кг веса (100-150 г/сутки). Исключение белков из пищи даже на короткий срок приводит к серьезным нарушениям:
Снижено
потребление
белков
сниженсниженсинтез клеточных белков
клеточных белков
Белковое голодание (квашиоркор)
задержка роста |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
снижен синтез |
|
|
|
анемия |
|
|
|
гемоглобина |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
снижен синтез |
|
|
|
отеки |
|
|
|
альбуминов |
|
|
|
|
|
|
|
снижен синтез |
|
|
|
|
|
||
|
|
|
жировая |
|
|||
липопротеинов |
|
инфильтрация печени |
|
||||
атрофия клеток |
|
|
|
|
|
|
|
нарушено переваривание |
|
||||||
поджелудочной |
|
||||||
|
|
|
белков |
|
|||
железы |
|
|
|
|
|||
|
|
|
|
|
|
|
|
Белковое голодание опасно еще и потому, что в организме человека могут синтезироваться (из других метаболитов) только заменимые аминокислоты, другие – незаменимые - должны поступить с пищей, т.к. человеческий организм не обладает способностью их синтезировать. А поскольку для биосинтеза любого белка необходим полный набор аминокислот, при отсутствии незаменимых аминокислот трансляция (биосинтез белка) не будет начинаться (принцип «всё или ничего»).
Белки являются основными азотсодержащими соединениями в организме, поэтому для характеристики белкового обмена используется понятие «азотистый баланс», который характеризуется соотношением поступившего с пищей азота к выводимому азоту (Nпост./Nвыв.)
положительный азотистый баланс (Nпост./Nвыв. >0) – характерен для растущего
|
организма либо для периода реабилитации |
|
отрицательный азотистый баланс |
после болезни; |
|
(Nпост./Nвыв. <0) – характерен для |
|
|
|
усиленного распада белков (старение, |
|
азотистое равновесие |
голодание, тяжелые заболевания); |
|
(Nпост./Nвыв. = 0) – характерно для взрослого |
||
|
здорового организма при нормальном |
|
|
питании. |
90 |

I. Переваривание белков |
|
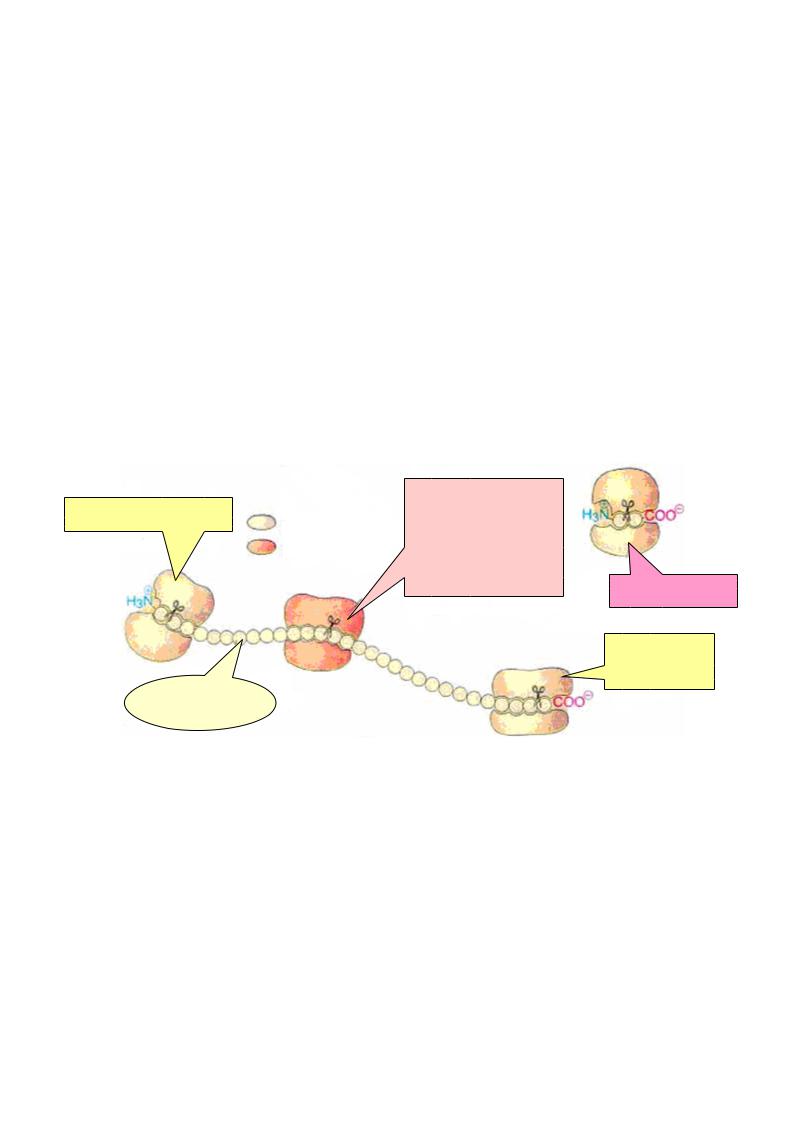
Переваривание белков - э то ферментативный гидролиз ( протеолиз) |
пептидных |
связей в молекуле белка, в результате чего образуются свободные аминокислоты.
радикалы
аминокислот
…
N-конец |
|
|
|
|
|
|
|
|
|
С-конец |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
пептидная связь |
|
|
||||||
цепи |
|
|
|
|
цепи |
|
|||||
Переваривание белков осуществляется с помощью гидролаз, называемых |
|
|
|||||||||
протеолитическими ферментами , (протеазами или пептидазами) |
, которые |
|
|||||||||
вырабатываются в неактивном |
виде |
( проферменты или зимогены ) |
и |
||||||||
активируются |
путем частичного протеолиза, т.е. гидролиза одной пептидной связи |
||||||||||
с отщеплением ингибирующего |
N-концевого пептида . Это сопровождается |
|
|||||||||
изменением конформации фермента и раскрытием его активного центра: |
|
|
|||||||||
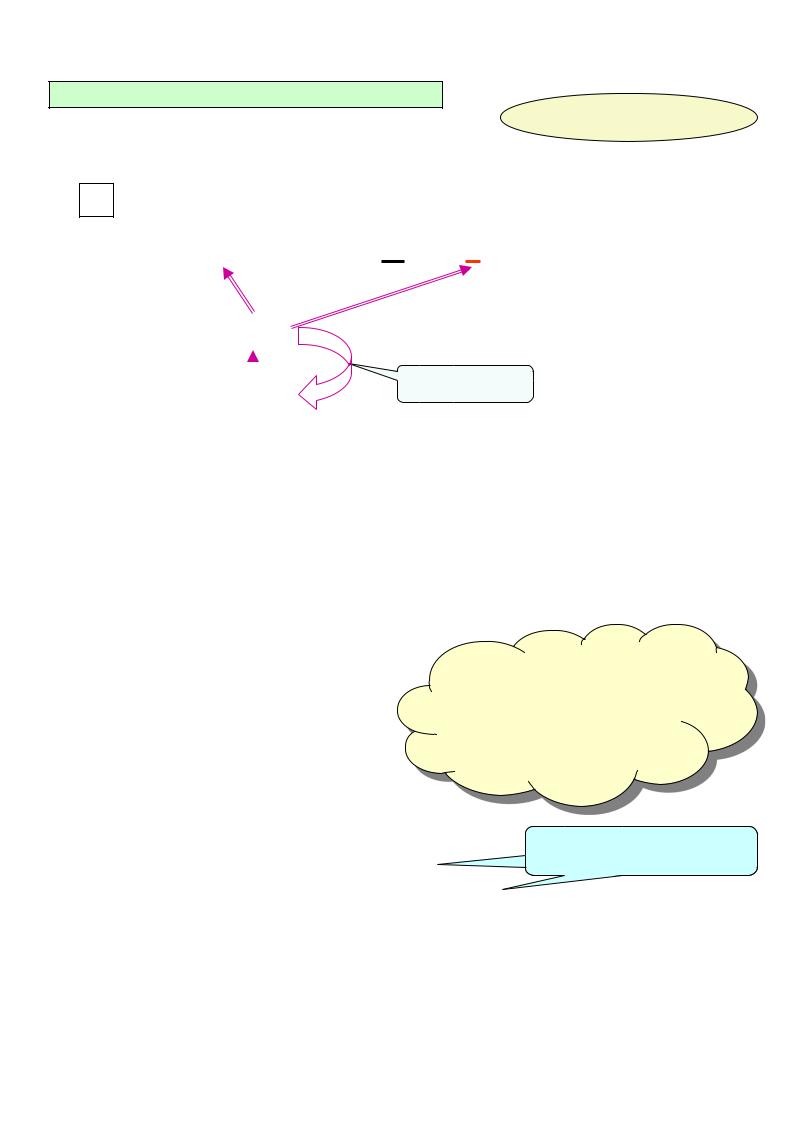
Н2О
неактивный фермент (профермент или зимоген)
аутокатализ
N-концевой |
активный фермент |
полипептид |
При этом образовавшийся в результате частичного протеолиза активный фермент может действовать на свой профермент, переводя его в активное состояние, т.е. осуществлять аутокатализ (активирует сам себя).
Место синтеза проферментов (слизистая желудка, поджелудочная железа) и место их активации (полость желудка, тонкой кишки) пространственно разделены . Это необходимо для защиты секреторных клеток желудка и поджелудочной железы
от самопереваривания.
Преждевременная активация проферментов в секреторных клетках происходит при язве желудка (активируется пепсин), при остром панкреатите (активируется трипсин).
91
В норме активация зимогенов в поджелудочной железе предотвращается ингибитором трипсина, образующим с ферментом очень прочный комплекс. В желудке и кишечнике внутренние поверхности покрыты муцинами – гликопротеинами слизи, которые защищают эпителий ЖКТ от разрушений ферментами.
По месту атаки молекулы субстрата протеолитические ферменты делятся на экзопептидазы и эндопетидазы.
Протеазы, или пептидазы, которые гидролизуют пептидную связь у концевой аминокислоты, называются экзопептидазы.
К ним относятся аминопептидаза, отщепляющая крайнюю аминокислоту с N-конца белковой молекулы и карбоксипептидаза, гидролизующая пептидную связь с С-конца молекуля белка, а также ди- и трипептидазы , расщепляющие соответственно дитрипептиды.
Пептидные связи, удаленные от концов молекулы белка, гидролизуют
эндопептидазы: пепсин, трипсин, химотрипсины, эластаза . В зависимости от наличия в их активном центре аминокислот серина, цистеина и др, различают сериновые протеазы, цистеиновые протеазы и т.д.
аминопептидаза эндопептидазы экзопептидазы
аминокислотный
остаток
Эндопептидазы: |
|
пепсин |
|
трипсин |
|
химотрипсины |
|
эластаза |
дипептидазы |
|
|
|
карбокси- |
|
пептидаза |
Все пептидазы обладают относительной специфичностью , т.е. расщепляют все белки, однако, каждый из этих ферментов преимущественно гидролизует пептидные
связи между определенными аминокислотами: |
|
|
пепсин гидролизует пептидные связи у ароматических аминокислот ( |
фенилаланин и |
|
тирозин) и между лейцином и глутаматом; |
|
|
трипсин расщепляет преимущественно связи у аргинина и лизина; |
|
|
химотрипсин -у ароматических аминокислот |
фенилаланина, |
тирозина и |
триптофана; |
|
|
эластаза – между глицином и аланином. |
лекарственных средств |
|
Протеолитические ферменты применяются в качестве |
||
(ацидинпепсин, фестал, панкреатин) при нарушении секреции желудочного сока, при воспалении поджелудочной железы и т.д. Кроме того, в клинике протеазы
применяются для обработки гнойных ран (расщепляют белки гнойного содержимого).
92
ПЕРЕВАРИВАНИЕ БЕЛКОВ В ЖЕЛУДКЕ
Для пепсина рНопт 1,5-2.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
фенил |
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|||||||||||
|
|
|
|
H |
O |
|
|
тирозин |
|
H |
O |
|
аланин |
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
O |
|
|
|
H |
|
|
|
|
|
O H |
O |
|
H |
|
|
O H |
O |
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н2N-CH-C |
|
N-CH-C |
|
|
|
N-CH |
-C |
|
|
|
N-CH-C |
|
N-CH |
-C |
N-CH-C |
|
N-CH-C |
|
N-CH-C-OH |
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пепсин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
НCl |
|
|
|
|
|
|
|
|
|
|
|
|
аутокатализ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
пепсиноген |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В желудке действует фермент пепсин, который вырабатывается главными клетками
слизистой оболочки желудка в виде неактивного профермента |
пепсиногена. Этот |
зимоген активируется частичным протеолизом с помощью |
соляной кислоты |
(медленно), а затем с помощью аутокатализа (быстро). Пепсин, обладая относительной специфичностью, преимущественно гидролизует пептидные связи у ароматических аминокислот (фенилаланина и тирозина).
В желудке также действует пепсиноподобный фермент |
гастриксин, у которого |
||
рНопт = 3, т.е. этот фермент переваривает белки при пониженной кислотности |
|||
желудочного сока. |
|
|
|
Функции соляной кислоты: |
|
|
У грудных детей |
|
|
в желудке фермент реннин |
|
|
|
|
|
денатурирует белки |
катализирует створаживание молока, |
||
создает сильнокислую среду рН 1,5 – 2 |
|
переводя растворимый белок |
|
активирует пепсин |
казеиноген в нерастворимый казеин, |
||
разрушает микроорганизмы |
|
который далее расщепляется |
|
|
|
|
пепсином |
Нарушение переваривания белков в желудке |
|
|
|
Гиперхлоргидрия –повышенная продукция НСI. |
гипоацидные состояния |
||
Гипохлоргидрия - пониженная продукция НСI. |
|
|
рН 3 - 5 |
Ахилия - отсутствие в желудочном соке НСI и пепсина
(при полной ахилии или тотальной резекции желудка может развиваться пернициозная анемия, т.к. отсутствует внутренний фактор Касла – гастромукопротеин, необходимый
для всасывания витамина В12) |
|
Молочная кислота (лактат) |
в желудочном соке в норме отсутствует. Может |
обнаруживаться при злокачественных опухолях желудка |
|
93 |
(активируется анаэробный гликолиз). |
аминопептидаза
R R
ПЕРЕВАРИВАНИЕ БЕЛКОВ В КИШЕЧНИКЕ
|
|
фенилаланин |
|
|
|
|
|
|
|
|
аргинин |
|
тирозин |
|
|
|
глицин |
|
|
|
|
лизин |
|
триптофан |
|
R |
|
аланин |
|
R |
|
R |
|
|
|
|
|
|
|
|
|
|
|
O H O H |
O H O H O H O H O H O |
|||||||||||||||||||||||||||||||||||||||||
Н2N-CH- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
N-CH |
|
|
|
|
|
N-CH-C |
|
|
|
N-CH-C N |
-CH-C |
|
N-CH-C |
|
N-CH-C |
|
|
|
N-CH-C-OH |
|||||||||||||||||||||
|
-C |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
химотрипсин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
трипсин |
эластаза |
карбоксипептидаза |
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
энтеропептидаза |
|
|
|
химотрипсиноген |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
трипсиноген |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
проэластаза |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
прокарбоксипептидаза |
||||||||||
В кишечнике (рН 7-8) |
действуют ферменты поджелудочной железы : трипсин, |
|||||||||||||||||||||||||||||||||||||||||
химотрипсины, эластаза, карбоксипептидаза, вырабатываемые в неактивном виде.
Эти проферменты активируются в кишечнике: трипсиноген активируется кишечным
ферментом |
энтеропептидазой, химотрипсиноген, проэластаза и |
|
|
прокарбоксипептидаза |
активируются самим активным |
трипсином. |
|
Аминопептидаза и дипептидазы – ферменты кишечного сока, вырабатываются в активном состоянии.
В результате суммарного действия всех желудочных, панкреатических и кишечных
пептидаз происходит полный гидролиз пищевых белков и образуются |
свободные |
аминокислоты, которые всасываются в стенку кишечника путем активного |
|
транспорта, поступают в кровь и разносятся к органам и тканям. Свободные |
|
аминокислоты, в отличие от белков, лишены видовой специфичности и не обладают антигенными свойствами.
Пути превращения аминокислот
Часть аминокислот в результате потери аминогруппы (процессы дезаминирования и трансаминирования) превращается в α-кетокислоты (безазотистые остатки), которые
могут быть: |
|
|
использованы на синтез глюкозы – |
глюконеогенез (такие аминокислоты называются |
|
гликогенные), |
|
|
использованы на синтез липидов, кетоновых тел – |
кетогене з (такие аминокислоты |
|
называются кетогенные), |
|
|
окислены до конечных продуктов с образованием СО2, воды и энергии. |
||
Отщепившаяся аминогруппа в виде |
аммиака |
NH3 (токсичное вещество ), |
превращается в мочевину (конечный продукт азотистого обмена) и выводится через |
|
почки с мочой. |
|
Часть аминокислот распадается путем отщепления карбоксильной группы |
|
(декарбоксилирование) в виде СО2 с образованием продуктов, которые называются |
|
биогенные амины. |
94 |
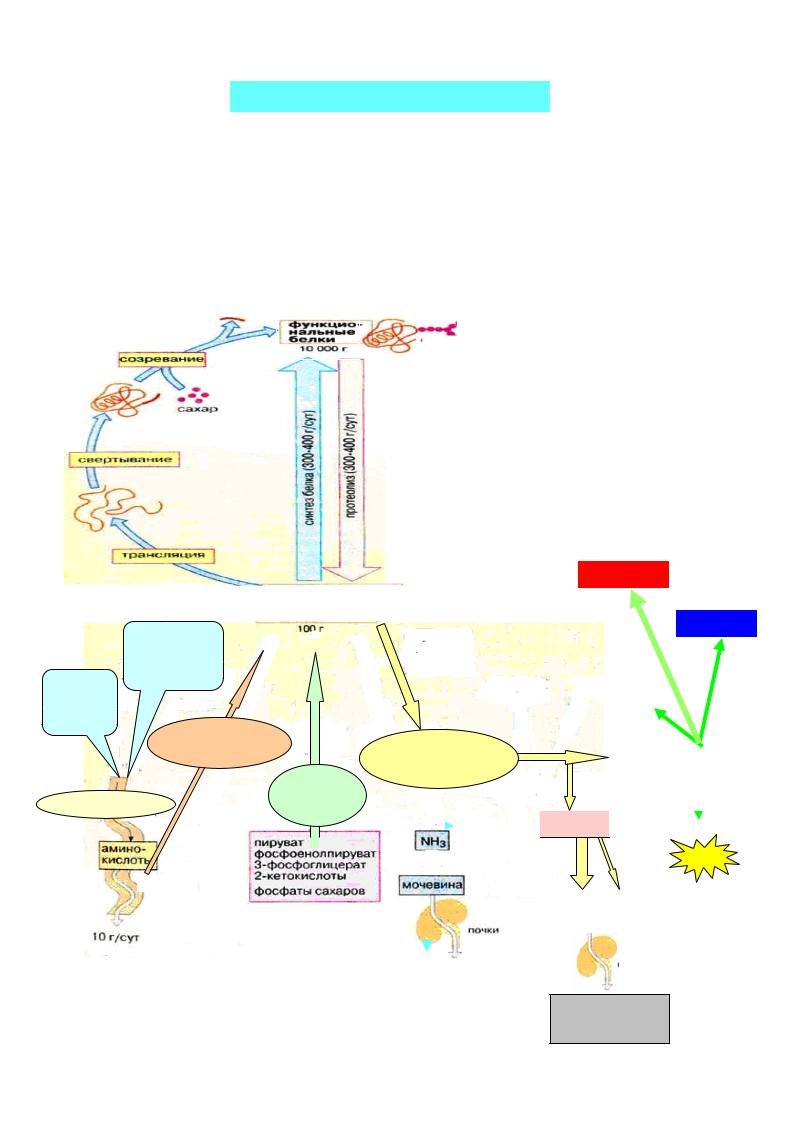
II.Пути превращения аминокислот
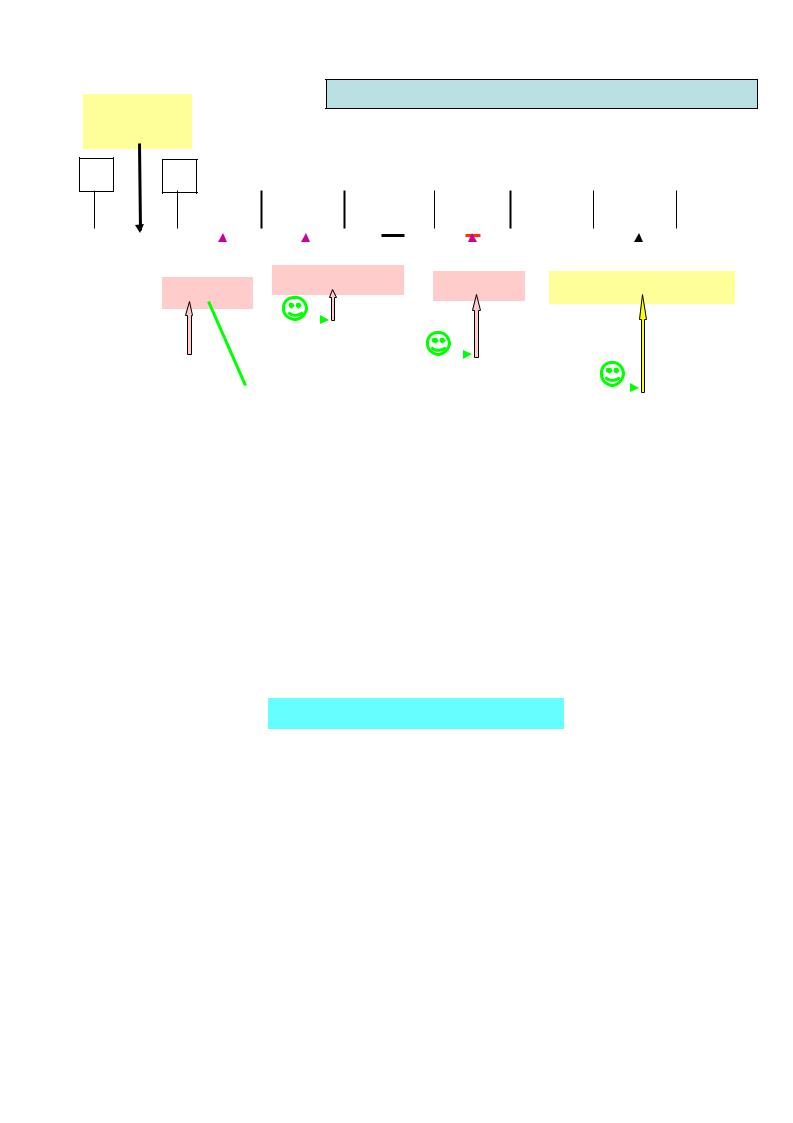
Вотличие от жиров и углеводов, в организме не существует депо белков. Своеобразным депо является пул аминокислот , т.е. количество свободных аминокислот, которые образуются:
за счет всасывания в кишечнике,
при распаде (протеолизе) собственных белков организма, путем синтеза de novo (заменимые аминокислоты).
|
|
Функциональные |
||
|
|
белки |
|
|
|
|
10000г |
|
|
созревание |
||||
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Свободные аминокислоты |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
используются прежде всего на |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
синтез собственных |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
функциональных белков |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
организма: |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
структурных белков, ферментов, |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рецепторов, гормонов, белков |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
плазмы крови и т.д. |
||||||||||||||
|
|
|
|
|
|
трансляция |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
глюкоза |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пул |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
аминокислот |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
секреция |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
липиды |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
100 г |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
белка |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
50г/сутки |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
пища |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кетоновые |
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
50-100 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
тела |
|
|
|
|
|||
г/сутки |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
всасывание |
|
|
|
|
деградация |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
до 150г/сутки |
|
|
|
|
|
|
|
|
|
|
ά-кето-кислоты |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
50-100г/сутки |
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
переваривани |
|
|
|
|
|
|
|
|
|
|
cинтез |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
de novo |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СО2 |
|
|
NН3 |
|
|
СО2 , Н2О |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пируват |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
амино- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
АТ |
|||||||
|
|
кислоты |
|
|
|
|
|
|
фосфоенолпируват |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ф |
|||||||||||||||||
|
|
|
|
|
|
|
кишечник |
|
|
|
3-фосфоглицерат |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
мочевина |
|
соли |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ά-кетокислоты |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
глюкоза |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
аммония |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
выведение с |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
фекалиями |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
почки |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
биогенные |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
10г/сутки |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
амины |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
95 |
выведение с |
мочой |

ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ

Катилизируют эту реакцию аминотрансферазы (трансаминазы). Коферментом в этих
реакциях является пиридоксальфосфат (ПАЛФ) |
– активная форма витамина В |
6, |
который как посредник, принимает аминогруппу от |
аминокислоты и превращается |
в |
пиридоксаминфосфат (ПАМФ). Ферменты этой реакции органоспецифичны: АлАТ –
аланинаминотрансфераза больше локализована в печени, |
АсАТ |
– |
аспартатаминотрансфераза – в сердце; при повреждении клеток этих органов |
|
|
ферменты переходят в кровь. Определение их активности в сыворотке крови |
|
|
(энзимодиагностика) является важным методом для обнаружения и клинического |
|
|
контроля таких нарушений: при заболевании соответствующих органов |
(гепатит, |
|
инфаркт миокарда) активность этих индикаторных ферментов возрастает в 20-30 раз.
Основными |
донорами |
|
|
Значение реакции трансаминирования |
|||||||||
аминогрупп в реакциях |
|
коллекторная функция – собирание аминогрупп от |
|||||||||||
трансаминирования |
|
разных аминокислот в виде глутаминовой кислоты |
|||||||||||
являются |
глутамат, |
|
с помощью этой реакции синтезируются заменимые |
||||||||||
аспартат и аланин. |
|
аминокислоты; |
|
|
|
||||||||
Основным |
акцептором |
|
происходит перераспределение аминного азота в тканях; |
||||||||||
аминогрупп |
|
от |
|
эта реакция является начальным этапом катаболизма |
|||||||||
различных аминокислот |
|
аминокислот, первой стадией непрямого дезаминирования; |
|||||||||||
является |
|
|
|
|
|
благодаря реакции трансаминирования углеродный |
|||||||
α-кетоглутарат. |
|
скелет аминокислот может включаться в другие обмены. |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
НЕПРЯМОЕ ДЕЗАМИНИРОВАНИЕ |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
NН3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
глутаматдегидрогеназа |
|
|
|
|
|
|
|
|
|
|
|
|
α-кетоглутарат |
|||||
α-кетоглутарат |
|
глутамат |
|
|
|||||||||
|
|
|
|
|
|||||||||
|
|
1 |
|
|
|
|
|
|
Аминокислоты, |
|
которые |
||
|
|
|
|
|
|
|
|
|
не могут |
дезаминироваться |
|||
|
|
|
|
|
|
|
|
|
прямо, подвергаются |
||||
|
|
|
|
|
|
|
|
|
непрямому дезаминированию |
||||
|
|
|
|
|
|
|
|
|
или трансдезаминированию, |
||||
|
аминокислота α-кетокислота |
которое включает 2 этапа: |
|||||||||||
|
|
|
|
|
|
||||||||
1 –трансаминирование аминокислоты с ά-кетоглутаровой кислотой (при этом |
|||||||||||||
образуется глутаминовая кислота, |
|
|
|
|
|
||||||||
2 – прямое окислительное дезаминирование глутаминовой кислоты |
с образованием |
||||||||||||
свободного аммиака. |
|
|
|
|
|
|
|
|
|||||
Глутаматдегидрогеназа, катализирующая 2-й этап трансаминирования, - регуляторный аллостерический фермент (его ингибитор НАДН), от активности которого зависит
скорость непрямого дезаминирования ряда аминокислот, |
а значит, и |
97 |
образования NН3. |
|
|
|
|
|
|
|
III. Обмен аммиака |
|
|
|
|
|
аминокислоты |
|
|
|
|
|
|
Источники аммиака: |
|||
|
|
|
|
|
биогенные амины |
|
прямое и непрямое |
||||
|
|
|
|
|
|
|
|
|
|
дезаминирование аминокислот; |
|
|
нуклеотиды |
|
|
|
гниение белков |
|
обезвреживание биогенных |
||||
|
|
|
|
|
|
|
аминов; |
||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
дезаминирование пуриновых и |
|
|
|
|
|
|
|
|
|
|
|
пиримидиновых нуклеотидов; |
|
|
|
|
|
NН3 |
|
|
|
|
|||
|
|
|
|
|
|
|
гниение белков в кишечнике. |
||||
|
|
Аммиак – токсичное соединение. В высоких концентрациях он поражает |
|||||||||
|
|
||||||||||
|
|
главным образом нервные клетки. |
Причины токсичности аммиака: |
||||||||
Аммиак связывает α-кетоглутарат (восстановительное аминирование) |
|||||||||||
|
|
|
|
|
|
|
НАДФНН+ |
+ |
|||
|
|
|
|
|
|
|
|
|
|
НАДФ |
|
|
|
|
NН3 |
+ α-кетоглутарат |
|
|
|||||
|
|
|
|
|
|
глутамат |
|||||
|
|
|
|
|
|
||||||
При этом α-кетоглутарат выводится из пула аминокислот, значит, угнетаются те реакции, для которых он необходим:
ЦТК (возникает гипоэнергетическое состояние);
обмен аминокислот (нарушается трансаминирование).
Аммиак усиливает синтез глутамина в нервной ткани, что ведет к повышению осмотического давления и в высоких концентрациях может вызвать отек мозга.
|
|
|
|
АТФ |
АДФ + Ф |
|
|
NН3 |
+ |
|
|||
|
|
глутамин |
||||
|
глутамат |
|||||
Аммиак в крови находится в виде иона NН4+ |
|
|||||
|
NН |
+ |
Н+ |
|
|
NН +, |
|
|
|||||
|
3 |
|
|
|
|
4 |
|
|
|
|
|
||
накопление катиона аммония нарушает перенос ионов (Na+, К+ ) через мембрану, что
ухудшает проведение нервных импульсов.
Обезвреживание аммиака
|
|
NН3 |
|
|
Синтез |
|
|
|
Образование |
глутамина |
Образование |
|
|
|
Синтез |
Образование |
глутамата |
||
|
аланина |
|
||
|
аммонийных |
|
||
|
|
мочевины |
|
|
|
|
солей |
|
|
|
|
25г/сутки |
|
|
|
|
0,5г/сутки |
|
|
|
|
|
|
|
мозг и |
мышцы, |
печень |
|
|
другие ткани |
кишечник |
почки |
мозг 98 |

IV. Пути обезвреживания аммиака
1. Образование транспортных форм аммиака |
|
Конечными продуктами обмена аммиака являются |
мочевина и аммонийные соли , |
которые образуются соответственно в печени и почках и выводятся из организма через почки в составе мочи. Однако аммиак образуется во всех органах и тканях, особенно интенсивно при напряженной мышечной работе, нервном возбуждении и т.д. Поэтому доставка аммиака к местам окончательного обезвреживания (печень и почки)
осуществляется с помощью транспортных форм.
Главной транспортной формой аммиака является глутамин, который легко проникает через клеточные мембраны, так как представляет
собой нейтральную аминокислоту: |
АТФ |
АДФ + Ф |
||
|
NН3 |
+ глутамат |
||
|
|
глутамин |
||
|
|
|
глутаминсинтетаза |
|
|
Благодаря этой реакции в норме поддерживается низкая |
|||
|
концентрация аммиака |
в крови (25-40 мкмоль/л) |
||
Глутамин попадает в кровь из различных тканей, в основном, из мышц и мозга и транспортируется главным образом в почки, печень и кишечник , где активен фермент глутаминаза, отщепляющая от глутамина свободный аммиак:
|
|
|
|
|
|
|
|
Н2О |
|
|
|
|
|
|
|
|
|
|
|
|
глутамин |
|
|
|
|
глутамат |
+ |
NН3 |
|
|
|||||||
|
|
глутаминаза |
|
|
|
|
|
|||||||||||
|
|
|
|
|||||||||||||||
|
Из кишечника и мышц аммиак выводится в виде |
|
|
|
|
|
||||||||||||
|
аланина (глюкозо-аланиновый цикл) |
|
|
|
|
|
|
|||||||||||
Работающая мышца получает часть энергии за счет |
|
|
|
|
|
|||||||||||||
распада аминокислот. Аминогруппы |
|
|
|
|
от |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
||||||||||
различных аминокислот в процессе реакции |
|
|
|
|
|
|
|
|
||||||||||
трансаминирования оказываются в |
глутамате. |
|
|
|
|
|
||||||||||||
Далее глутамат трансаминируется с |
пируватом, |
|
|
|
|
|
||||||||||||
который образуется в работающей мышце из |
|
|
|
|
|
|
||||||||||||
глюкозы в результате гликолиза. В результате этой |
|
|
|
|
|
|||||||||||||
реакции образуется аланин, который «несет в себе» |
|
|
|
|
|
|||||||||||||
аминогруппы |
из |
мышечных белков и углеродный |
|
|
|
|
|
|||||||||||
скелет из глюкозы |
: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
+ |
|
|
|
|
|
|
|
+ |
|
аланин |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
пируват |
|
|
|
|
|
|
|
|
|
|
|||||||
глутамат |
|
|
|
|
α-кетоглутарат |
|
|
|
|
|
|
|||||||
Образовавшийся |
аланин через кровь поступает в |
|
|
|
|
|
||||||||||||
печень, где подвергается непрямому дезаминирова- |
|
|
|
|
почки |
|||||||||||||
нию. Полученный аммиак обезвреживается с |
|
мочевина |
|
|
||||||||||||||
|
|
|||||||||||||||||
образованием мочевины, а пируват превращается в |
|
|
|
|
|
|||||||||||||
99 |
глюкозу, которая снова питает мышцы. |
|
|
|
Выведение с мочой |
|||||||||||||
