
Полезные материалы за все 6 курсов / Ответы к занятиям, экзаменам / Биохимия в рисунках и схемах
.pdf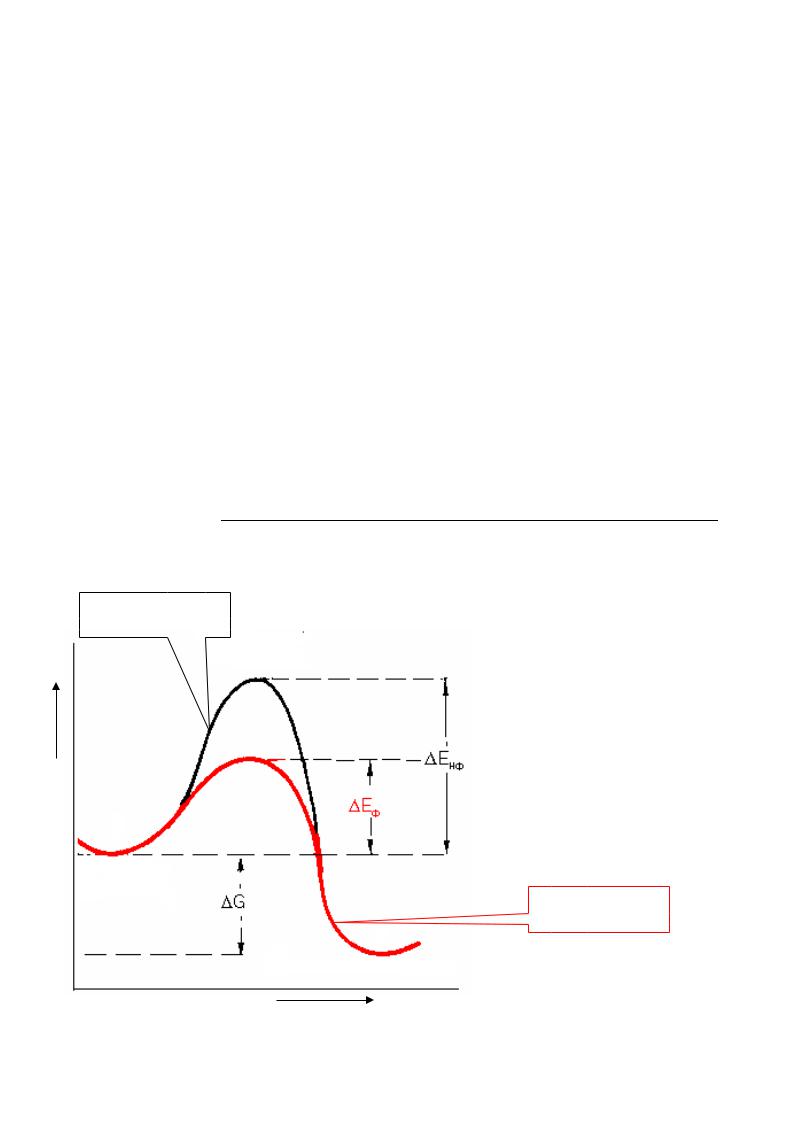
VIII. Общие представления о катализе
•Разница между свободной энергией исходных веществ и продуктов реакции определяет вероятность протекания этой реакции.
•Если у исходных веществ она выше, то возможно самопроизвольное протекание реакции (экзергоническая), если наоборот - реакция энергетически невозможна (эндергоническая).
•Скорость экзергонических реакций зависит от энергетического барьера, т.е. энергии активации - это то дополнительное количество энергии (напр.,
нагревание), которое необходимо сообщить молекулам реагирующих веществ, чтобы они вступили в химичекую реакцию.
Катализатор (фермент) не влияет на свободную энергию исходных веществ
и продуктов, но он влияет на энергетический профиль, т.е. в присутствии катализатора реакция идет через низкий энергетический барьер.
•Таким образом, ферменты снижают энергию активации реакции , в
результате чего скорость ферментативной реакции резко возрастает по сравнению с неферментативной.
свободная
10
неферментативная
реакция
переходное
состояние
энергия активации неферментативной реакции
энергия активации ферментативной реакции
S
исходное
состояние
ферментативная
реакция
P
конечное
состояние
ход реакции

IX. Механизм дейcтвия ферментов
В классическиех работах Михаэлиса и Ментен процесс ферментативного катализа делится на три стадии:
E+S |
|
k1 |
ES |
ES* |
|
EP |
k2 |
E+P |
|
|
|
|
|
||||||
|
|
k-1 |
|
|
|
|
|
|
|
•1 . Диффузия субстрата к ферменту и образование ЕS-комплекса, проходит быстро и обратимо.При этом реализуется точное пространственное, геометрическое,
электростатическое соответствие (комплиментарность) между активным центром фермента и субстратом.
•2 . Преобразование первичного ES-комплекса в активированные ЕS*- проходит медленно, идет расшатывание связей субстрата с помощью функциональных групп
фермента. При этом снижается энергия активации реакции.
•3 . Отделение продуктов реакции от активного центра и диффузия их в среду. Фермент при этом не входит в состав конечных продуктов реакции.
Эффективность ферментативного катализа объясняется следующими молекулярными эффектами:
Ориентация реагентов
Субстрат соединяется с ферментом по меньшей мере в трех точках (трехточечнпя фиксация), что обуславливает высокую избирательность (комплиментарность) связывания и ориентацию субстрата и это обеспечивает увеличение скорости реакции в сотни и тысячи раз (что невозможно при беспорядочных взаимодействиях).
Напряжение и деформация
При связывании с активным центром молекула субстрата деформируется, напрягается, места деформации легче разрываются.
Кислотно-основный катализ
Ферменты, будучи белками, имеют в активном центре и кислые и основные группы, поэтому могут быть как донорами, так и акцепторами протонов, что невозможно для неорганических катализаторов. Это облегчает перестройку и разрыв связей в субстрате (так, например, функционирует остаток аминокислоты гистидина в активном центре , при его блокировании фермент теряет активность).
Ковалентный катализ
Ферменты могут иметь в активном центре группы, способные образовывать
ковалентные связи с субстратом, давая неустойчивые |
ES-комплексы, быстро |
освобождающие продукты реакции. |
|
Как правило, для ферментов характерно сочетание всех этих механизмов, что и |
|
обеспечивает их феноменальную активность. |
11 |

X. Кинетика ферментативных реакций
• Исследует закономерности влияния химической природы реактантов и различных внешних условий (рH, температура и т.д.) на скорость ферментативной реакции для выяснения механизма биохимических процессов.
“Изучить кинетику и не выяснить механизм реакции - все равно, что найти шляпу и потерять ее владельца” (Ингольд).
• Как было указано выше, скорость ферментативной реакции зависит от температуры, рН среды. Кроме того, на скорость влияют конфентрация фермента (прямо пропорционально) и концентрация субстрата.
V
скорость
Зависимость скорости ферментативной реакции от концентрации субстрата
Как видно из графика, при низкой
концентрации субстрата |
[S] |
зависимость |
|
скорости реакции |
V |
от |
концентрации |
субстрата линейна. |
|
|
|
При высокой концентрации субстрата |
|||
скорость реакции максимальна |
Vmax и не |
||
зависит от концентрации субстрата, т.е. наблюдается эффект насыщения фермента субстратом.
KM |
концентрация субстрата [S] |
|
|
|
|
|
|
|
Vmax . [S] |
|
|
Уравнение Михаэлиса-Ментен |
|
|
|
|
описывает поведение многих ферментов в |
||
V = КM + [S] |
|||||
|
зависимости от концентрации субстрата. |
||||
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
КM – константа Михаэлиса - численно равна концентрации субстрата, при которой скорость ферментативной реакции равна половине максимальной
(КM имеет размерность концентрации).
КM является экспериментально определяемой величиной и имеет практичекую ценность для выяснения действия эффекторов (активаторов или ингибиторов) на активность фермента (обратно пропорциональна активности фермента).
Более удобным для обработки результатов является график в координатах Лайнуивера-Берка, который представляет собой прямо пропорциональную зависимость, что позволяет легко получить значения константы Михаэлиса, а, следовательно, оценить активность фермента в конкретных условиях.
12

XI. Регуляция активности ферментов
Об активности фермента судят по скорости расходования субстрата или скорости накопления продукта.
Активность фермента определяют в стандартных условиях:
• температура - 25 С;
• рH - оптимальное значение;
• насыщающая концентрация субстрата (скорость равна максимальной);
• сложный фермент должен быт насыщен кофактором.
Международная единица активности фермента - такое количество фермента, которое превращает 1 микромоль (мкмоль) субстрата за 1 мин в стандартных условиях.
Удельная активность - равна числу единиц фермента в образце, деленному на массу белка в этом образце - в мкмоль/мин.мг белка
Катал (кат) количество фермента. способное превратить 1 моль субстрата в 1 с в стандартных условиях.
Факторы, влияющие на активность ферментов:
• температура
• рH среды
• концентрация фермента
• концентрация субстрата
• наличие активаторов или ингибиторов
Таким образом, ферменты относятся к катализаторам с регулируемой активностью, что очень важно для поддержания гомеостаза.
XII. Активация ферментов
1. Аллостерическая регуляция.
Многие ферменты являются аллостерическими. т.е.регуляторными. Кроме активного центра они имеют аллостерический центр , находящийся в другом месте молекулы фермента. Такие ферменты построены, как правило, из нескольких субъединиц, т.е.
имеют четвертичную структуру, при этом одна субъединица имеет активный центр. а другая - аллостерический, служащий для связывания низкомолекулярных веществ – аллостерических эффекторов. Структура эффектора должна быть комплиментарной структуре аллостерического центра (так же, как структура субстрата комплиментарна активному центру фермента).
Аллостерические эффекторы могут быть как активаторами, так и ингибиторами. При присоединении аллостерического эффектора к регуляторной субъединице
происходит изменение ее конформации, что вызывает конформационные изменения и в каталитической субъединице, вследствие чего активный центр становится либо более
комплиментарным субстрату |
( аллостерическая активация |
), либо менее |
|
(аллостерическое ингибирование). |
|
13 |
|

•Гетеротропные аллостерические эффекторы - вещества, непохожие по химическому строению на субстрат.
• Гомотропная аллостерическая регуляция - характерна для ферментов, имеющих одинаковые протомеры, в каждом из которых есть активный центр. В этом случае субстрат сам оказывается эффектором, соединяясь с одним протомером, активирует другие.
аллостерический
центр
активный центр
субстрат |
активатор |
ингибитор |
аллостерическая активация |
аллостерическое ингибирование |
2. Активация кофакторами |
|
|||
Некоторые |
||||
Наличие кофактора – необходимое условие активности сложных |
||||
металлы – |
||||
ферментов. В качестве кофакторов чаще всего выступают активные |
||||
кофакторы |
||||
формы витаминов или ионы двух- (иногда одно-)валентных металлов . |
||||
|
|
|
Cu2+ |
|
Четверть всех ферментов нуждается в наличии металлов для проявления |
||||
Fe2+ |
||||
активности. |
||||
Fe3+ |
||||
Осуществляется активация разными механизмами:. |
||||
K+ |
||||
ионы металлов участвуют в формировании и стабилизации активного |
||||
центра; |
Mg2+ |
|||
ионы металлов выполняют роль простетических групп; |
Mn2+ |
|||
ионы металлов облегчают связывание субстрата с активным центром |
Mo+ |
|||
фермента; |
Ni2+ |
|||
Se+ |
||||
металл соединяется с субстратом, образуя металлосубстратный |
||||
комплекс (истинный субстрат), на который действует фермент. |
Zn2+ |
|||
14
3. Частичный протеолиз - превращение неактивного фермента (зимогена или профермента) в активный путем отщепления полипептидного участка. При этом гидролизуется одна пептидная связь, т.е. главным является изменение первичной структуры фермента . Характерен для протеолитических ферментов, участвующих в переваривании белков.
|
Н2О |
неактивный фермент |
полипептидный участок |
активный фермент |
Это эволюционно закрепленный механизм защиты структурных белков клетки от действия протеаз.
4. Фосфорилирование - дефосфорилирование ферментов
Ряд ферментов при фосфорилировании (введении отрицательно заряженной фосфорной группы) под действием фермента протеинкиназы активируется, например:
|
АТФ АДФ |
|
|
липаза |
протеинкиназа |
липаза |
Ф |
неактивная |
|
активная |
|
Другие ферменты активируются при дефосфорилировании:
гликоген- |
гликоген- |
синтаза |
синтаза |
неактивная
активная
Н2О
протеинфосфотаза
5. Ассоциация и диссоциация протомеров
Некоторые ферменты активируются присоединением или отщеплением регуляторных субъединиц или белков-регуляторов. При этом главным является изменение четвертичной структуры фермента.
ассоциация
диссоциация
15

XIII. Ингибирование ферментов
Изучение ингибирования дало ключ к пониманию механизма действия многих ферментов, позволило понять суть ферментативного катализа, изучить многие
метаболический процессы. Оно имеет также прикладное значение, т.к. ингибиторы применяются в фармакологии, фармацевтической промышленности.
Ингибиторы характеризуются прочностью связывания с субстратом, (устанавливается диализом), поэтому делятся на две группы:
1. Необратимые ингибиторы – соединения, специфически связывают функциональные группы фермента, образуя с ним прочные ковалентные связи.
2. Обратимые ингибиторы – образуют непрочные, нековалентные связи и могут диссоциировать от фермента.
|
|
ингибиторы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
обратимые |
|
|
необратимые |
|
|
|
|
||||
ингибиторы |
|
|
|
|
|
ингибиторы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
конкурентные |
|
|
|
неконкурентные |
|
|
|
|
ингибиторы |
|
|
|
ингибиторы |
|
|
|
|
|
|
|
|
|
|
1. Конкурентное ингибирование
Е
Е
Е
Действие многих лекарственных препаратов основано на конкурентном ингибировании.
Например, для лечения подагры, связанной с накоплением мочевой кислоты, применяется конкурентный ингибитор ксантиноксидазы - аллопуринол, который является структурным аналогом ксантина - промежуточного продукта в процессе образования мочевой кислоты:
|
|
аллопуринол |
|
|
_ |
пуриновые осования |
ксантин |
мочевая кислота |
16 |
|
ксантиноксидаза |
|
|

2. Неконкурентное ингибирование
Ингибитор (I) не имеет структурного сходства с субстратом (S) (т.е. сродства к активному центру фермента), поэтому связывание ингибитора с ферментом часто происходит не в активном центре, а в другой части молекулы субстрата. При этом может образовываться тройной комплекс ESI. Устранить неконкурентное ингибирование высокими концентрациями субстрата невозможно, для этого нужны вещества, связывающие ингибитор.
Е |
Е |
|
Е |
|
|
Неконкурентный ингибитор |
Конкурентный ингибитор |
уменьшает Vmax , но не изменяет |
увеличивает KM, но не |
сродство фермента к субстрату |
изменяет Vmax |
Аллостерическое ингибирование относится к неконкурентному, и часто реализуется по типу обратной отрицательной связи, т.е. конечный продукт ряда последовательных реакций (Рn) является ингибитором одного из ферментов, катализирующих эти реакции (например, Е 1). В этом случае ингибируется регуляторный аллостерический фермент, который катализирует скорость определяющую (самую медленную) стадию процесса:
S |
|
|
Р1 |
|
Р2 |
|
Р3 |
|
|
Рn |
|
|
|
|
|
||||||
|
|
Е1 |
Е2 |
Е3 |
Еn |
|
||||
|
|
|
||||||||
_
Иногда при продолжительном действии неконкурентного ингибитора и образовании прочных связей с ферментом такое ингибирование становится необратимым.
Необратимые ингибиторы часто бывают токсичными.
•Например , цианиды, прочно связываясь с железом, входящим в активный центр цитохромоксидазы, блокируют дыхательную цепь, что ведет к смерти клетки.
•Ионы тяжелых металлов очень токсичны т.к. блокируют SH-группы в активном
центре ферментов, при этом субстрат может связаться с активным центром, но продукты не будут образовываться.
• Ингибиторы холинэстэразы, которая расщепляет ацетилхолин |
(нейромедиатор), |
фосфорилируют каталитическую группу фермента необратимо |
(отравляющие |
вещества зарин, зоман). |
17 |

XIV. Применение ферментов в медицине
Применение ферментов в медицине развивается по трем основным направлениям:
 Энзимопатология - исследование ферментативной активности в норме и патологии и выявление таким образом наследственных заболеваний - энзимопатий, связанных с генетическим дефектом. Такой дефект гена приводит к нарушению синтеза определенного белка, если же этот белок является ферментом, это ведет к изменению скорости катализируемой им реакции, т.е. к нарушению метаболизма.
Энзимопатология - исследование ферментативной активности в норме и патологии и выявление таким образом наследственных заболеваний - энзимопатий, связанных с генетическим дефектом. Такой дефект гена приводит к нарушению синтеза определенного белка, если же этот белок является ферментом, это ведет к изменению скорости катализируемой им реакции, т.е. к нарушению метаболизма.
 Энзимотерапия - использование ферментов и регуляторов действия ферментов в качестве лекарственных средств. Например, ингибиторы протеолитических ферментов (которые в норме продуцируются поджелудочной железой в неактивном состоянии)
Энзимотерапия - использование ферментов и регуляторов действия ферментов в качестве лекарственных средств. Например, ингибиторы протеолитических ферментов (которые в норме продуцируются поджелудочной железой в неактивном состоянии)
используются для предотвращения аутолиза поджелудочной железы при остром панкреатите.
Энзимодиагностика - развивается по двум направлениям:
 Применение высокоочищенных ферментов как аналитических реактивов, т.е. в качестве избирательных реагентов для количественного определения химических веществ (нормальных или патологических) в биологических жидкостях с диагностической целью. Этот метод диагностики отличается высокой специфичностью и чувствительностью. в клинике этими методами определяют содержание глюкозы, лактата, ХС, ТАГ, мочевины, мочевой кислоты и др.
Применение высокоочищенных ферментов как аналитических реактивов, т.е. в качестве избирательных реагентов для количественного определения химических веществ (нормальных или патологических) в биологических жидкостях с диагностической целью. Этот метод диагностики отличается высокой специфичностью и чувствительностью. в клинике этими методами определяют содержание глюкозы, лактата, ХС, ТАГ, мочевины, мочевой кислоты и др.
 Обнаружение самих ферментов в сыворотке крови при поражении органов и тканей. При этом изменение концентрации (активности) самого фермента является скорее следствием, чем причиной патологического процесса. Такие измерения обычно проводят в плазме, хотя ферментный анализ других биологических жидкостей, таких как моча или сок поджелудочной железы, также может дать полезную информацию. Большинство ферментов, определяемых в плазме, являются внутриклеточными и освобождаются в кровь при повреждении клеточных мембран, но многие ферменты, например, ренин, факторы свертывания крови, активно секретируются в кровь, где и выполняют свою физиологическую функцию.
Обнаружение самих ферментов в сыворотке крови при поражении органов и тканей. При этом изменение концентрации (активности) самого фермента является скорее следствием, чем причиной патологического процесса. Такие измерения обычно проводят в плазме, хотя ферментный анализ других биологических жидкостей, таких как моча или сок поджелудочной железы, также может дать полезную информацию. Большинство ферментов, определяемых в плазме, являются внутриклеточными и освобождаются в кровь при повреждении клеточных мембран, но многие ферменты, например, ренин, факторы свертывания крови, активно секретируются в кровь, где и выполняют свою физиологическую функцию.
В небольших количествах внутриклеточные ферменты присутствуют в крови как результат клеточного обновления. При повреждении клеток освобождается большое количество ферментов, что отражается в возрастании их концентрации в крови. Это так называемые “индикаторные ферменты”.
18
Задания для самопроверки и самокоррекции
Задача 1. У гастроэнтерологического больного понижена кислотность желудочного сока, вследствие чего нарушено переваривание белков в желудке. Какое свойство ферментов, переваривающих белки (в частности, пепсина) проявляется в данном случае?
A.Зависимость активности ферментов от pН.
B.Специфичность ферментов.
C.Термолабильность ферментов.
D.Денатурация ферментов.
E.Влияние ингибиторов на активность ферментов.
Задача 2. При моделировании биохимического процесса смесь, содержащую субстрат реакции, буферный раствор и фермент, инкубировали при 80ºС в течение 30 минут. Качественная реакция на продукт отрицательна. Какое свойство ферментов привело к прекращению реакции?
A.Относительная специфичность.
B.Абсолютная специфичность.
C.Стереоспецифичность.
D.Зависимость от pН.
E.Денатурация ферментов.
Задача 3. При изучении физико-химических свойств лактатдегидрогеназы (ЛДГ),
выделенной из сердечной мышцы и из скелетных мышц, определили их
различную электрофоретическую подвижность, различные рН оптимумы. При этом оба белка-фермента катализировали одну реакцию. Чем обусловлены
различия в свойствах изоферментов?
A.Различиями в первичной структуре.
B.Различиями во вторичной структуре.
C.Различиями в третичной структуре.
D.Различиями в четвертичной структуре.
Задача 4. Лекарственные препараты на основе салицилатов являются обратимыми не конкурентными ингибиторами фермента
глутаматдегидрогеназы. Предложите метод, который можно использовать для снижения степени ингибирования:
А. Увеличить концентрацию субстрата В. Снизить концентрацию ингибитора С. Изменить значение рН среды
D. Ввести структурный аналог субстрата Е. Снизить концентрацию субстрата.
Правильность решения проверьте, сопоставив их с эталонами ответов.
1-А, 2-Е,
19
