
- •Биологическая
- •2. Забор крови для лабораторных исследований.
- •3. Правила лабораторных исследований.
- •4. Ошибки при проведении лабораторных исследований.
- •Методы биохимических исследований
- •Тема 1. Введение в биохимию. Биохимические компоненты клеток
- •Белки. Состав и свойства белков
- •Тема 2. Ферменты и коферменты
- •Тема 3, 4. Основные закономерности метаболизма. Цикл Кребса. Молекулярные основы биоэнергетики
- •Тема 1. Метаболизм углеводов и его регуляция
- •Тема 2. Метаболизм липидов и его регуляция
- •Тема 3. Метаболизм аминокислот. Энзимопатии аминокислотного обмена
- •Тема 1, 2. Основы молекулярной биологии. Основы молекулярной генетики
- •Тема 3, 4. Молекулярные механизмы действия гормонов на клетки-мишени. Биохимия гормональной регуляции метаболизма
- •Работа 1. Реакции, свидетельствующие о белковой природе инсулина
- •Работа 2. Качественная реакция на тироксин
- •Тема 1. Биохимия питания человека. Витамины как компоненты питания
- •Работа 6. Реакции на витамин р (рутин)
- •Работа 2. Количественное определение витамина а в рыбьем жире
- •Тема 2. Биохимия и патобиохимия крови
- •Тема 3. Функциональная и клеточная биохимия органов и тканей.
- •Литература:
- •Тема 1. Введение в биохимию. Биохимические компоненты клеток 21
Тема 1. Метаболизм углеводов и его регуляция
Углеводы представляют собой полигидроксиальдегиды (альдозы) или полигидроксикетоны (кетозы), а также их производные. Функции углеводов разнообразны – энергетическая, пластическая, защитная, регуляторная и др.
В зависимости от количества мономерных звеньев углеводы делят на моносахариды или монозы (не гидролизуются до более простых углеводов), олигосахариды (гидролизуются на небольшое количество остатков моносахаридов) и полисахариды (содержат от десятков до нескольких тысяч моносахаридных остатков). В олиго- и полисахаридах остатки моноз соединены О-гликозидными связями.
Монозы по числу атомов углерода делят на триозы, тетрозы, пентозы, гексозы и гептозы. Наиболее распространенными являются гексозы (глюкоза, галактоза, фруктоза) и пентозы (рибоза и дезоксирибоза).
Наиболее широко распространенными представителями дисахаридов являются сахароза, мальтоза и лактоза.
Встречающиеся в природе полисахариды подразделяются на гомополисахариды, состоящие из остатков моноз одного типа (например, гликоген, крахмал, целлюлоза), и гетерополисахариды, в составе которых встречаются два и более типов моносахаридов и их производных (например, гиалуроновая кислота, гепарин и др.). Гликоген и крахмал являются резервными углеводами и используются в качестве запасного энергетического материала.
Основным моносахаридом пищи, который участвует в катаболических реакциях, является глюкоза. Другие монозы, которые попадают в организм с пищей (фруктоза – как компонент сахарозы, галактоза – лактозы), подлежат метаболическим превращениям после их трансформации в фосфорные эфиры глюкозы.
Основные внутриклеточные превращения глюкозы:
аэробное окисление, в результате которого глюкоза превращается в пируват; затем происходит окислительное декарбоксилирование пирувата до ацетил-КоА и полное окисление последнего в ЦТК;
анаэробный гликолиз, в результате которого образуется молочная кислота (лактат);
запасание глюкозы в виде гликогена в печени или использование для синтеза триацилглицеролов в жировой ткани;
пентозофосфатный цикл окисления глюкозы, в результате которого образуются фосфорные эфиры пентоз, восстановленная форма НАДФ+ (НАДФН) и CO2;
превращение глюкозы в глюкуроновую кислоту.
Такие ткани, как мозг и эритроциты, зависят от постоянного снабжения глюкозой. Если получаемое с пищей количество углеводов недостаточно, необходимая концентрация глюкозы в крови может поддерживаться некоторое время за счет расщепления гликогена печенью.
Если запасы гликогена истощены, то в печени запускается синтез глюкозы de novo – глюконеогенез. Наряду с печенью способностью к синтезу глюкозы обладают также клетки почечных канальцев. Субстратами в глюконеогенезе являются глюкогенные аминокислоты, а также лактат, образующийся в эритроцитах и мышечной ткани в анаэробных условиях, и глицерол, образующийся при расщеплении жиров.
К гормонам, которые влияют на углеводный обмен, принадлежат пептиды инсулин и глюкагон, глюкокортикоид кортизол и катехоламин адреналин.
Инсулин индуцирует синтез de novo гликогенсинтазы, а также некоторых ферментов гликолиза (гексокиназа, фосфофруктокиназа). Одновременно инсулин подавляет синтез ключевых ферментов глюконеогенеза.
Глюкагон действует как антагонист инсулина: индуцирует активность ферментов глюконеогенеза и подавляет активность пируваткиназы, ключевого фермента гликолиза. Также, через вторичный мессенджер цАМФ, глюкагон тормозит синтез гликогена и активирует его расщепление. Подобным образом действует и адреналин.
Глюкокортикоиды, прежде всего кортизол, индуцируют синтез всех ключевых ферментов глюконеогенеза. Одновременно они индуцируют синтез ферментов, участвующих в деградации белков и аминокислот, обеспечивая таким образом глюконеогенез субстратами.
Лабораторная работа 1. Химические свойства углеводов
Моносахариды взаимодействуют с крепкими минеральными кислотами, которые отщепляют от них Н2О с образованием циклических соединений –фурфурола (из пентоз) и оксиметилфурфурола (из гексоз). Дисахариды и полисахариды, обработанные крепкими минеральными кислотами, гидролизуются с образованием моносахаридов, дающих далее оксиметилфурфурол. Фурфурол и оксиметилфурфурол образуют окрашенные комплексы при взаимодействии с некоторыми органическими соединениями (-нафтолом, орцином, резорцином и др.). На способности большинства углеводов взаимодействовать с крепкими минеральными кислотами основаны реакции Подобедова–Молиша (общая реакция на углеводы), относительно специфические реакции на пентозы с орцином, на фруктозу с резорцином, др.
Карбонильная группа в моносахаридах является наиболее реакционноспособной и обусловливает их способность восстанавливать металлы, конденсироваться с образованием смол и вступать в реакции замещения карбонильного кислорода.На этом свойстве основаны многие методы качественного и количественного определения сахаров.
Все качественные реакции выполняются с растворами глюкозы, фруктозы, галактозы, ксилозы, сахарозы, мальтозы, лактозы и крахмала.
Работа 1. Реакция Подобедова–Молиша
К 1 мл углевода добавить 2–3 капли спиртового раствора -нафтола. Перемешать. Осторожно по стенке подслоить 2 мл концентрированной H2SO4. Реакция положительна, если на границе раздела жидкостей появляется фиолетовое кольцо.
Работа 2. Проба на пентозы с орцином
Для сравнения взять растворы ксилозы (или несколько кусочков соломы, содержащей полисахарид, построенный из остатков ксилозы) и глюкозы. К 1 мл углевода добавить 1 мл солянокислого раствора орцина и кипятить до появления зеленой окраски в пробирке с ксилозой.
Работа 3. Реакция Селиванова (на фруктозу)
По сравнению с другими гексозами, фруктоза быстрее образует оксиметилфурфурол при обработке минеральными кислотами. Это видно при использовании разбавленных минеральных кислот. Данное свойство легло в основу качественного определения фруктозы.
Ход работы. В 3 пробирки налить по 1 мл фруктозы, глюкозы и сахарозы (для сравнения) и добавить по 2 мл раствора резорцина в 12 % НСl. Одновременно нагреть все 3 пробирки до кипения и кипятить до появления вишнево-красной окраски в пробирке с фруктозой.
Работа 4. Реакция Фелинга
Представляет собой процесс восстановления Сu2+ до Сu1+ в щелочной среде в присутствии углеводов со свободными карбонильными группами. На примере гексозы:
CuSO4 + NaOH Cu(OH)2 + NaSO4
CH2OH(CHOH)4CHO +2Cu(OH)2 CH2OH(CHOH)4COOH +Cu2O +2H2O.
Появление красного осадка (закись меди) или желтого осадка (гидрат закиси меди) свидетельствует о наличии в данном углеводе свободной карбонильной группы.
Ход работы. К 2 мл раствора углевода добавить 1 мл раствора Фелинга (готовится из смеси растворов NaOH, СuSO4 и сегнетовой соли). После перемешивания нагреть содержимое пробирки в пламени горелки или в кипящей водяной бане до появления в некоторых пробирках красного или желтого осадка. Нагревать либо одновременно все пробирки, либо по 2 пробирки, одна из которых обязательно должна содержать раствор редуцирующего углевода. Реакцию Фелинга провести также с гидролизованными сахарозой и крахмалом.
Гидролиз сахарозы. К 1 мл раствора сахарозы добавить 0,5 мл 10 % раствора H2SO4 и кипятить смесь 1–2 минуты. Нейтрализовать кислоту добавлением 1 мл 10 % раствора NаОН.
Гидролиз крахмала. К 2 мл крахмала добавить 0,5 мл 10% раствора H2SO4 и поместить в кипящую водяную баню на 10-15 мин. Охладить и нейтрализовать кислоту добавлением 1 мл 10% раствора NаОН.
Работа 5. Реакция серебряного зеркала
Представляет собой процесс восстановления серебра в щелочной среде углеводами со свободными карбонильными группами, т. е. имеет тот же механизм, что и реакция Фелинга.
AgNO3 + NH4OH AgOH + NH4NO3
CH2OH(CHOH)4CHO + 2AgOH CH2OH(CHOH)4COOH + 2Ag + H2O
Ход работы. К 1 мл раствора углевода добавить 1 мл аммиачного раствора AgNO3 и осторожно нагреть в пламени горелки до появления на стенках пробирки осадка металлического серебра.
Работа 6. Реакция с реактивом Ниландера
Основана на восстановлении азотнокислого висмута до металлического висмута в щелочной среде в присутствии редуцирующих углеводов. Этой реакцией пользуются в клинических лабораториях для определения содержания глюкозы в моче, т. к., в отличие от солей меди, соли висмута не восстанавливаются мочевой кислотой. Реакция очень чувствительна.
Ход работы. К 0,5 мл углевода добавить 5–6 капель реактива Ниландера. Нагревать смесь до появления черного осадка металлического висмута.
Работа 7. Реакция осмоления
Данная реакция основана на способности углеводов со свободными карбонильными группами при нагревании со щелочами конденсироваться и образовывать смолы или карамели.
Ход работы. К 1 мл углевода добавить 0,5 мл 10 % раствора NaOH и нагреть. Появление золотисто-коричневой окраски и запаха жженого сахара свидетельствует об осмолении исследуемых сахаров.
Работа 8. Реакция замещения карбонильного кислорода (образование озазонов)
Углеводы, имеющие свободные карбонильные группы, при нагревании с фенилгидразином в кислой среде образуют озазоны. Озазоны разных сахаров отличаются по форме кристаллов, температуре плавления и растворимости, что используется для идентификации сахаров. Некоторые сахара (глюкоза, фруктоза, манноза) дают одинаковые продукты, и потому данным методом не могут быть идентифицированы.
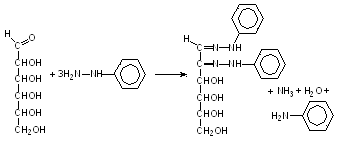
Ход работы. На дно сухой пробирки насыпать смесь (свежеприготовленную) солянокислого фенилгидразина с уксуснокислым натрием (1 : 2) так, чтобы дно было покрыто этой смесью. Прилить 1–2 мл раствора сахара. Пробирки поместить в водяную баню (100 0С) на 30–40 мин. После появления желтого осадка озазонов жидкость охладить в струе проточной воды. Нанести каплю жидкости с осадком на предметное стекло и рассмотреть под микроскопом. Зарисовать форму кристаллов.
Р
Бродильный
сосуд
Эйхгорна

Спиртовым брожением называется процесс превращения глюкозы в спирт и СО2 в анаэробных условиях под влиянием микроорганизмов. Данная проба позволяет отличить сбраживающиеся ферментами дрожжей углеводы (гексозы, триозы и некоторые дисахариды) от несбраживающихся. Используется при идентификации раствора углевода.
Ход работы. Налить в пробирки по 9 мл растворов глюкозы, фруктозы, галактозы, лактозы, сахарозы, мальтозы. Добавить по 2 мл суспензии дрожжей и перемешать.
Заполнить смесью бродильный сосуд Эйхгорна так, чтобы в запаянном колене не было пузырьков воздуха. Жидкость должна заполнить трубку бродильного сосуда до расширенной его части. Для этого, налив жидкость в расширенную часть сосуда, закрыть отверстие большим пальцем руки и перевернуть сосуд. Когда трубка заполнится жидкостью, сосуд осторожно вернуть в нормальное положение. Бродильный сосуд поместить в термостат (37 0С).
Через 30–40 мин наблюдается выделение пузырьков углекислого газа, которые собираются в верхней части закрытого колена трубки, что свидетельствует о сбраживании данного углевода.
На основании результатов проделанных работ заполняют таблицу и делают выводы о свойствах исследованных углеводов.
|
|
Реакции на свободные карбонильные группы |
Озазоны (форма кристаллов) |
Реакции с минеральными кислотами |
Брожение | |||||
|
Углевод |
Фелинга |
Ниландера |
Осмоления |
Серебряного зеркала з |
Подобедова–Молиша |
с орцином |
Селиванова | ||
|
Глюкоза |
|
|
|
|
|
|
|
|
|
|
Фруктоза |
|
|
|
|
|
|
|
|
|
|
Галактоза |
|
|
|
|
|
|
|
|
|
|
Лактоза |
|
|
|
|
|
|
|
|
|
|
Ксилоза |
|
|
|
|
|
|
|
|
|
|
Сахароза |
|
|
|
|
|
|
|
|
|
|
Мальтоза |
|
|
|
|
|
|
|
|
|
|
Крахмал |
|
|
|
|
|
|
|
|
|
Лабораторная работа 2. Определение концентрации глюкозы глюкозооксидазным методом
В крови из веществ углеводной природы в наибольшем количестве содержится глюкоза. Поэтому для диагностики нарушений углеводного обмена в клинической практике часто используется определение количества глюкозы в крови.
Принцип метода. Реакция основана на способности глюкозы окисляться в присутствии глюкозооксидазы (КФ 1.1.3.4). Глюкозооксидаза относится к флавопротеинам, специфически катализирует перенос двух водородных атомов с первого углеродного атома глюкозы на кислород воздуха.
В начале ферментативной реакции образуется 6-глюконолактон, который, присоединяя воду, спонтанно превращается в глюконовую кислоту.
Глюкоза + Н2О + О2 → Глюконовая кислота + Н2О2
При этом в эквимолярных количествах образуется пероксид водорода, который в присутствии пероксидазы (КФ 1.11.1.7) и восстановительных эквивалентов восстанавливается до воды. Добавление в систему красителя (например, ортотолуидина), который приобретает окраску при окислении, или других соединений, которые в присутствии пероксида водорода образуют окрашенные продукты (например, фенол и 4-аминофеназон в присутствии Н2О2 образуют хинонимин красно-фиолетового цвета), позволяет зафиксировать количество образовавшегося Н2О2 колориметрически.
Материалы и реактивы:
1) Энзимы – пероксидаза (2200 ± 220) U/л, глюкозооксидаза (18000 ± 1800) U/л, 4-аминофеназон (110 ± 11) мг/л, стабилизаторы, активаторы;
2) Буферный раствор – фосфатный буфер (рН 7,2–7,4) (0,1 ± 0,01) М, фенол (190 ± 19) мг/л, стабилизаторы;
3) Калибровочный раствор глюкозы (10±0,5) мМ или (1802±90) мг/л;
4) Антикоагулянт – раствор цитрата натрия и хлористого натрия.
Анализируемый материал: сыворотка крови, плазма, моча.
|
Отмерить в пробирку, мл |
Калибровочная проба |
Опытная проба |
Холостая проба |
|
Калибровочный раствор Анализируемый р-р Физиологический р-р Буферный раствор Энзимы |
0,04 – – 2,00 2,00 |
– 0,04 – 2,00 2,00 |
– – 0,04 2,00 2,00 |
|
Общий объем в пробирке, мл |
4,04 |
4,04 |
4,04 |
Ход работы. Добавить реактивы согласно таблице, выдержать 20 мин при комнатной температуре (+18–25 0С), или 12 мин при температуре +37 0С. Измерить поглощение Е калибровочной и опытной пробы против холостой при 500–546 нм в кювете с длиной оптического пути 10 или 5 мм.
Концентрацию глюкозы рассчитать по формуле:
![]() ,
,
где Скалибр. – концентрация калибровочного раствора глюкозы (10 мМ),
Еопыт. – поглощение опытной пробы,
Екалибр. – поглощение калибровочной пробы.
В норме концентрация глюкозы в сыворотке, плазме крови составляет (4,22–6,11) мМ или (76–110) мг/дкл; в моче (0–1,11) мМ или (0–20) мг/дкл.
К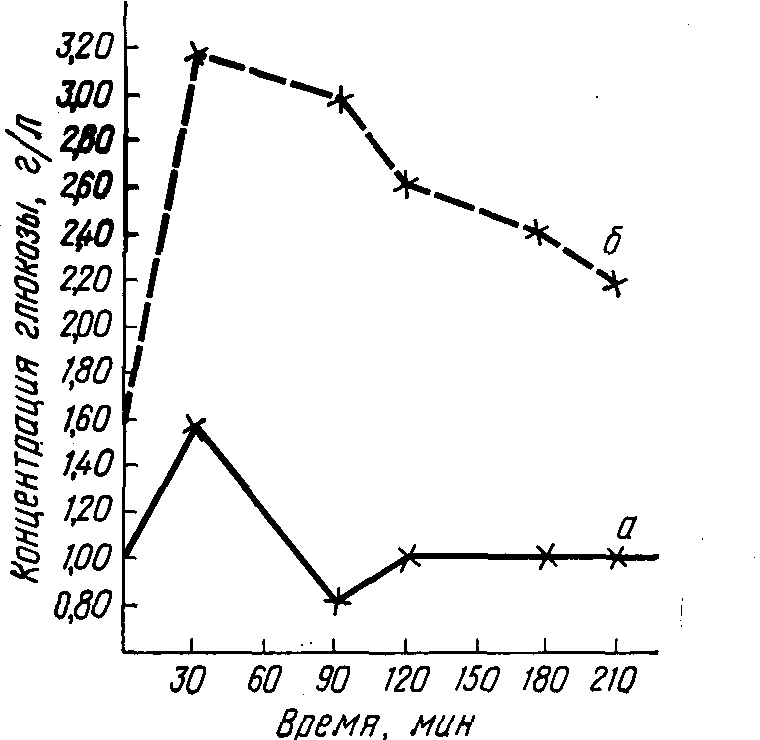 линико-диагностическое
значение.Гипергликемия
может возникнуть при сахарном диабете,
остром панкреатите, панкреатических
циррозах (эти заболевания дают
гипергликемию, связанную с недостатком
инсулина), при травмах и опухолях мозга,
эпилепсии, менингите, опухолях коры
надпочечников, гиперфункции щитовидной
железы, при психологическом возбуждении
и т. д.
линико-диагностическое
значение.Гипергликемия
может возникнуть при сахарном диабете,
остром панкреатите, панкреатических
циррозах (эти заболевания дают
гипергликемию, связанную с недостатком
инсулина), при травмах и опухолях мозга,
эпилепсии, менингите, опухолях коры
надпочечников, гиперфункции щитовидной
железы, при психологическом возбуждении
и т. д.
Для исследования обмена углеводов в клинике применяется метод сахарной нагрузки (однократный прием 50–100 г глюкозы, который вызывает пищевую, или алиментарную, гипергликемию у здорового человека). Усиленное выделение инсулина способствует быстрой утилизации глюкозы и приводит к нормализации содержания глюкозы в крови уже через 1–2 ч (линия а на графике). При ряде патологий повышение содержания сахара в крови после сахарной нагрузки достигает значительно больших величин и сохраняется более длительное время (линия б на графике).
Гипогликемия наблюдается при передозировке инсулина (при лечении диабета), аденомах поджелудочной железы (вследствие увеличения синтеза инсулина β-клетками островков Лангерганса), гипотиреозе, а также при голодании и продолжительной физической работе.
В норме у здорового человека с мочой за сутки выделяется до 0,02 % глюкозы, которую не определяют обычными методами. Появление глюкозы в моче в большом количестве, или глюкозурия, связано с различными причинами. Одной из них может быть гипергликемия, при которой уровень сахара в крови превышает почечный порог для глюкозы (8–10 мМ). Другой причиной могут быть заболевания почек, связанные с нарушением реабсорбции (обратного всасывания) глюкозы в почечных канальцах.
Лабораторная работа 3. Выявление сиаловых кислот в сыворотке крови
Принцип метода. Сиаловые кислоты – производные нейраминовой кислоты. При нагревании сиаловой кислоты с реактивом Гёсса, содержащим ТХУ (осаждает белки) и концентрированную H2SO4 (гидролизует олигосахариды и полисахариды и дегидратирует гексозы и пентозы и их производные). Продукты реакции окрашены в буровато-розовый цвет. Интенсивность окраски определяется колориметрически.
Материалы и реактивы: сыворотка крови, 10 % раствор ТХУ, реактив Гесса (94 объёма ледяной уксусной кислоты и 6 объёмов концентрированной H2SO4).
Ход работы. В сухую центрифужную пробирку налить 1 мл сыворотки крови, добавить 1 мл 10 % раствора ТХУ. Смесь перемешать, пробирку закрыть фольгой и поставить в кипящую водяную баню на 5 мин.
Вынуть пробирку из водяной бани и охладить. Это приводит к высвобождению нейраминовой кислоты из молекул гликопротеинов. Нейраминовая кислота переходит в раствор, в осадке остаются белки. Смесь центрифугировать 5 мин при 3000 об./мин. После центрифугирования к 0,4 мл надосадочной жидкости добавить 5 мл реактива Гесса и снова кипятить в водяной бане в течение 30 мин, закрыв пробирку фольгой. После охлаждения колориметрировать на ФЭК в кюветах толщиной 10 мл против воды при зеленом светофильтре (540 нм). Полученную величину экстинкции умножить на 1000. Результаты измерения выразить в условных единицах (у.е.). В норме эта величина колеблется от 100 до 195 у.е., что отвечает содержанию сиаловых кислот от 5,5 до 7,9 г/л ацетилнейраминовой кислоты.
Клинико-диагностическое значение.
Исследования сиаловых кислот в крови и моче имеет важное диагностическое значение. Производные нейраминовой кислоты – сиаловые кислоты – появляются в повышенном количестве в крови (гиперсиалемия) вследствие деструктивных процессов в различных органах. Количество сиаловых кислот увеличивается при инфекционных заболеваниях, ревматизме, туберкулезе, злокачественных опухолях костной ткани, легких, коллагенозах, нефротическом синдроме, остеомиелите и др.
Снижение содержания сиаловых кислот в крови (гипосиалемия) наблюдают у больных анемией, болезнью Вильсона–Коновалова, а также дегенеративными процессами в ЦНС.
В моче сиаловые кислоты обнаруживают только при протеинурии.
Лабораторная работа 4. Количественное определение концентрации молочной кислоты в сыворотке крови по методу Бюхнера
Молочная кислота в организме является конечным продуктом гликолиза и гликогенолиза – анаэробных процессов распада глюкозы и гликогена. Значительное количество молочной кислоты образуется в мышцах, поступает в кровь, переносится к сердечной мышце и в печень, где окисляется и используется как энергетический материал.
Принцип метода. Молочная кислота вследствие нагревания с концентрированной серной кислотой превращается в уксусный альдегид, который при взаимодействии с гидрохиноном образует соединение красно-коричневого цвета. Количество молочной кислоты определяют колориметрически на ФЭК при синем светофильтре (λ = 490 нм).
Материалы и реактивы: сыворотка крови, 5 % раствор метафосфорной кислоты, 10 % раствор сульфата меди, сухой гидроксид кальция, концентрированная серная кислота, 20 % раствор гидрохинона, стандартный раствор молочной кислоты, дистиллированная вода.
Ход работы. В две сухие пробирки налить по 6 мл дистиллированной воды. Затем в первую добавить 1 мл стандартного раствора молочной кислоты, во вторую – 1 мл сыворотки крови. Для осаждения белков влить в каждую пробирку по 1 мл метафосфорной кислоты, встряхнуть и оставить на несколько минут, осадок отделить. К фильтратам прибавить по 1 мл 10 % раствора сульфата меди и по 0,5 г гидроксида кальция. Пробы перемешать, через 5 мин отфильтровать. Отмерить по 1 мл фильтрата в пробирки с притертыми крышками, прибавить по 0,1 мл 10 % раствора сульфата меди и по 4 мл концентрированной серной кислоты. Поставить на кипящую водяную баню на 1,5 мин. Охладить, прибавить по 0,1 мл 20 % спиртового раствора гидрохинона, хорошо перемешать и кипятить в течение 15 мин. Пробирки охладить и колориметрировать при синем светофильтре.
Концентрацию молочной кислоты рассчитать по формуле:
![]() ,
,
где С – концентрация молочной кислоты в сыворотке крови, мМ;
Сст. – концентрация молочной кислоты в стандартном растворе;
Ест. – оптическая плотность стандартного раствора молочной кислоты;
Еопыт. – оптическая плотность опытной пробы.
Клинико-диагностическое значение
В крови здорового человека концентрация молочной кислоты составляет 1–2 мМ. Её увеличение может быть связано с выполнением человеком интенсивной мышечной работы без достаточного поступления кислорода. При этом не происходит адекватное окислительное декарбоксилирование пирувата до ацетил-КоА, а увеличение концентрации восстановленного НАД приводит к образованию лактата. В случае достаточного поступления кислорода лактат превращается в пируват.
Любые патологические процессы, сопровождающиеся гипоксическими состояниями, вызывают лактатацидоз. Для них характерно увеличение соотношения лактат/пируват (порядка 10 : 1).
Лабораторная работа 5. Количественное определение концентрации пировиноградной кислоты в моче колориметрическим методом
Пировиноградная кислота – один из центральных метаболитов углеводного обмена. Определение ее количества в плазме крови и моче широко используют для мониторинга в клинической практике.
Принцип метода. Пировиноградная кислота с 2,4-динитрофенилгидразином (2,4-ДНФГ) в щелочной среде образует 2,4-динитрофенилгидразон пировиноградной кислоты коричнево-красной окраски, интенсивность которой пропорциональна концентрации пировиноградной кислоты и определяется колориметрически.
Материалы и реактивы: моча, стандартный раствор пирувата (пировиноградная кислота) – 625 мг в 100 мл воды, 0,1 % раствор 2,4-ДНФГ в 2 н растворе соляной кислоты, 12 % раствор гидроксида натрия, дистиллированная вода.
Ход работы. В одну из двух пробирок налить 0,1 мл мочи, во вторую – 0,1 мл пировиноградной кислоты. В обе пробирки добавить по 0,9 мл дистиллированной воды и по 0,5 мл 0,1 % раствора 2,4-ДНФГ, смешать и на 20 мин поставить в темное место. Затем добавить по 1 мл 12 % раствора гидроксида натрия и через 10 мин колориметрировать на ФЭК против контроля (воды) при синем светофильтре (λ = 490 нм).
Концентрацию пировиноградной кислоты вычислить по формуле:
![]() ,
,
где Сст. – концентрация стандартного раствора пировиноградной кислоты;
Сопыт. – концентрация пировиноградной кислоты в моче, мг/сутки;
Еопыт. – оптическая плотность исследуемой пробы;
Ест. – оптическая плотность стандарта;
V – суточное количество мочи; а – 0,1 мл мочи, взятой для анализа.
Клинико-диагностическое значение. В крови здорового человека концентрация пировиноградной кислоты составляет 45–115 мкМ. С мочой за сутки выделяется 15–25 мг пировиноградной кислоты. Содержание пировиноградной кислоты в крови (вместе с молочной кислотой) повышается во время усиленной мышечной работы, а также при некоторых патологических состояниях, сопровождающихся нарушением окислительного декарбоксилирования; в результате возникают судороги (тетания, эпилепсия, столбняк). Выделение пировиноградной кислоты с мочой увеличивается при недостаточности витамина В1, сердечной недостаточности, токсикозах, заболеваниях печени, инсулинозависимом сахарном диабете, а также после введения препаратов, изменяющих работу сердечной мышцы – камфары, стрихнина, адреналина.
Содержание пировиноградной кислоты резко повышается в спинномозговой жидкости при травматических и воспалительных заболеваниях ЦНС (менингит, абсцесс мозга). Под влиянием наркоза уровень пировиноградной кислоты в крови снижается.
Таким образом, основной причиной накопления в крови пировиноградной и молочной кислот является нарушение их дальнейшего взаимопревращения в окислительно-восстановительных процессах.
Контрольные вопросы по теме «Метаболизм углеводов и его регуляция»:
Аэробное и анаэробное окисление глюкозы, общая характеристика процессов.
Анаэробное окисление глюкозы. Последовательность реакций и ферменты гликолиза.
Аэробное окисление глюкозы. Этапы преобразования глюкозы до СО2 и Н2О.
Окислительное декарбоксилирование пирувата. Ферменты, коферменты и последовательность реакций в мультиферментном комплексе.
Образование АТФ в ходе гликолиза: субстратное фосфорилирование и челночные механизмы переноса гликолитического НАДН в митохондрии.
Сравнительная характеристика биоэнергетики аэробного и анаэробного окисления глюкозы, эффект Пастера.
Фосфоролитический путь расщепления гликогена в печени и мышцах. Регуляция активности гликогенфосфорилазы.
Биосинтез гликогена: ферментативные реакции, физиологическое значение. Регуляция активности гликогенсинтазы.
Механизмы регуляции гликогенолиза и гликогенеза за счет каскадного цАМФ-зависимого фосфорилирования ферментных белков.
Генетические нарушения метаболизма гликогена (гликогенозы, агликогенозы).
Глюконеогенез: субстраты, ферменты и физиологическое значение процесса.
Глюкозо-лактатный цикл (цикл Кори) и глюкозо-аланиновый циклы.
Глюкоза крови (глюкоземия): нормогликемия, гипо- и гипергликемия, глюкозурия. Сахарный диабет – патология обмена глюкозы, его типы.
Гормональная регуляция концентрации и обмена глюкозы крови.
Пентозофосфатный путь окисления глюкозы: схема процесса и биологическое значение.
Метаболические пути превращения фруктозы и галактозы; наследственные энзимопатии их обмена.
