
- •Биологическая
- •2. Забор крови для лабораторных исследований.
- •3. Правила лабораторных исследований.
- •4. Ошибки при проведении лабораторных исследований.
- •Методы биохимических исследований
- •Тема 1. Введение в биохимию. Биохимические компоненты клеток
- •Белки. Состав и свойства белков
- •Тема 2. Ферменты и коферменты
- •Тема 3, 4. Основные закономерности метаболизма. Цикл Кребса. Молекулярные основы биоэнергетики
- •Тема 1. Метаболизм углеводов и его регуляция
- •Тема 2. Метаболизм липидов и его регуляция
- •Тема 3. Метаболизм аминокислот. Энзимопатии аминокислотного обмена
- •Тема 1, 2. Основы молекулярной биологии. Основы молекулярной генетики
- •Тема 3, 4. Молекулярные механизмы действия гормонов на клетки-мишени. Биохимия гормональной регуляции метаболизма
- •Работа 1. Реакции, свидетельствующие о белковой природе инсулина
- •Работа 2. Качественная реакция на тироксин
- •Тема 1. Биохимия питания человека. Витамины как компоненты питания
- •Работа 6. Реакции на витамин р (рутин)
- •Работа 2. Количественное определение витамина а в рыбьем жире
- •Тема 2. Биохимия и патобиохимия крови
- •Тема 3. Функциональная и клеточная биохимия органов и тканей.
- •Литература:
- •Тема 1. Введение в биохимию. Биохимические компоненты клеток 21
Тема 2. Биохимия и патобиохимия крови
Кровь человека составляет примерно 8 % от массы тела. Она состоит из клеток, клеточных фрагментов и плазмы. Доля клеточных элементов в общем объеме называется гематокритом и составляет примерно 45 %.
Кровь выполняет в организме множество разнообразных функций.
Кровь обеспечивает транспорт газов – кислорода и двуокиси углерода; а также переносит питательные вещества к различным органам после всасывания в кишечнике. Кровь обеспечивает обмен веществ между тканями и перенос конечных продуктов метаболизма для их выведения из организма легкими, печенью и почками. Кровь осуществляет также перенос гормонов.
Кровь поддерживает водный баланс между кровеносной системой, клетками и внеклеточной средой. Кислотно-основное равновесие в крови регулируется легкими, печенью и почками.
Кровь обладает механизмами защиты против чужеродных молекул и клеток, проникающих в организм, К специфической защитной системе относятся клетки иммунной системы и антитела.
Для предотвращения кровопотери при повреждении кровеносных сосудов в крови существует эффективная система коагуляции — физиологическое свертывание. Растворение кровяных сгустков (фибринолиз) также обеспечивается кровью.
Клеточными элементами крови являются эритроциты, лейкоциты и тромбоциты.
Плазма крови является водным раствором электролитов, питательных веществ, метаболитов, белков крови и сигнальных веществ. По сравнению с составом цитоплазмы в плазме крови относительно высокие концентрации ионов Na+, Са2+ и Cl–. Напротив, концентрации ионов К+, Mg2+ и фосфата ниже, чем в клетках. Концентрация белков также ниже, чем в клетках.
Жидкая фаза, остающаяся после свертывания крови, называется сывороткой. Она отличается от плазмы тем, что не содержит фибриногена и других белков, которые отделяются при коагуляции крови.
Лабораторная работа 3. Определение концентрации гемоглобина в крови
В состав гемоглобина эритроцитов входят простой белок глобин и простетическая группа гем. Гем – это хелатный комплекс иона железа и порфирина – циклического соединения, которое содержит 4 пиррольных кольца, соединённых метиленовыми мостиками. Глобин состоит из 4 полипептидных цепей, каждая из которых связана с гемом. Один гем способен связывать четыре молекулы кислорода, который переносится от лёгких к тканям. В плазме крови О2 мало растворим.
В тканях образуется СО2 (основной источник – окислительное декарбоксилирование α-кетокислот в митохондриях). Гемоглобин связывает четыре молекулы СО2 N-концевой аминогруппой каждой полипептидной цепи.
Таким образом, гемоглобин в организме выполняет функцию газообмена.
Принцип метода: в присутствии окислителя и цианид-ионов гемоглобин образует в водном растворе цианметгемоглобин, окраска которого пропорциональна содержанию гемоглобина в крови.
Материалы и реактивы:
Окислительный реагент.
Калибровочный раствор гемиглобинцианида (соответствует пробе крови с концентрацией гемоглобина 150 г/л).
Ацетонциангидрин.
Ход работы. Приготовление трансформирующего раствора: содержимое флакона с окислительным реагентом и ампулы с ацетонциангидрином перенести в мерную колбу объёмом 2 л, долить до метки дистиллированной водой и перемешать.
Опытная проба: 0,02 мл крови осторожно перемешать, предотвращая образование пены, с 5 мл трансформирующего раствора, выдержать 15 минут, фотометрировать против трансформирующего раствора при длине волны 540 нм в кюветах толщиной 10 мм.
Калибровочная проба: оптическую плотность калибровочного гемиглобинцианида измерить против трансформирующего раствора.
Концентрацию гемоглобина рассчитать по формуле:
![]() ,
где
,
где
С – концентрация гемоглобина в пробе, г/л;
150 – калибровочная концентрация гемоглобина, г/л;
Е опыт. – оптическая плотность опытной пробы, ед. опт. плотности;
Екал. – оптическая плотность калибровочной пробы, ед. опт. плотности.
Нормальные величины содержания гемоглобина:
0,5–5 лет 110–140 г/л
5–9 лет 115–145 г/л
12–14 лет, М 120–150 г/л; Ж 115–150 г/л
15–17 лет, М 117–166 г/л; Ж 117–153 г/л
18–44 года,М 132–173 г/л; Ж 117–155 г/л
45–64 года,М 131–172 г/л; Ж 117–160 г/л
67–74 года,М 126–174 г/л; Ж 117–161 г/л.
Клинико-диагностическое значение
Уменьшение концентрации гемоглобина является основным лабораторным показателем анемии. Анемия – снижение концентрации гемоглобина в крови, часто при одновременном уменьшении числа эритроцитов. Существуют различные причины возникновения анемий. Рассмотрим некоторые из них:
Серповидноклеточная анемия возникает при образовании мутантного гемоглобина HbS, в β-цепях которого в шестом положении вместо остатка глутаминовой кислоты находится валин. Эта замена сопровождается снижением сродства гемоглобина к кислороду и способностью молекул гемоглобина слипаться с образованием нитеподобных агрегатов. Форма эритроцитов при этом приобретает характерную серповидную форму. Такие эритроциты подвержены гемолизу. Клинические проявления этой болезни варьируют от едва заметных (гетерозиготная форма) до таких, которые приводят к летальному исходу в раннем возрасте (гетерозиготная форма).
Также встречаются формы гемоглобина, в которых глутаминовая кислота в β-цепях в шестом положении заменена на лизин (HbC). Эритроциты, содержащие этот аномальный гемоглобин, также склонны к гемолизу.
Талассемии – гемолитические анемии, которые развиваются вследствие образования аномальных форм гемоглобинов, в которых отсутствуют α- или β-полипептидные цепи.
Мегалобластические анемии часто являются следствием недостатка витаминов, например, витамина B12 (кобаламина). Биохимической основой развития B12-зависимой анемии является нарушение биосинтеза белков и нуклеиновых кислот, что особенно проявляется в тканях с усиленной пролиферацией, к которым относится кроветворная ткань. Эта форма анемии характеризуется значительным уменьшением количества эритроцитов при увеличении их объёма и изменении формы.
Фолиевая кислота (витамин Вс) связана с обменом и биохимическими функциями витамина B12. Болезни, связанные с недостатком этих витаминов, часто протекают совместно и имеют сходную клиническую картину. Макроцитарная анемия является классическим проявлением авитаминоза Вс.
Повышение концентрации гемоглобина наблюдают при миелопролиферативных нарушениях, симптоматическом эритроцитозе.
Для диагностики сахарного диабета определяют уровень гликозилированного гемоглобина. В норме его содержание составляет 5–7 % от общего количества гемоглобина.
Лабораторная работа 4. Количественное определение белка в сыворотке крови методом Кирка
Белки сыворотки крови выполняют различные функции: транспортную, защитную, регуляторную и т. д. Содержание белка в плазме крови является одним из важных показателей белкового обмена.
Принцип метода: белки реагируют c сернокислой медью в щелочной среде с образованием соединений фиолетовой окраски (биуретовая реакция). Интенсивность окраски реакционного раствора прямо пропорциональна концентрации белков в анализируемой сыворотке.
Материалы и реактивы:
1. Калибровочный раствор альбумина (100 2) г/л
2. Биуретовый реагент (концентрированный раствор):
сульфат меди (15,0 0,75) г/л
гидроокись натрия (40,0 2) г/л
калий натрий виннокислый (45,0 2,25),г/л
йодид калия (25,0 1,25) г/л
Ход работы. Анализ проводится согласно схеме, приведенной в таблице 1.
Таблица 1
|
Отмерять в пробирку, мл |
Калибровочная или опытная пробы |
Холостая проба |
|
Калибровочный или опытный раствор |
0,08 |
– |
|
Физиологический раствор |
– |
0,08 |
|
Биуретовый реактив |
4,00 |
4,00 |
|
Смешать, выдержать 30 мин при комнатной температуре (от +18 до +25 0С). Измерять оптическую плотность калибровочной и опытной пробы против холостой при длине волны 540 нм в кюветах с длиной оптического пути 5 или 10 мм. | ||
Концентрацию общего белка в пробе определяют с помощью калибровочного графика. Из калибровочного раствора белка готовят ряд разведений, как отмечено в таблице 2.
Таблица 2
|
|
Пробирки | |||||
|
Холостая |
1 |
2 |
3 |
4 |
5 | |
|
Калибровочный раствор белка (мл) |
0,0 |
0,2 |
0,4 |
0,6 |
0,8 |
1 |
|
Дист. вода (мл) |
1,0 |
0,8 |
0,6 |
0,4 |
0,2 |
0 |
|
Концентрация белка в растворе (г/л) |
0,0
|
20
|
40
|
60
|
80
|
100
|
|
Оптическая плотность (Е) |
– |
|
|
|
|
|
И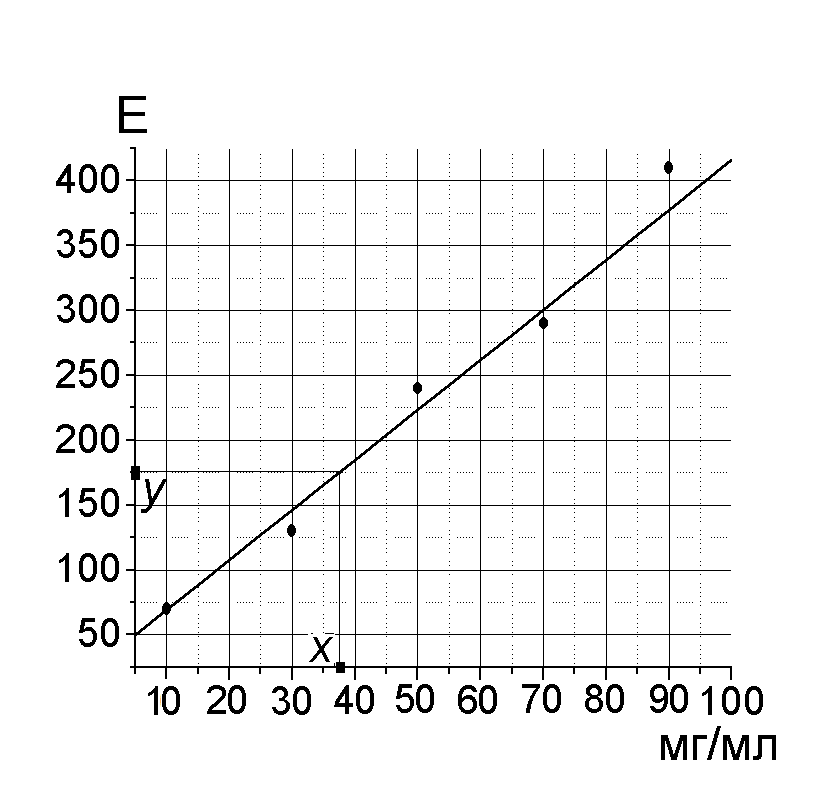 з
полученных растворов отбирают по 0,08 мл
и обрабатывают, как показано в таблице
1.
з
полученных растворов отбирают по 0,08 мл
и обрабатывают, как показано в таблице
1. Определяют оптическую плотность
растворов и строят калибровочный график.
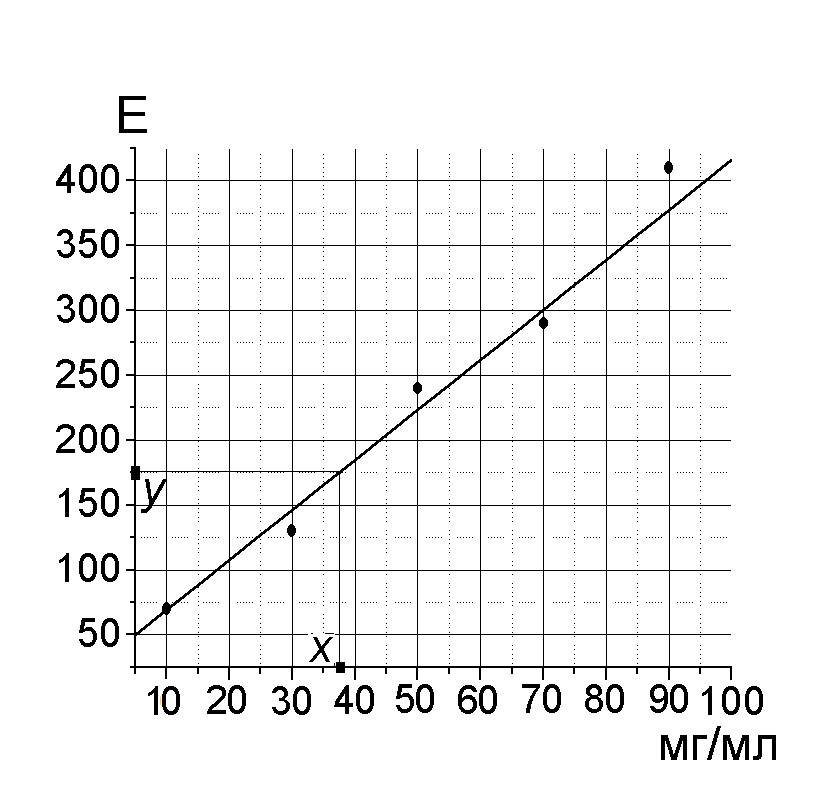
Пример калибровочного графика и расчета
по нему показан на рисунке.
Определяют оптическую плотность
растворов и строят калибровочный график.
Пример калибровочного графика и расчета
по нему показан на рисунке.
Пользуясь графиком, по значению экстинкции опытной пробы (y) находят содержание белка (x). Учтя разведение сыворотки в 10 раз получают содержание белка в 1 мл сыворотки. В норме количество белка в сыворотке составляет 60–80 г/л.
Клинико-диагностическое значение. Чаще всего увеличение количества общего белка в сыворотке крови является следствием дегидратации, которая является результатом потери части внутрисосудистой жидкости или её выхода во внесосудистое пространство. Такое состояние развивается при тяжёлых травмах, ожогах, диарее (например, при холере). При острых инфекционных заболеваниях повышение уровня белка может происходить из-за выброса белков острой фазы. При хронических паразитарных или инфекционных заболеваниях гиперпротеинемия может развиваться вследствие интенсивного протекания иммунного процесса и нарастания количества иммуноглобулинов.
Уменьшение содержания белка в плазме крови может быть следствием задержки воды, например, при сердечной декомпенсации или отёках на фоне цирроза печени. Большие потери белка, например, с мочой при нефритах или через ЖКТ, также могут быть причиной гипопротеинемии, как и нарушения синтеза белка при раковой кахексии, хронических поражениях печени, во время голодания.
Лабораторная работа 5. Определение концентрации фибриногена в плазме крови
Свертывание крови (коагуляция) – сложный физиолого-биохимический процесс, являющийся защитной реакцией организма на потерю крови. Существует два механизма остановки кровотечения: сосудисто-тромбоцитарный гемостаз и коагуляционный гемостаз.
Сосудисто-тромбоцитарный гемостаз является первичной реакцией на поражение микроциркуляторных сосудов. Он обеспечивает остановку потери крови благодаря сосудам и форменным элементам – тромбоцитам и эритроцитам. В случае повреждения кровеносных капилляров наблюдают их рефлекторный спазм, который поддерживается веществами, выделяемыми из тромбоцитов – серотонин, адреналин, норадреналин.
В дальнейшем часть тромбоцитов прикрепляется к коллагеновой сетке эндотелия и субэндотелиальной базальной мембране (адгезия). Другая часть тромбоцитов склеивается между собой по 15– 20 клеток с образованием агрегатов тромбоцитов. Последние прикрепляются к адгезированным тромбоцитам, что приводит к образованию тромба, закрывающего просвет сосудов, и к остановке кровотечения.
Приблизительно такой же механизм остановки кровотечения в сосудах микроциркуляторного русла.
В случае повреждения больших сосудов, особенно с повышенным кровеносным давлением и быстрым кровотоком, в гемостазе принимает участие система свёртывания крови.
Процесс свёртывания крови и образования кровяного сгустка – это каскад последовательных ферментативных реакций, катализируемых специализированными белками – факторами сворачивания. Он протекает в три фазы. Первая фаза – образование тромбокиназы, вторая – образование тромбина, третья фаза – образование фибрина, который составляет основу сгустка.
В результате образуется сгусток крови, который через 15–20 минут начинает стягиваться (ретракция, которая завершается в течение 2–3 часов). Вследствие ретракции сгусток становится компактным и не пропускает даже сыворотку крови.
Проходимость сосудов может быть восстановлена после растворения тромба. Этот процесс происходит благодаря фибринолитической ферментной системе.
Протеолиз фибриногена и фибрина под действием плазмина сопровождается появлением низкомолекулярных продуктов деградации фибрина (ПДФ), которые имеют выраженные антикоагулянтные свойства (угнетают агрегационную функцию тромбицитов). ПДФ вместе с мономерами фибрина образуют растворимые комплексы мономеров фибрина (РКМФ). Окончательными продуктами деградации фибрина является Д-димеры, содержание которых определяют на биохимических анализаторах.
В организме человека есть регуляторы свёртывания крови: стимулирующие – прокоагулянты (витамин К, ионы кальция и др.); противодействующие – антикоагулянты. К ним относятся физиологические антикоагулянты (антитромбины, 1-ингибитор протеиназ, 2-макроглобулин, гепарин); ПДФ, образующиеся в процессе фибринолиза. Кроме того, можно использовать лекарственные препараты из группы дикумаринов (дикумарин, пелентан и др.).
Для предотвращения сворачивания крови или плазмы пользуются различными стабилизаторами: оксалатами, цитратами, гирудином и др.
Методы для количественного определения фибриногена можно разделить на следующие группы:
1. Основаны на осаждении фибриногена, то есть переведение его в фибрин (с помощью тромбина, тромбопластина, коагулаз из змеиных ядов или других ферментов сворачивания крови); образовавшийся фибрин после подсушивания взвешивают (гравиметрический метод) или растворяют, окрашивают и колориметрируют.
2. Методы иммунологического или иммунохимического определения содержания фибриногена.
Работа 1. Гравиметрический метод определения содержания фибриногена по Р. А. Рутберг
Принцип метода. Метод основан на выделении из плазмы фибрина под влиянием хлорида кальция, его высушивании, взвешивании и определении по его массе содержания фибриногена в плазме.
Материалы и реактивы: кровь, раствор цитрата натрия (38 г/л), раствор хлорида кальция (50 г/л).
Ход работы. Венозную кровь смешать с раствором цитрата натрия в соотношении 9 : 1. Центрифугировать на лабораторной центрифуге при скорости 2000 об/мин в течение 5–7 мин. Перенести в другую пробирку 1 мл плазмы, добавить 0,1 мл раствора кальция хлорида и засечь время сворачивания плазмы. В норме сгусток образуется через 7–15 мин. Полученный сгусток перенести на беззольную фильтровальную бумагу. Сушить сгусток, пока не будет заметно следов влаги. Высушенный фибрин немедленно взвешивают на торсионных весах. В норме масса высушенного сгустка, полученного из 1 мл плазмы, составляет 9–15 мг.
Для определения концентрации фибриногена в граммах на литр умножить массу сухого фибрина на экспериментально установленный пересчитанный коэффициент, равный 0,222.
В норме в плазме практически здоровых людей содержание фибриногена колеблется в пределах 2–4 г/л.
Работа 1. Спектрофотометрический метод определения содержания фибриногена по Белицеру
Принцип метода. В случае добавления тромбина в плазму крови образуется сгусток, который высушивают на фильтровальной бумаге и растворяют в уксусной кислоте. Содержание фибриногена определяют спектрофотометрически.
Материалы и реактивы: плазма, фосфатный буфер (0,06 М) с рН 7; 0,15 М раствор хлорида натрия, 0,04 М раствор моноиодуксусной кислоты, 1,5 % раствор уксусной кислоты, тромбин.
Ход работы. В пробирку диаметром 9–10 мм и высотой 85–90 мм поместить 0,2 мл плазмы крови, добавить 1,6 мл 0,06 М фосфатного буфера. Смесь поместить в водяной термостат (37 0С). Спустя несколько минут добавить 0,1 мл 0,04 М раствора монойодуксусной кислоты; через 3 минуты добавить 0,1 мл тромбина. Так как тромбин содержит ионы кальция, то в его добавлении нет необходимости. В случае использования препаратов тромбина, не содержащих кальций, в пробу перед добавлением тромбина добавить 0,1 мл 0,02 М раствора хлорида кальция. После добавления каждого компонента содержание пробирки тщательно перемешать стеклянной палочкой с шершавой поверхностью. Палочку оставить в пробирке. Раствор слить и окончательно выделить сгусток, прижимая палочку к стенкам пробирки и медленно помешивая. Сгусток промыть два раза в 0,15 М раствора хлорида натрия, опуская палочку несколько раз в каждую из двух склянок с раствором (приблизительно по 50 мл). Затем один раз промыть в охлажденной дистиллированной воде. Жидкость для промывания с поверхности сгустка удалить прикосновением фильтровальной бумаги. Полученный сгусток растворить, помешивая, в 5 мл 1,5 % раствора уксусной кислоты. Растворение заканчивается через 5 минут. Содержание белка в растворе определить спектрофотометрически, измеряя экстинкцию при длине волны 280 и 320 нм. Содержание фибриногена (Х) в опыте рассчитывают по формуле:
![]() г/л,
г/л,
где Е (280– 320) – разница между значениями экстинкции при длине волны 280 и 320 нм;
255 – коэффициент для выражения в граммах на литр количества фибриногена во время анализа 0,2 мл плазмы;
15,067 – коэффициент экстинкции (Е1 %, 1 см) для фибрина в уксусной кислоте при длине волны 280 нм.
Клинико-диагностическое значение. Гиперфибриногенемия наблюдается при различных воспалительных процессах из-за ускоренного биосинтеза белков острой фазы и иммуноглобулинов, а также при злокачественных опухолях, лейкозе, острой (инфаркт миокарда) и хронической ишемической болезни сердца.
Гипофибриногенемия развивается при врожденных афибриногенемиях, приобретенных нарушениях синтеза фибриногена (проявляющиеся у больных хроническим гепатитом, циррозом печени, эритремии, при травматическом и посттрансфузионном шоке), тромбогеморрагическом синдроме.
К снижению уровня фибриногена может приводить усиленный фибринолиз и фибриногенолиз, а также рост потребности в фибрине при сосудистом сворачивании крови.
Снижение содержания фибриногена плазмы (фибриногена А) до уровня ниже, чем 1 г/л, может быть фактором риска появления кровотечения из сосудов внутренних органов.
По мере старения организма возрастает содержание фибриногена и, соответственно, повышается коагуляция.
Контрольные вопросы по теме « Биохимия и патобиохимия крови»:
Биохимические и физиологические функции крови в организме человека. Дыхательная функция эритроцитов.
Гемоглобин: механизмы участия в транспортировании кислорода и диоксида углерода. Варианты и патологические формы гемоглобинов человека.
Метаболизм порфиринов: строение гема; схема реакций биосинтеза протопорфирина IХ и гема.
Наследственные нарушения биосинтеза порфиринов, типы порфирий.
Буферные системы крови. Нарушение кислотно-основного баланса в организме (метаболический и респираторный ацидоз, алкалоз).
Биохимический состав крови человека. Белки плазмы крови и их клинико-биохимическая характеристика.
Ферменты плазмы крови; значение в энзимодиагностике заболеваний органов и тканей.
Каллекреин-кининовая система крови и тканей. Лекарственные средства – антагонисты кининообразования.
Небелковые органические соединения плазмы крови.
Неорганические компоненты плазмы крови.
Биохимические и функциональные характеристики системы гемостаза.
Система свёртывания крови; характеристика отдельных факторов; механизмы функционирования каскадной системы свёртывания крови.
Роль витамина К в реакциях коагуляции; лекарственные средства – синергисты и антагонисты витамина К.
Антисвёртывающая система крови; характеристика антикоагулянтов. Наследственные нарушения процесса свёртывания крови.
Фибринолитическая система крови. Лекарственные средства, влияющие на процессы фибринолиза.
Иммуноглобулины; биохимическая характеристика отдельных классов иммуноглобулинов человека.
Медиаторы и гормоны иммунной системы: интерлейкины, интерфероны, белково-пептидные факторы регуляции роста и пролиферации клеток.
Система комплемента; биохимические компоненты системы комплемента человека; классический и альтернативный пути активации.
Биохимические механизмы иммунодефицитных состояний: первичные (наследственные) и вторичные иммунодефициты.
